基于渗透压调控的纽莫康定B 0发酵动力学
2016-01-13章人川,郑嘉琪,肖潇等

基于渗透压调控的纽莫康定B0发酵动力学
章人川,郑嘉琪,肖潇,冯昆达,秦婷婷,宋萍,黄和
(南京工业大学生物与制药工程学院,江苏南京,211800)
摘要:以海洋丝状真菌Glarea lozoyensis Q45为研究对象,研究不同渗透压条件下Glarea lozoyensis Q45的生长、底物甘露醇消耗以及纽莫康定B0的生产特性。基于Logistics方程、Luedeking-Piret方程和Luedeking-Piret-Like 方程,得到了描述纽莫康定B0发酵模型的动力学参数。基于发酵动力学模型,提出了在菌体生长稳定期添加1.61 g/L NaCl的调控策略。在该策略下,纽莫康定B0的产量达到1.75 g/L,比初始条件的结果提高24.6%。
关键词:纽莫康定B0;渗透压; 发酵动力学;Glarea lozoyensis
doi:10.3969/j.issn.1672-3678.2015.06.012
收稿日期:2015-03-11
基金项目:国家自然科学基金(21306084)
作者简介:章人川(1990—),男,福建福州人,硕士研究生,研究方向:微生物次级代谢产物;黄 和(联系人),教授,E-mail:biotech@njtech.edu.cn
中图分类号:Q93
文献标志码:A
文章编号:1672-3678(2015)06-0065-05
Abstract:The fermentation kinetic models for Glarea lozoyensis Q45 were established to describe the effect of different osmotic pressure conditions for cell growth,consumption of mannitol and production of pneumocandin B0.Based on Logistics equation,Luedeking-Piret equation and Luedeking-Piret Like equation,the kinetic parameters of different osmotic pressure were analyzed.An osmotic pressure stage-controlled strategy,with 1.61 g/L NaCl added during the stationary phase,was suggested and experimentally verified.Following this strategy,the final production of pneumocandin B0 was 1.75 g/L,increased by 24.6%.
Keywords:pneumocandin B0;osmotic pressure;fermentation kinetic;Glarea lozoyensis
Fermentation kinetic model of pneumocandin B 0 based onosmotic pressure stage-controlled
ZHANG Renchuan,ZHENG Jiaqi,XIAO Xiao,FENG Kunda,QIN Tingting,SONG Ping,HUANG He
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
海洋丝状真菌Glarealozoyensis的次级代谢产物纽莫康定B0是抗真菌药物卡泊芬净的前体,由一个环状的六肽母核以及一个脂肪酸链组成。卡泊芬净作为一种新型的广谱抗真菌药物——棘白菌素类抗真菌药物,能选择性地抑制真菌细胞壁β-1,3葡聚糖的合成,在抗真菌药物领域受到人们广泛的关注[1-3]。
渗透压对大部分微生物的生长具有显著影响,细胞会通过合成用于调节胞内渗透压的物质来适应环境的变化。王玉磊等在研究产朊假丝酵母发酵的盐胁迫时发现,添加适当的Na+和K+能提高谷胱甘肽和S-腺苷蛋氨酸的联产产量。曾艳等研究裂殖壶菌时发现,一定浓度的渗透压胁迫使二十二碳六烯酸(DHA)产量提升46.84%。姜玮等在研究游动放线菌合成阿卡波糖的过程中发现,在前期维持较低的渗透压772.5 kPa,在中后期维持1 030~1 288 kPa,最终50 L发酵罐的效价提升50%。
目前,相关学者已就渗透压对G.lozoyensis发酵的影响以及G.lozoyensis发酵产纽莫康定B0的工业放大[9-11]进行过研究,但对G.lozoyensis发酵动力学进行研究的很少。发酵动力学能通过数学模型描绘微生物代谢来减少传统经验型发酵调控的盲目性。因此,本研究中,笔者构建基于渗透压调控的G.lozoyensis产纽莫康定B0的分批发酵动力学模型,研究在最优初始渗透压发酵条件下G.lozoyensis发酵过程中的菌体生长,底物消耗以及产物合成的潜在规律,并初步探讨渗透压对菌体生理代谢的影响方式。
1材料与方法
1.1 实验材料
1.1.1菌种
菌株GlarealozoyensisQ45,中国典型培养物保藏中心(CCTCC)保藏,保藏日期2014年9月14日,保藏编号为CCTCC M 2014416。
1.1.2培养基
PDA固体培养基(g/L):去皮马铃薯200.0,蔗糖20.0,琼脂20.0。
种子培养基(g/L):葡萄糖 40.0,黄豆粉 20.0,玉米浆 10.0,KH2PO410.0,微量元素 10.0。
微量元素(g/L):FeSO4·7H2O 1.0,MnSO4·H2O 1.0,ZnSO4·7H2O 0.2,CaCl2·2H2O 0.1,HBO30.056,CuCl2·2H2O 0.025,(NH4)5MO7O24·4H2O 0.003。
发酵培养基(g/L):甘露醇 80,玉米蛋白粉 10,K2HPO42.5。
1.1.3实验材料
甘露醇标准品购自西格玛奥德里奇(上海)贸易有限公司,其余试剂均购自国药集团试剂公司的分析纯试剂。
LC-20AB型高效液相色谱购自岛津(中国)有限公司,U3000型高效液相色谱购自赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1培养方法
发酵培养:自斜面取2 cm2菌苔至50 mL种子培养基中,26 ℃、220 r/min培养5 d。以10%的接种量接入装有50 mL发酵培养基的250 mL锥形瓶中,26 ℃、220 r/min培养15 d。
1.2.2检测方法
甘露醇检测采用岛津高效液相色谱LC Solution工作站测定。色谱柱Aminex HPX-87P柱(300 mm×7.8 mm),流动相为超纯水,流速1 mL/min,检测器为示差折光检测器(RID-10A),柱温80 ℃,进样量20 μL。
生物量检测采用菌体干质量浓度法,80 ℃烘干至恒质量。
纽莫康定B0检测采用戴安高效液相色谱U3000测定。色谱柱Venusil MP C18柱(250 mm×4.6 mm),流动相A为乙腈,流动相B为0.1 %的H3PO4。洗脱程序 :0~20 min,V(A)∶V(B)=40∶60;20~40 min,V(A)∶V(B)=50∶50,流速1 mL/min。检测器为紫外检测器,检测波长210 nm,柱温35 ℃,进样量20 μL。
1.2.3渗透压计算方法
培养基中总渗透压为电解质和非电解质之和,计算方法参照文献[12]。
目前,用于模拟菌体生长的非结构模型主要为Monod方程和Logistic方程[13]。G.lozoyensisQ45发酵生产纽莫康定B0的过程中,菌体生长符合Logistic方程,Logistic菌体生长动力学模型见式(1)。
(1)
式中:X为菌体质量浓度(g/L);Xm为最大菌体质量浓度(g/L);μm为最大比生长速率(d-1);t为发酵时间(d)。
产物生成动力学模型:纽莫康定B0的合成与菌体的生长应归于部分生长偶联型。因此,选用Luedekin-Piret方程来描述G.lozoyensisQ45菌合成纽莫康定B0的速率[14],见式(2)。
(2)
式中:P表示纽莫康定B0质量浓度(g/L),α表示生长偶联的产物合成系数,β表示非生长偶联的产物合成系数。当α≠0、β=0时,为产物形成与细胞生长偶联型;α≠0、β≠0时,为产物形成与细胞生长部分偶联型;α=0、β≠0时,为产物形成与细胞生长非偶联型。
底物消耗动力学模型:纽莫康定B0分批发酵过程中,甘露醇作为碳源和能源用于菌体生长,维持菌体新陈代谢以及次级代谢产物的合成。底物消耗动力学可采用Luedekin-Piret-Like方程来表示[15],见式(3)。
(3)
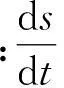
发酵动力学参数计算:用Matlab7软件工具包中lsqcurvefit参数对上述公式进行非线性最小二乘法拟合。
2结果与讨论
2.1 渗透压对 G. lozoyensis Q45产纽莫康定B 0的影响
考察渗透压对菌体底物消耗与产物合成的相互影响,结果如图1所示。由图1可知:高浓度甘露醇80 g/L(1 132.31 kPa)条件下纽莫康定B0的产量是低浓度40 g/L(566.16 kPa)的4.96倍。在低浓度甘露醇条件下,添加终质量浓度为6.44 g/L(566.16 kPa)的NaCl使渗透压回到高浓度甘露醇的渗透压,纽莫康定B0产量较低浓度时提高191.4%。底物消耗方面,NaCl的添加使底物甘露醇的消耗速度减缓。因此,渗透压对G.lozoyensisQ45的发酵产纽莫康定过程和菌体代谢有着重要影响。但是纽莫康定B0产量并没有回复到高浓度的水平,可能是初始甘露醇浓度不够,没有足够的底物维持细胞和产量的合成。因此,在下阶段实验中,采用80 g/L甘露醇作为底物质量浓度。
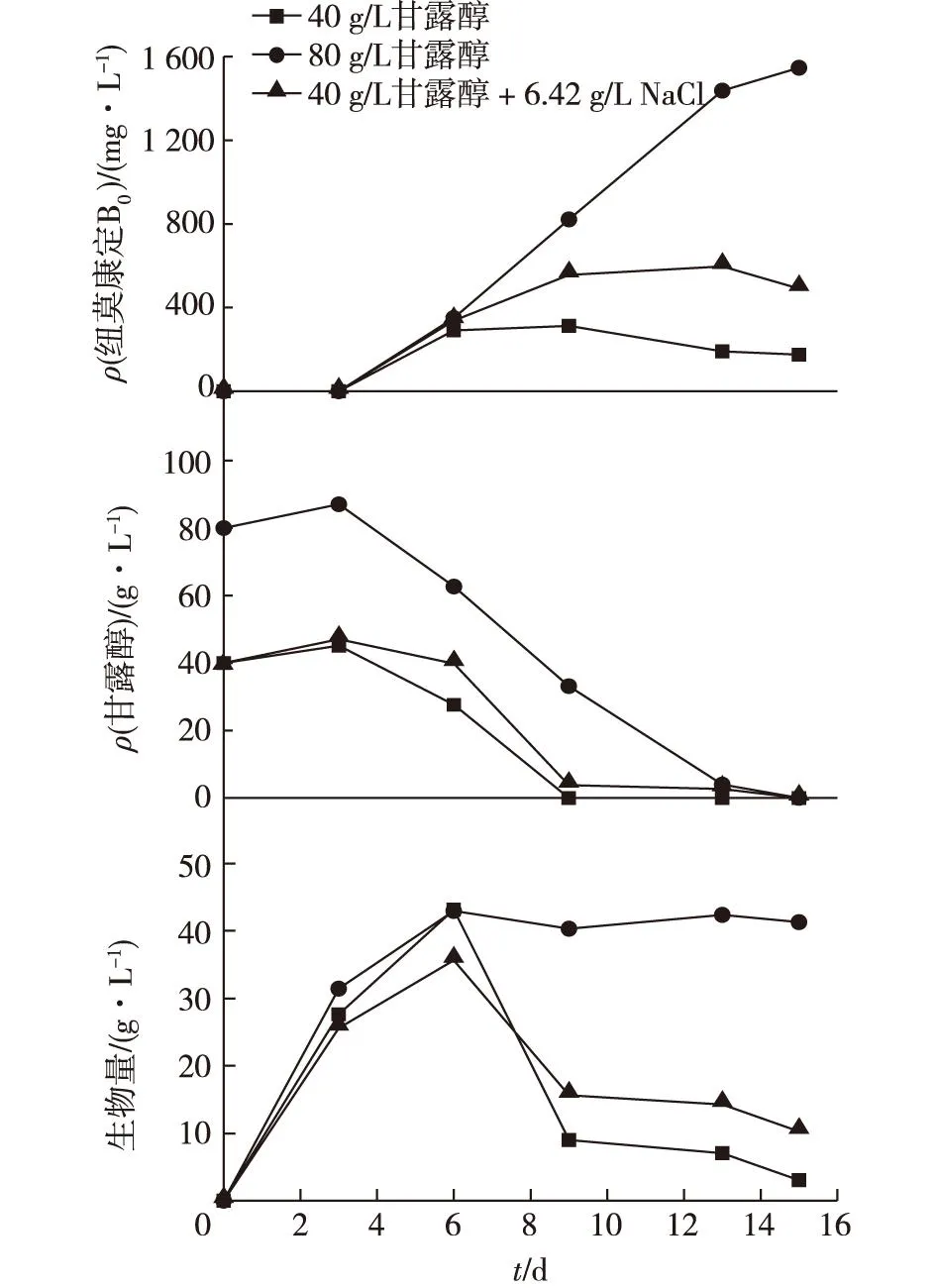
图1 渗透压对纽莫康定B 0发酵的影响 Fig.1 Effects of the osmotic pressure on pneumocandin B 0 fermentation
2.2 NaCl浓度对 G. lozoyensis Q45产纽莫康定B 0的影响
考虑到6.42 g/L NaCl所提供的渗透压(相当于40 g/L甘露醇)已经较大,所以在80 g/L甘露醇基础上添加NaCl的时候,以添加6.42 g/L NaCl为最高值,以倍数关系做递减,考察不同初始NaCl溶液条件下纽莫康定B0的发酵情况,结果如图2所示。由图2可知:G.lozoyensisQ45生长过程可分为3个阶段。在迟滞期(Ⅰ阶段,0~2 d),碳源消耗速度缓慢,菌体生长缓慢,同时产物少量合成;在对数期(Ⅱ 阶段,2~6 d),菌体快速生长,产物合成以及碳源消耗速度略微加快;在稳定期(Ⅲ 阶段,6~15 d),菌体生长趋于稳定,此时,在碳源大量消耗的基础上,产物开始大量合成。同时,随着NaCl浓度的增加,甘露醇消耗速度减缓,生物量的积累减少,纽莫康定B0的合成速度和最大产量先增加后减少。 在迟滞期添加1.61 g/L NaCl,纽莫康定B0产量相比添加3.22 g/L和6.24 g/L NaCl的实验组分别提高15.4%和21.5%,因此,确定1.61 g/L NaCl为最优添加量。
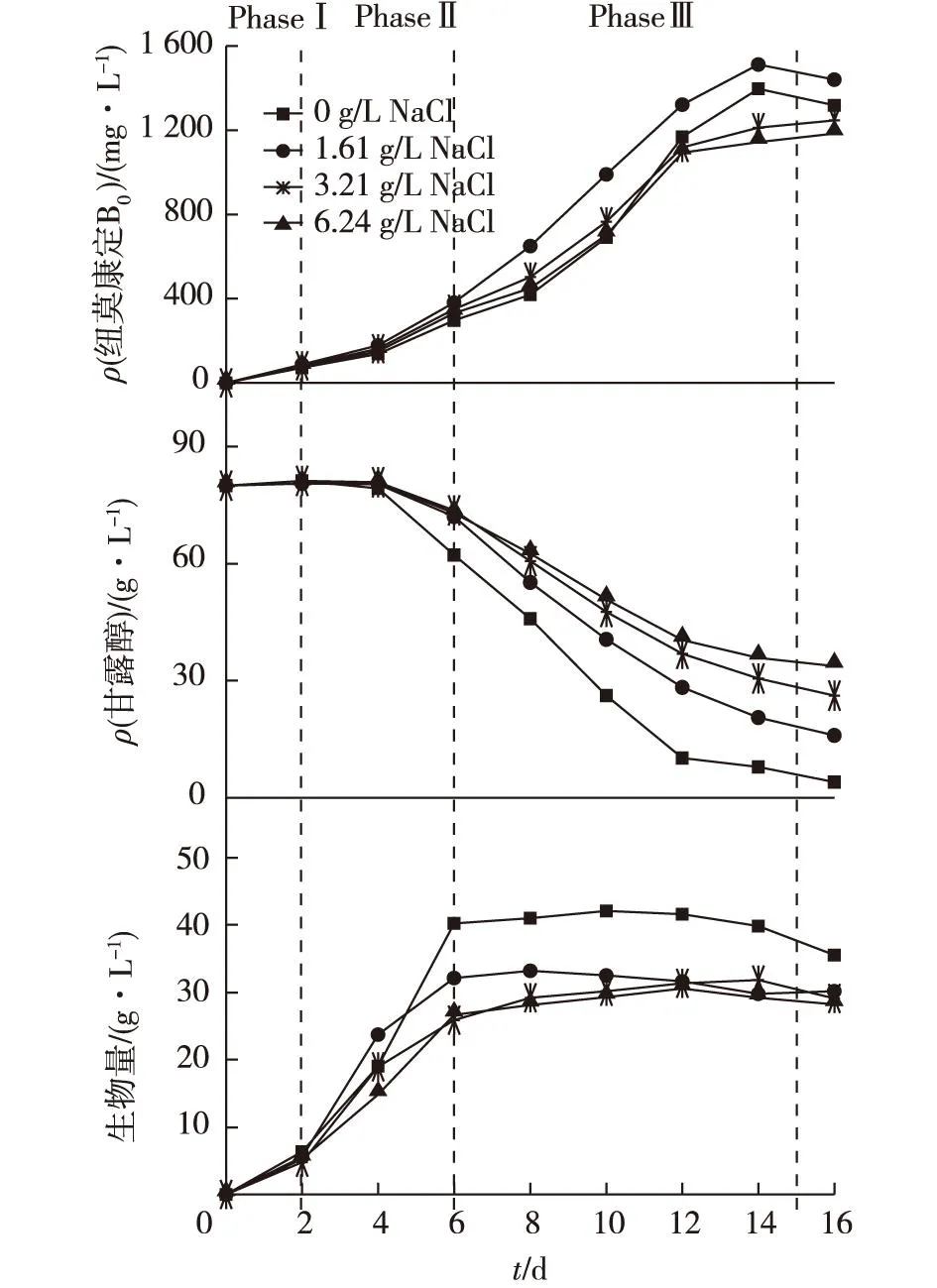
图2 NaCl质量浓度对纽莫康定B 0发酵过程的影响 Fig.2 Effects of NaCl concentration on pneumocand in B 0 fermentation
2.3 发酵动力学模型的建立与分析
2.3.1发酵动力学模型的建立
为了验证模型的适用范围,分别以8%~12%初始菌体浓度(即接种量)以及60~100 g/L初始底物质量浓度作为考察范围,研究不同接种量计算值与实验值的相对误差,结果如表1所示。由表1可知:当接种量在±20%之内时,菌体生长、底物消耗的实验值与计算值的平均相对误差均在5%之内,产物合成的平均相对误差在10%以内。当初始底物质量浓度在70~90 g/L范围内时,菌体生长、底物消耗和产物合成模型的相对误差均控制在5%以内,当初始底物质量浓度在60和100 g/L时,菌体生长和产物合成的平均相对误差均超过10%,说明底物浓度相比发酵接种量对发酵阶段菌体生长的影响更大(表2)。
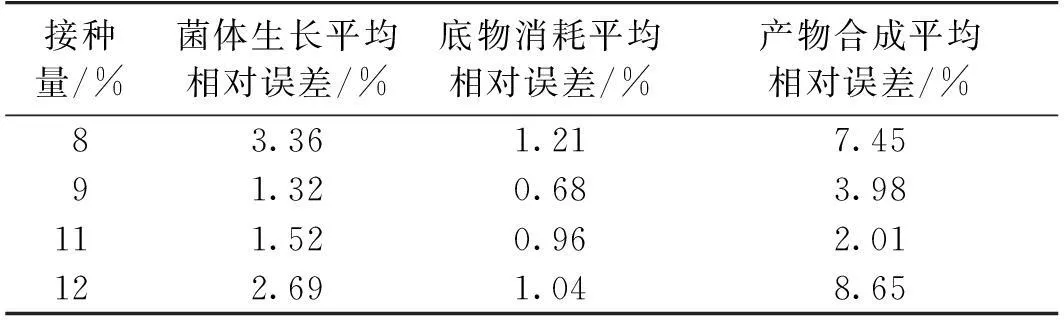
表1 接种量计算值与实验值的相对误差
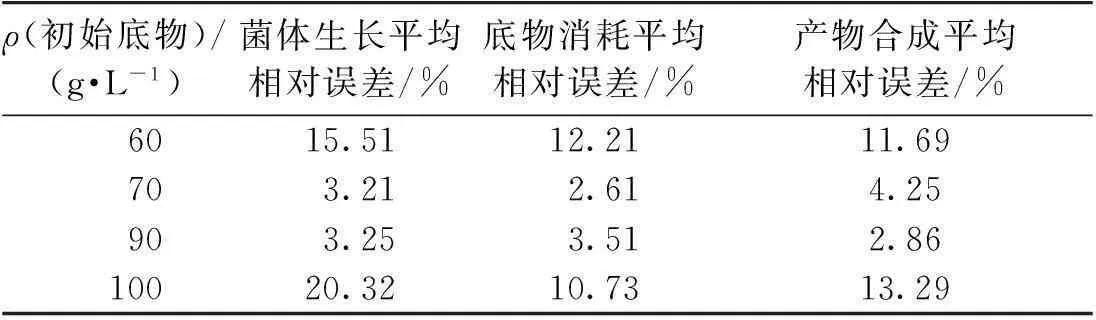
表2 底物浓度计算值与实验值的相对误差
该模型在初始菌体质量浓度(2.76±0.552) g/L、初始底物质量浓度(80±10) g/L范围内能得到很好的应用。
2.3.2渗透压对发酵动力学参数影响
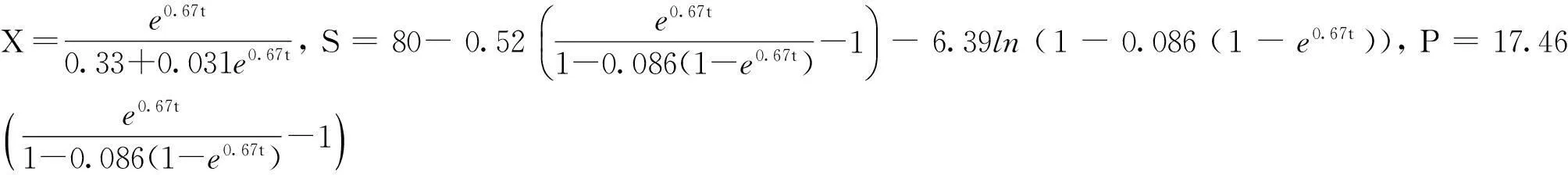
2.4 基于发酵动力学研究的渗透压调控策略
基于以上的动力学参数分析,NaCl对纽莫康定B0发酵的影响如下:①降低菌体的生长速度;②促使底物的消耗流向纽莫康定B0合成方向。考虑到纽莫康定B0是次级代谢产物,产物合成需要生物量的积累[16],因此,研究不同阶段NaCl的添加对产物合成的影响,结果如图3所示。由图3可知:稳定期(12 d)添加1.61 g/L NaCl使纽莫康定B0的产量提升24.6%,与在迟滞期(0天)和对数期(4 d)添加1.61 g/L NaCl相比,分别提高21.28%和15.47%。因此,此结果验证了基于发酵动力学参数分析提出的渗透压调控策略是可行的。

图3 不同生长阶段NaCl添加对产量的影响 Fig.3 Effects of NaCl added in different growth phase for production
可以从以下两个方面尝试解释NaCl对纽莫康定B0合成存在的双面影响:①由于纽莫康定B0合成菌株G.lozoyensisQ45属于海洋丝状真菌,其天然的生长环境本身就存在一定程度的渗透压,因此NaCl的添加一定程度上模拟了菌体的最适生长环境,导致产物合成的增加;②Na+的添加会改变微生物细胞膜上Ca2+通道的流量,使得细胞膜上的磷脂酶信号被激活,从而影响钙调磷激酶响应的锌指蛋白,最终提高胞内次级代谢产物的合成[17], 因此,推测在纽莫康定B0的合成中,Na+也起到同样效果。
3结论
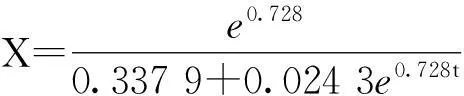
根据不同渗透压条件下动力学参数的分析,提出在生长稳定期添加NaCl的调控策略。在前期维持较高的菌体比生长速率,使得菌体达到更高的生物量,在后期添加NaCl溶液,降低菌体用于维持自身代谢的相关系数,提高产物合成相关系数,使菌体积累足够生物量的同时实现产物的高浓度积累。对所提出的发酵控制策略进行验证,通过在稳定期中期流加NaCl的策略,产量与80 g/L条件相比,提高24.6%,达到1.75 g/L。
参考文献:
[1]Wichmann C F,Liesch J M,Schwartz R E.L-671 329,a new antifungal agent:Ⅱ.structure determination.J Antibiot,1989,42(2):168-173.
[2]Fromtling R A,Abruzzo G K.L-671 329,a new antifungal agent:Ⅲ.invitro activity,toxicity and efficacy in comparison to aculeacin.J Antibiot,1989,42(2):174-178.
[3]Sawistowskaschroder E T,Kerridge D,Perry H.Echinocandin inhibition of 1,3-beta-d-glucan synthase fromCandidaalbicans.FEBS Lett,1984,173(1):134-138.
[4]Yancey P H,Clark M E,Hand S C,et al.Living with water-stress-evolution of osmolyte systems.Science,1982,217:1214-1222.
[5]王玉磊,叶子优,贺秋萍,等.S-腺苷蛋氨酸和谷胱甘肽联产发酵中盐胁迫的作用.生物加工过程,2012,10(3):33-38.
[6]曾艳,冯云,仝倩倩,等.渗透压调控对裂殖壶菌发酵产DHA的影响.生物加工过程,2012,10(6):24-28.
[7]姜玮,生英涛,蔡月明,等.麦芽糖浓度和渗透压对游动放线菌生长及阿卡波糖生物合成的综合影响.中国医药工业杂志,2010,41(3):178-182.
[8]Connors N,Petersen L,Hughes R,et al.Residual fructose and osmolality affect the levels of pneumocandins B0and C0produced byGlarealozoyensis.Appl Microbiol Biotechnol,2000,54(6):814-818.
[9]Pollard D J,Buccino R,Connors N C,et al.Real-time analyte monitoring of a fungal fermentation,at pilot scale,using in situ mid-infrared spectroscopy.Bioproc Biosyst Eng,2001,24(1):13-24.
[10]Pollard D J,Hunt G R,Kirschner T F,et al.Rheological characterization of a fungal fermentation for the production of pneumocandin.Bioproc Biosyst Eng,2002,24(6):373-383.
[11]Pollard D J,Kirschner T F,Hunt G R,et al.Scale up of a viscous fungal fermentation:application of scale-up criteria with regime analysis and operating boundary conditions.Biotechnol Bioeng,2007,96(2):307-317.
[12]Wright P J,Reed R H.Method for determination of turgot pressure in macroalgae,with particular reference to the phaeophyta.Marine Biology,1988,99:473-480.
[13]Feng J,Zhang J S,Jia W,et al.An unstructured kinetic model for the improvement of triterpenes production byGanodermalucidumG0119 based on nitrogen source effect.Bioprocess Biosyst Eng,2014,19(4):727-732.
[14]Luedeking R,Piret E L.A kinetic study of the lactic acid fermentation batch process at controlled pH.Biotechnol Bioeng,2000,67(6):636-644.
[15]张扬,冯小海,李莎,等.Kitasatosporasp.MY5-36产ε-聚赖氨酸分批补料发酵动力学.生物加工过程,2012,10(3):23-27.
[16]Papagianni M.Fungal morphology and metabolite production in submerged mycelial processes.Biotechnol Adv,2004,22(3):189-259.
[17]Xu Y N,Xia X X,Zhong J J.Induced effect of Na plus on ganoderic acid biosynthesis in static liquid culture ofGanodermalucidumvia calcineurin signal transduction.Biotechnol Bioeng,2013,110(7):1913-1923.
(责任编辑管珺)
