白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响
2016-01-11成薇,沈长波,王莉等
网络出版时间:2014-12-4 13:45网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.024.html
白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响
成薇,沈长波,王莉,余萍萍,杨琴
(重庆医科大学附属第一医院神经内科,重庆400016)
中国图书分类号:R-332;R284.1;R322.81;R329.24;R845.22
摘要:目的研究白藜芦醇预处理对体外氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响。方法采用悬浮培养法分离纯化新生SD大鼠大脑皮质神经干细胞。第3代贴壁培养神经干细胞氧糖剥夺150 min后,复氧培养24 h。实验分为正常组、对照组、乙醇组和不同浓度白藜芦醇预处理组。免疫荧光法鉴定细胞,CCK-8法检测细胞活力,流式细胞周期及BrdU法检测细胞增殖。结果悬浮及贴壁培养细胞均高表达巢蛋白(nestin)。与对照组和乙醇组相比,不同浓度白藜芦醇预处理组(1、5、20 μmol·L`(-1))均能明显增强细胞活力,促进细胞增殖,其中以5 μmol·L`(-1)白藜芦醇组作用最强(P<0.05)。结论白藜芦醇预处理能减轻氧糖剥夺/再复氧对神经干细胞的损伤,并促进其增殖。
关键词:白藜芦醇;不同浓度;预处理;神经干细胞;氧糖剥夺;再复氧损伤;细胞增殖
doi:10.3969/j.issn.1001-1978.2015.01.024
文章编号:
文献标志码:A1001-1978(2015)01-0113-06
收稿日期:2014-09-01,修回日期:2014-10-11
基金项目:国家自然科学基金面上项目(No 81071119);国家神经病学临床重点专科建设项目(卫办、医政函[2012]649号]2012年)
作者简介:成薇(1990-),女,硕士生,E-mail:w289045916@163.com;
通讯作者杨琴(1970-),女,博士,教授,研究方向:脑血管疾病与干细胞移殖,,E-mail:xyqh200@126.com
Abstract:AimTo study the proliferative effect of resveratrol pretreatment on oxygen-glucose deprivation/reoxygenation(OGD/R)injury of rat cortical neural stem cells(NSCs)in vitro.MethodsIsolation and purification of NSCs in neonatal Sprague-Dawley(SD)rats were conducted by suspended cultivation. The third passage NSCs of adherent culture was cultured under oxygen and glucose deprivation for 150 min and reoxygenation for 24 h. The experimental subjects were divided into normal, control, ethanol and resveratrol pretreatment groups. Immunofluorescence was used to identify NSCs. Cell viability was detected with CCK-8 assay. Flow cytometry cell cycle and BrdU assay were used to measure cell proliferation. ResultsCells both in suspended and adherent cultivation highly expressed neuroepithelial stem cell protein(nestin). Compared with the control group,NSCs viabilities and proliferation in resveratrol groups (1, 5, 20 μmol·L`(-1)) were significantly heightened,and highest in the 5 μmol·L`(-1) resveratrol group (P<0.05). ConclusionResveratrol pretreatment can reduce injury and promote proliferation of NSCs after oxygen-glucose deprivation / reoxygenation.
在发育和成熟哺乳动物神经系统中,神经干细胞(neural stem cells,NSCs)的发现为中枢神经系统(CNS)的损伤修复带来了希望。在正常状态下,成年哺乳动物神经生发区的NSCs处于静止状态。在各种原因导致脑损害的病理条件下,神经生发区的NSCs针对环境的变化被激活,调整增殖、迁移、分化速度,并整合到靶区,以促进神经功能恢复。因此,在各种脑损害后,通过各种药物或方法激活内源性NSCs,增强或调整干细胞的再生反应,并迁移至靶区进一步分化与整合,从而促进神经功能恢复,将是今后内源性NSCs动员治疗神经系统疾病的方向。
白藜芦醇(resveratrol,Res)是多酚类植物抗毒素, 广泛存在于葡萄(红葡萄酒)、桑葚、虎杖、决明子、花生等多种植物中,具有抗氧化、清除体内自由基、增强机体免疫以及抗癌、抗菌抗炎等作用,起到降脂、延缓衰老,具有神经保护作用[1-2]。在脑缺血的不同时间窗给予Res均可减轻脑缺血性损伤,减少神经元凋亡[3-4]。在脑损害后,Res能否激活内源性NSCs,促进其增值、迁移、分化、整合呢? Park 等[5]发现Res抑制正常神经前体细胞的增殖和健康成年大鼠海马的神经发生,而Moriya 等[6]则发现Res能增强慢性疲劳小鼠海马的神经发生,改善疲劳症状,减轻海马萎缩。在缺血性脑损害后,Res能否促进NSCs的增殖呢?目前鲜有报道。因此本实验拟采用体外氧糖剥夺/再复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)损伤模型模拟体内脑缺血/再灌注损伤模型,观察Res预处理对NSCs增殖的影响。
1材料与方法
1.1实验动物健康新生1~3 d内Sprague-Dawley(SD)大鼠,♀♂不限,由重庆医科大学实验动物中心提供,动物合格证号:SCXK(渝)20070001。
1.2主要试剂DMEM/F-12(1 ∶1)、B-27添加剂购自Gibco公司,D-Hanks液、胎牛血清购自Hyclone公司,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮细胞生长因子(epidermal growth factor,EGF)购自Peprotech公司,溴脱氧尿苷(5-bromodeoxyuridine,BrdU)购自Suolaibao Technology公司,白藜芦醇(纯度 ≥99%) 购自Sigma公司。 鼠抗Nestin多克隆抗体和BrdU单克隆抗体分别购自Santa Cruz和Cell Signaling Technology公司。FITC和TRITC标记羊抗鼠IgG、山羊封闭血清购自北京中杉金桥公司。CCK-8试剂盒、多聚赖氨酸(Poly-L-lysine)溶液、DAPI染色液购自碧云天生物技术有限公司。其他试剂均为国产分析纯。
参考文献1.3神经干细胞的分离培养`([7])的方法,取新生1~3 d内SD大鼠,浸入体积分数为0.75酒精中消毒5 min,无菌条件下剥离全脑,去除小脑,保留余下部分。 DMEM/F12培养液冲洗干净,仔细剥离大脑皮质表面的血管和脑膜,将其剪成约1 mm`3的小块。吸入离心管,静置3 min,吸去上清液,1 000×g离心5 min,去除上清液,加体积分数为0.00125胰蛋白酶,置37℃培养箱中消化30 min,中间摇晃1次,用等体积含体积分数为0.1胎牛血清的DMEM/F12培养液终止消化。巴氏管轻轻吹打混匀,用200目钢筛网滤过,1 000×g离心5 min,去除上清液,加入神经干细胞完全培养液(DMEM/F12,体积分数为0.02 的B27,体积分数为0.01的青、链霉素,浓度为20 μg·L`(-1)的 bFGF和EGF),巴氏管吹打成单细胞悬液,400目钢筛网滤过,调整接种密度为3×10`8~5×10`8·L`(-1),接种于50 cm`2玻璃培养瓶内,置于37℃、饱和湿度、体积分数为0.05 CO2培养箱中悬浮培养。每隔2~3 d半量换液,每7 d传代。每天观察细胞生长情况。悬浮培养至P3后,接种于预先用0.1 g·L`(-1)多聚赖氨酸处理过的或其包被过盖玻片的培养板内贴壁培养`([8]),用于后续研究。
1.4神经干细胞氧糖剥夺/再复氧(OGD/R)损伤模型的构建参考已建立的方法[9],除去神经干细胞完全培养液,D-Hanks液清洗3次,将培养液改为D-Hanks液,置于37℃三气培养箱缺氧150 min,通以体积分数分别为0.01 O2、0.05 CO2和0.94 N2厌氧混合气体。氧糖剥夺后将细胞培养液更换为神经干细胞完全培养液,并置于37℃、饱和湿度、体积分数为0.05 CO2培养箱中复氧培养24 h。
1.5实验分组实验分为正常组(normal, Norm)、对照组(control, Ctrl)、乙醇组(ethanol, Eth)和 白藜芦醇预处理组(Res)。正常组,贴壁培养的神经干细胞正常培养;对照组,贴壁培养的神经干细胞氧糖剥夺150 min,再复氧24 h;乙醇组,即Res溶剂对照组, 用含乙醇体积分数为0.013的完全培养基预处理贴壁培养神经干细胞24 h,再行OGD/R处理;Res预处理组,用含不同浓度(1、5、20 μmol·L-1) Res的完全培养基预处理贴壁培养的神经干细胞24 h,随后行OGD/R处理。
1.6免疫细胞化学染色除去神经干细胞完全培养液,PBS缓冲液漂洗3次,每次5 min。用体积分数为0.04多聚甲醛室温固定30 min,PBS漂洗3次;体积分数为0.001 Triton X-100室温下破膜30 min, PBS漂洗3次,每次5 min;山羊工作血清室温封闭30 min,吸去血清,不洗;加入一抗(Nestin 1 ∶100,BrdU 1 ∶200),阴性对照组用PBS缓冲液替代一抗,4℃过夜;PBS漂洗3次,加入荧光标记二抗(抗体工作浓度1 ∶100),37℃避光孵育1 h;PBS漂洗3次,DAPI染核3~5 min;再用PBS漂洗3次,体积分数为0.5甘油封片,倒置荧光显微镜照相。
1.7CCK-8法测定细胞活力将传代的神经干细胞球消化成单细胞悬液,接种至96孔培养板,每组6个复孔,每孔100 μL体系,细胞密度5×103个/孔。OGD/R后,吸去96孔培养板内培养液,每孔避光加入100 μL含体积分数为0.1 CCK-8溶液的神经干细胞完全培养液,37℃孵育4 h后终止培养,摇床室温振荡5~10 min。使用空白对照孔调零,在酶标仪上测定450 nm处吸光度值,结果以OD值表示。实验重复3次,取3次实验结果的平均值作为实验结果。
1.8流式细胞学法检测细胞周期取对数期生长的神经球,消化成单细胞接种于6孔板内,每孔调整密度至1×106个。氧糖剥夺再复氧终止后,用体积分数为0.0025胰蛋白酶将细胞消化成单细胞悬液,体积分数为0.1胎牛血清中和胰蛋白酶,1 000×g离心5 min,弃去上清液,缓慢加入体积分数为0.7的 4℃预冷乙醇固定,4℃固定细胞至少5 h。离心去除乙醇固定液,PBS离心洗涤两次,加入RNase A 37℃水浴30 min,再加入PI染液混匀,4℃避光孵育30 min,每组检测1×104个细胞。实验重复3次,测定各细胞周期所占百分比。
1.9BrdU法检测神经干细胞增殖收集神经干细胞前向培养液中避光加入10 μmol·L-1BrdU 37℃孵育24 h,弃去完全培养液,PBS洗涤3次,每次5 min,体积分数为0.04多聚甲醛室温下固定30 min行免疫荧光染色。每组在10×10倍显微镜下随机计数5个视野下BrdU阳性细胞数,计算阳性细胞率/%=阳性细胞总数/活细胞总数 ×100%。
2结果
2.1神经干细胞的鉴定传代细胞克隆球或消化吹散成的单细胞经Nestin间接免疫荧光染色,可见神经干细胞特异性标记物Nestin阳性,见Fig 1。
2.2白藜芦醇对OGD/R损伤后神经干细胞活力的影响CCK-8法检测结果显示,正常组(0.838±0.016)细胞活力最高,白藜芦醇预处理各组(0.494±0.005、0.570±0.007、 0.489±0.009)细胞活力较对照组(0.460±0.003)和乙醇组(0.455±0.005)明显增强(P<0.05),其中浓度为5 μmol·L-1白藜芦醇组最强,1 μmol·L-1白藜芦醇组次之,见Fig 2。

Fig 1Identification of neural stem cells
(FITC DAPI, Scale bars =100 μm)
A-C: Neurosphere was identified by the representative marker Nestin (green). B: A neurosphere was observed under a light microscope. D-F: Neural stem cells were identified by the representative marker Nestin (green) as adherent monolayer culture. E: Nuclei were labeled with DAPI
2.3白藜芦醇对OGD/R损伤后神经干细胞增殖的影响 首先采用流式细胞学法检测细胞周期。

Fig 2Effects of resveratrol on NSCs viability after OGD/R injury(n=3)
Norm: Normal group; Ctrl: Control (OGD/R) group; Eth: Ethanol group; Res 1: Resveratrol 1 μmol·L-1group; Res 5: Resveratrol 5 μmol·L-1group; Res 20: Resveratrol 20 μmol·L-1group; Blank: Nothing but the NSCs complete medium;▲P<0.05vsNorm;*P<0.05vsCtrl;#P<0.05vsRes 5>
细胞周期分为G0/G1期、S期、G2/M期。其中S期为细胞DNA合成期,代表细胞增殖期,通常与G2/M期(DNA合成后期)百分比之和所占细胞周期比值即增殖指数[ PI=(G0/G1+S)/(G0/G1+S+G2/M)]表示细胞增殖活性。流式细胞学法周期结果显示,正常组(3.8%±1.9%)细胞增殖指数PI低于其
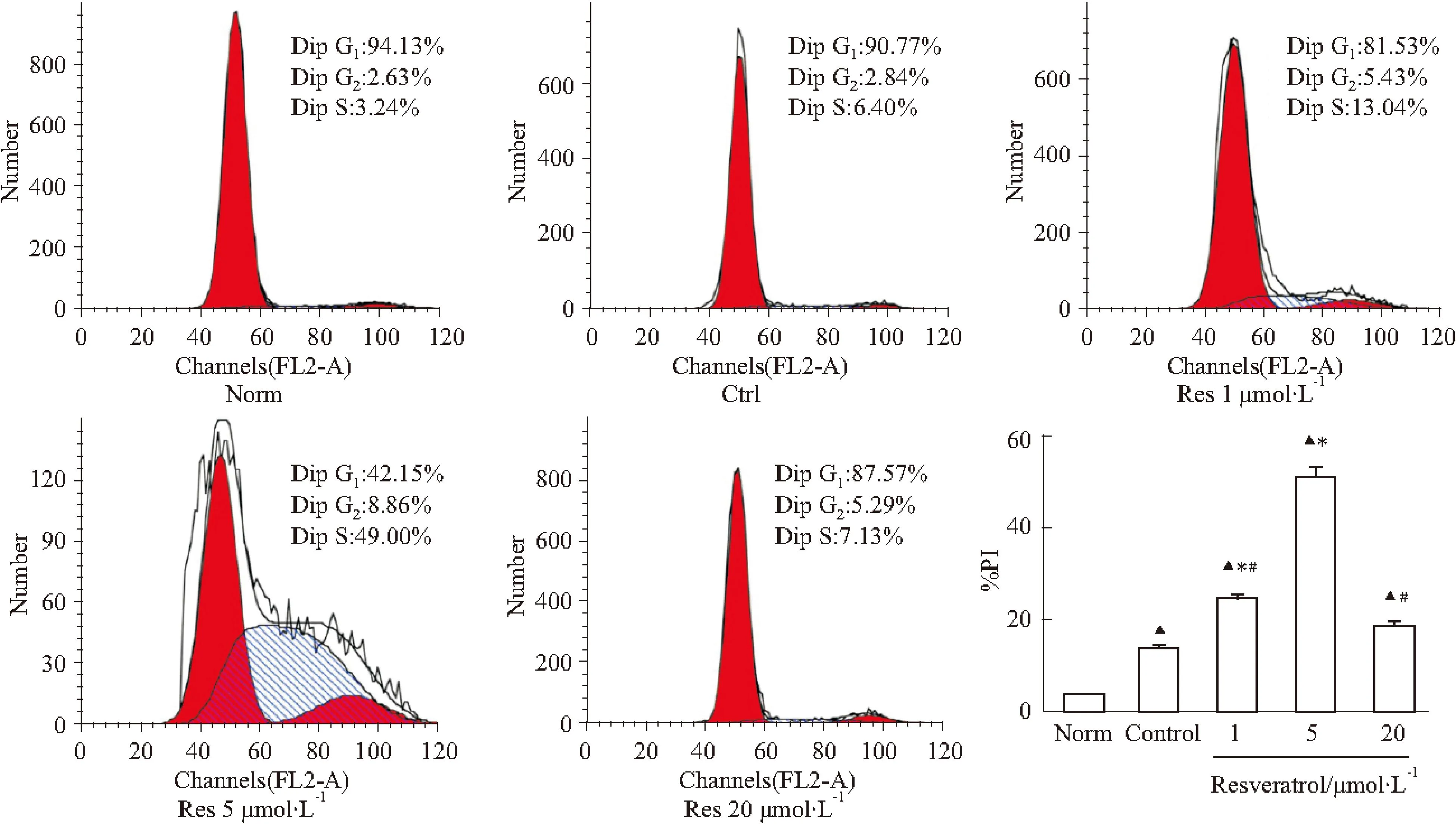
Fig 3 Effects of resveratrol on the cell cycle of NSCs after OGD/R injury( n=3)
Norm: Normal group; Ctrl: Control (OGD/R) group; Res 1: Resveratrol 1 μmol·L-1group; Res 5: Resveratrol 5 μmol·L-1group; Res 20: Resveratrol 20 μmol·L-1group;▲P<0.05vsNorm;*P<0.05vsCtrl;#P<0.05vsRes 5
他各组。加入不同浓度的Res,细胞增殖指数PI(24.2%±5.1%、50.6%±6.6%、18.8%±5.6%)均较对照组(13.7%±3.9%)明显增高,其中5 μmol·L-1白藜芦醇组最高(P<0.05),1 μmol·L-1白藜芦醇组次之(P<0.05),表明Res能促进神经干细胞增殖,见Fig 3。
其次采用BrdU免疫荧光法检测细胞增殖。BrdU为胸腺嘧啶的衍生物,可代替胸腺嘧啶在DNA合成期(S期)进入细胞。活体注射或细胞培养加入,而后利用抗BrdU单克隆抗体,免疫细胞化学染色,显示增殖细胞。结果显示,正常组(6.3%±0.4%)BrdU阳性细胞数百分比低于其他各组。加入不同浓度的Res,细胞BrdU阳性细胞数百分比(26.8%±1.6%、37.9%±2.6%、16.5%±1.2%)均较对照组(13.5%±1.3%)明显增高,其中5 μmol·L-1白藜芦醇组最高(P<0.05),1 μmol·L-1白藜芦醇组次之(P<0.05)。结果也表明白藜芦醇能促进神经干细胞增殖。见Fig 4。
3讨论
以往的观点认为,成年哺乳动物CNS的神经再生非常有限,而且随着年龄的增长,神经元数量会逐渐减少。然而近10余年的研究表明,发育中和成年哺乳动物室管膜、室下区、海马齿状回颗粒细胞层下区和嗅球、皮质等区域终身存在具有自我更新和分化功能的神经干细胞,神经发生终身存在,这为CNS损伤修复带来了新的希望[10]。正常情况下,神经生发区干细胞处于休眠状态。在病理条件下,干细胞被激活、增殖、迁移、分化、整合,从而促进神经功能恢复,但这种能力是有限的。因此,神经科学研究者期望能找到一些药物或方法促进生发区干细胞的增殖、迁移、分化、整合。

Fig 4 Effects of resveratrol on proliferation of NSCs
A-C: Normal group; D-F: Control (OGD/R) group; G-I: Resveratrol 1 μmol·L-1group; J-L: Resveratrol 5 μmol·L-1group; M-O: Resveratrol 20 μmol·L-1group; P: The percentage of BrdU+cells in each group; The proliferation of NSCs(white arrow); Scale bars=75μm;▲P<0.05vsNorm;*P<0.05vsCtrl;#P<0.05vsRes 5
缺血性脑卒中具有致死率、 致残率、 复发率高的特点。如何改善治疗、促进脑卒中患者神经功能恢复是神经科学研究者亟待探索解决的重大课题,亦是面临的最难以逾越的严峻挑战。Res是一种主要存在于葡萄、藜芦、虎杖等植物中的多酚类物质。研究发现地中海地区饮食习惯可明显降低心脑血管疾病的发生率,其原因是饮食中含丰富的Res[11]。随后大量的体内外实验均证实Res具有抗肿瘤、抗炎、抗氧化、清除自由基、抗血小板聚集、抗动脉粥样硬化及神经保护等多种药理活性[12-13]。本实验在体外采用OGD/R模型模拟体内脑缺血/再灌注损伤,观察Res对NSCs的影响。结果表明,与正常组相比,体外OGD/R损伤后可引起NSCs增殖。CCK-8法检测显示不同浓度Res 20: Res预处理均可增强OGD/R后NSCs的活力,其中以5 μmol·L-1白藜芦醇组细胞活力最强,1 μmol·L-1白藜芦醇组次之。流式细胞学细胞周期检测发现,Res预处理较对照组能明显减少NSCs G0/G1期(DNA合成前期)细胞比例,增加S期(DNA合成期)和G2/M期(DNA合成后期)细胞比例,其中5 μmol·L-1白藜芦醇组最明显,1 μmol·L-1白藜芦醇组次之。BrdU增殖检测也证实Res具有相似效应。结果表明Res呈剂量依赖性地减轻OGD/R对NSCs的损伤,促进NSCs增殖。Harada 等[14]观察到Res能增强大鼠海马齿状回神经发生,改善认知功能障碍。Moriya 等[6]也发现Res能增强慢性疲劳小鼠海马的神经发生,减轻海马萎缩,改善疲劳症状。我们的研究结果与这二者的研究均显示Res能促进损伤后NSCs的增殖。本课题组前期的体内外研究以及文献报道表明Res能减轻缺血对神经元的损伤,减少脑梗死体积,改善神经功能[1,3,15-16]。目前的研究又显示Res能促进损伤后NSCs的增殖。这表明Res可能具有神经保护和促神经发生的双重作用。
本实验结果表明,Res预处理对OGD/R损伤后的大鼠皮质NSCs有剂量依赖性促增殖作用。Res能否促进体内脑缺血性损伤后NSCs的增殖,从而改善神经功能,并且其促增殖的机制又是如何的,则有待进一步研究。
[1]Ren J W, Fan C C, Chen N, et al.Resveratrol pretreatment attenuates cerebral ischemic injury by upregulating expression of transcription factor Nrf2 and HO-1 in rats[J].NeurochemRes, 2011, 36(12): 2352-62.
[2]任俊伟, 杨琴. 白藜芦醇对脑缺血/再灌注氧化应激损伤保护机制的研究进展[J].中国药理学通报,2011,27(4) :448-51.
[2]Ren J W, Yang Q. Protective mechanism of resveratrol on cerebral ischemia/reperfusion injury via amerliorating oxidative stress[J].ChinPharmacolBull, 2011, 27(4):448-51.
[3]Huang T, Gao D, Jiang X, et al. Resveratrol inhibits oxygen-glucose deprivation-induced MMP-3 expression and cell apoptosis in primary cortical cells via the NF-κB pathway[J].MolMedRep, 2014, 10(2):1065-71.
[4]沈长波,黄家贵,张黎黎,等. 白藜芦醇在缺氧缺糖再灌注损伤不同时间窗对大鼠皮质神经元氧化应激的影响[J]. 第二军医大学学报,2013,34(7): 708-13.
[4]Shen C B, Huang J G, Zhang L L, et al. Effect of resveratrol on oxidative stress of rat primary cortical neurons during different time windows of oxygen-glucose deprivation/reperfusion injury[J].AcadJSecMilitMedUniv, 2013, 34(7): 708-13.
[5]Park H R, Kong K H, Yu B P, et al. Resveratrol inhibits the proliferation of neural progenitor cells and hippocampal neurogenesis[J].JBiolChem, 2012, 287(51):42588-600.
[6]Moriya J, Chen R, Yamakawa J, et al. Resveratrol improves hippocampal atrophy in chronic fatigue mice by enhancing neurogenesis and inhibiting apoptosis of granular cells[J].BiolPharmBull, 2011, 34(3):354-9.
[7]杨琴,曾志磊,谢鹏,等. 新生大鼠神经干细胞的体外培养和鉴定[J]. 重庆医科大学学报,2007,32(11): 1134-7.
[7]Yang Q, Zeng Z L, Xie P, et al. Identification and cultivation of neural stem cells in neonatal ratsinvitro[J].JChongqingMedUniv, 2007, 32(11): 1134-7.
[8]Babu H, Claasen J H, Kannan S, et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus[J].FrontNeurosci, 2011, 5 (89):1-10.
[9]Chen T, Liu W, Chao X, et al. Neuroprotective effect of osthole against oxygen and glucose deprivation in rat cortical neurons: involvement of mitogen-activated protein kinase pathway[J].Neurosci, 2011, 183(2):203-11.
[10]Zhang L, Chopp M, Meier D H, et al. Sonic hedgehog signaling pathway mediates cerebrolysin-improved neurological function after stroke[J].Stroke, 2013, 44(7):1965-72.
[11]De Lorgeril M, Salen P, Martin J L, et al. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study[J].Circulation, 1999, 99:779-85.
[12]方芳,李珍,王烈成,等. 白藜芦醇预处理对局灶性脑缺血/再灌注大鼠海马CA1区神经元凋亡的保护作用和机制[J]. 中国药理学通报,2012,28(11):1544-8.
[12]Fang F, Li Z, Wang L C, et al. Protective effects of preconditioning with resveratrol on focal cerebral ischemia/reperfusion induced neuronal apoptosis in rat hippocampal CA1 region[J].ChinPharmacolBull, 2012, 28(11):1544-8.
[13]韩宁,殷安安,章翔,等. 白藜芦醇预处理对神经干细胞氧糖剥夺损伤的保护作用[J]. 中华神经外科疾病研究杂志,2014,13(1): 23-6.
[13]Han N, Yin A A, Zhang X, et al. Resveratrol preconditioning protects neural stem cells from oxygen-glucose deprivation injury[J].ChinJNeurosurgDisRes, 2014, 13(1): 23-6.
[14]Harada N, Zhao J, Kurihara H, et al. Resveratrol improves cognitive function in mice by increasing production of insulin-like growth factor-I in the hippocampus[J].JNutrBiochem, 2011, 22(12):1150-9.
[15]黄家贵,张黎黎,沈长波,等. 白藜芦醇在缺糖缺氧/再灌注损伤不同时间窗对大鼠皮质神经元的保护作用[J]. 中国药理学通报,2013,29(9): 1230-4.
[15]Huang J G, Zhang L L, Shen C B, et al. Effects of resveratrol on oxygen and glucose deprivation/reoxygenation injury of rat primary cortical neurons at different time windows[J].ChinPharmacolBull, 2013, 29(9):1230-4.
[16]张黎黎,黄家贵,沈长波,等. 白藜芦醇预处理对缺糖缺氧再灌注大鼠原代皮质神经元的保护作用[J]. 中成药,2014,36(5): 897-903.
[16]Zhang L L, Huang J G, Shen C B, et al. Effect of resveratrol on rat primary cortical neurons during oxygen and glucose deprivation/reperfusion injury[J].ChinTraditPatentMed, 2014, 36(5): 897-903.
Effect of resveratrol pretreatment on proliferation of cortical neural stem
cells after oxygen-glucose deprivation/reoxygenation injury in rats
CHENG Wei, SHEN Chang-bo, WANG Li, YU Ping-ping, YANG Qin
(DeptofNeurology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Key words: resveratrol; different concentrations; pretreatment; neural stem cells; oxygen-glucose deprivation; reoxygenation injury; proliferation
