去除二硫键和蛋白残基对银杏抗菌蛋白构象的影响
2016-01-02史晓璇
史晓璇,陈 洪
(中南林业科技大学 材料科学与工程学院,湖南 长沙 410004)
去除二硫键和蛋白残基对银杏抗菌蛋白构象的影响
史晓璇,陈 洪
(中南林业科技大学 材料科学与工程学院,湖南 长沙 410004)
通过分子动力学模拟,研究了二硫键以及蛋白自身残基在维持蛋白构象稳定中起到的作用,对野生型、截断型和突变型的银杏抗菌蛋白Ginkbilobin-2(Gnk-2)的构象变化进行了分析。结果表明:在100 ns的模拟时间内,造成蛋白构象发生显著变化的主要原因,是蛋白自身残基的缺失,而短时间内二硫键在维持蛋白结构稳定方面的作用并不明显。仅通过比较短时间内模拟所得到的截断型和野生型蛋白的结构变化无法判断二硫键对蛋白结构稳定性的影响。这与文献中仅通过100 ns的时间内模拟野生型和截断型蛋白均方根位移(RMSD)值的变化趋势,便判断出二硫键的断裂是引发蛋白构象发生显著变化的主要原因的看法,是不一致的。这些结果对揭示二硫键以及蛋白自身残基在维持蛋白质空间构象及其生物活性中所起的作用具有重要的意义。并且对银杏抗菌蛋白的深入研究和开发也提供了理论支持。
分子动力学模拟;二硫键;蛋白自身残基;银杏抗菌蛋白;结构稳定
抗菌蛋白可以有效降低病原菌对农作物的危害,避免农作物生产遭受巨大损失。因此,近年来利用生物技术研究抗菌蛋白成为了研究的热点。银杏Ginkgo biloba起源古老,寿命可达3 000年以上,被称为植物“活化石”。自然界的银杏树几乎不会感染疾病,银杏的抗菌能力吸引了许多学者的研究[1-10]。银杏抗菌蛋白Ginkbilobin-2(Gnk-2)是银杏种子的胚乳中发现的一种新型抗菌蛋白,是一种含有108个氨基酸的成熟蛋白质,可以抑制植物病原真菌如尖孢镰刀菌的生长[11]。Gnk-2蛋白中含有三个二硫键,在蛋白质稳定性方面有重要的作用。
一般而言,二硫键,同时也可被称作二硫桥,是一种在蛋白结构稳定性以及聚集性方面有重要作用的共价键。二硫键是2个-SH基被氧化而形成的—S—S—形式的硫原子间的键。在生物化学的领域中,通常是指在肽和蛋白质分子中的半胱氨酸残基中的键。巯基之间想要形成二硫键必须要包含以下三个要素:可及性,相互邻近,可以相互反应[12-14]。关于半胱氨酸形成二硫键的条件,Creighton[15]就立体化学方面提出了三点准则:(1)硫原子之间的距离为2.05±0.03Å,(2) 形成二硫键的硫原子与β-carbon原子间的角度接近103°,(3) 两个β-carbon原子的方向与二硫键旋转±90°后的方向一致。两个硫原子相互作用的能量大约为300-430 kJ/mol[14],因此这种相互作用的缺失会使蛋白质产生显著的构象变化。二硫键在维持蛋白质结构、稳定性以及功能方面的作用各不相同。关于二硫键在不同蛋白质结构和动力学性能方面的作用,学者也已经在一系列实验[16-20]和模拟计算[21-28]中开展了相关研究。而为研究去除二硫键会导致蛋白构象所发生的变化,前人也已经陆续得到了一些实验结果[16-18]:二硫键的去除会降低蛋白的结构稳定性,也会扰乱和减弱蛋白局部区域的活动。
二硫键的改性需要极端严苛的实验条件以及先进的实验技术[29],尤其是在避免蛋白质的空间结构以及极性的冲突方面。而分子动力学模拟的方法可以较容易改性蛋白质并观测蛋白结构和动力学特性的变化。目前为止,分子动力学模拟的方法已经被用于研究各种蛋白的结构特性[26-28]。在分子动力学模拟的过程中,研究人员通常通过去除形成二硫键的半胱氨酸残基的方式来达到去除二硫键的目的,得到截断型蛋白[26-28]。2006年,Qin Meng等[25]研究了淀粉酶抑肽Tendamistat中的二硫键的折叠作用,模拟结果表明二硫键以及氢键对于蛋白的折叠至关重要,在去除二硫键的情况下,蛋白的稳定性大大降低。Moghaddam等学者[26]利用分子动力学模拟研究了二硫键在蝎毒素scorpion toxin Lqh III 1000 ps内的作用。模拟结果表明,二硫键虽然不是强化自身位置结构最重要的影响因素,但是二硫键在整个蛋白质结构中起到了重要的作用。2012年,Castellanos等[27]研究了二硫键在人体血清蛋白Human Serum Albumin(HSA)中所起到的作用。他们认为70 ns之中的去除二硫键的HSA结构变化是来源于二硫键的缺失。同样,2014年Ning LuLu等学者[28]在朊病毒蛋白Prion Protein中,针对特定的二硫键 Cys179-Cys214进行了分子动力学模拟研究。在100 ns的模拟中,作者将变异型和截断型蛋白质结构的变化直接归因于二硫键的缺失,认为二硫键对蛋白稳定性有重要的作用。然而,通过此种方式得到的截断型蛋白的构象变化将不可以再单一的归结为是二硫键的去除。因为二硫键的去除同时也会造成蛋白质自身残基的缺失,蛋白自身残基的缺失同样会对蛋白构象的稳定性造成一定的影响。
因此,本研究的主要目的就是以含三个二硫键的银杏抗菌蛋白Gnk-2为例,通过分子动力学模拟来探究短时间(100 ns)内造成蛋白构象发生显著变化、影响蛋白构象稳定性的主要原因究竟是蛋白自身残基的缺失还是二硫键的去除。这从分子水平上揭示二硫键以及蛋白自身残基对蛋白构象稳定性的影响机制具有重要的理论意义。同时,通过对影响Gnk-2蛋白质因素的研究,可以为转基因抗病种的获得以及生物制药抗生素的研制提供基础的理论。
1 模型与方法
1.1 抗菌蛋白Gnk-2模型
采用PDB数据库中编号为3A2E的银杏抗菌蛋白分子为模型蛋白,删除四聚体中的其他原子,得到抗菌蛋白单体,如图1所示。野生型Gnk-2的三级结构是由两个α-helix和一个 five-stranded β-sheet构成的,形成了一个紧凑的单体结构[30]。在β-sheet中,折叠的顺序从一头到另一头是1-4-5-3-2.所有的折叠呈现反平行的方向。野生型Gnk-2蛋白的半胱氨酸残基形成了三个分子内的二硫键,这三个二硫键分别是:Cys10-Cys86,Cys62-Cys71,和Cys74-Cys99。这三个二硫键是在H2 helix和三个β-sheet之间形成的(S1,S3和S5),Gnk-2的结构以及二硫键Cys10-Cys86, Cys62-Cys71,和 Cys74-Cys99在其中的分布如图1所示。
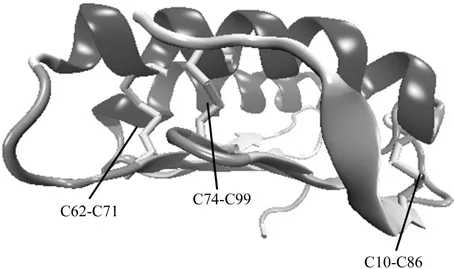
图1 抗菌蛋白Gnk-2模型中的三个二硫键Fig.1 Three disul fide bonds in Gnk-2 protein
分子动力学模拟过程中用到的截断型蛋白是通过建模的方法去除野生型蛋白的某个残基所得,突变型蛋白是把野生型蛋白的半胱氨酸残基突变为丙氨酸残基所得。
1.2 分子动力学模拟方法
文章中所有的分子动力学模拟都是使用了GROMACS4.6和AMBER99力场。模拟中使用的方法和条件的设置借鉴了以前的工作[27-28]。模拟系统的水箱设置要避免边界效应,分子系统到水箱边界的距离至少1 nm。为了模拟真实的系统,水箱中添加了溶剂和合适浓度的离子,并且添加反电荷的离子以保证系统的电中性。由于温度的升高可以加速蛋白质构象变化而不影响蛋白结构变化的路径,为了在合理的时间内观察到蛋白质构象的变化,模拟温度选定为360 K。这样,既可以合理加速构象变化的过程又不至于对蛋白构象造成破坏[31-32]。所有的分子动力学模拟的温度设定为360 K,压强设定为1 bar,pH值设定为7.0。时间步长设定为2 fs,输出数据设定为每5步更新一次。化学键的设定使用了LINCS算法[33]。范德瓦尔斯力的截断长度和短程静电相互作用半径都设置为1 nm。Particle Mesh Ewald (PME)[34]被用来计算长程静电相互作用。Velocity-rescaling 算法[35]被用来控制温度,Berendsen算法[36]用于控制压强。能量最小化使用了 steepest descent method,模拟于50 000 步内完成。
系统在动力学模拟之前,分别做了10 000步的能量最小化以及时长为100 ps的NVT松弛和100 ps的NPT松弛。系统动力学模拟结束后所得到的分子运动轨迹的分析,查看以及蛋白分子微观构象图的制作均使用VMD 1.9.1[37]完成。
1.3 分析方法
蛋白的均方根位移D(root mean square deviation)计算如下:以晶体结构为参照,根据式(1)计算t时刻的构象中各原子坐标与天然构象中对应坐标的均方根偏差
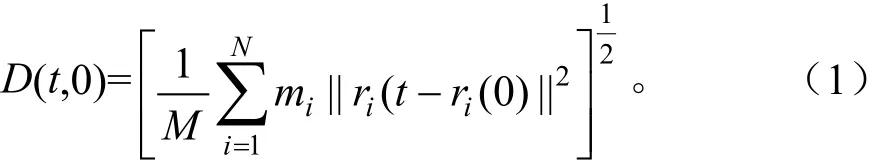
式中mi为各原子的原子量,M为各原子的原子量之和,ri(t)和ri(0)分别表示原子i在t时刻和0时刻的位置坐标。D的值反应了特定构象与天然结构的相似程度,其值越低,表明蛋白越接近天然构象,反之,则代表差异越大。
2 结果与讨论
2.1 野生型,截断型和突变型Gnk-2的构象稳定性
为了了解二硫键以及蛋白自身残基在银杏抗菌蛋白Gnk-2的结构稳定性中所起到的作用,我们采用分子动力学模拟的方法,研究了100 ns内野生型、截断型和突变型Gnk-2的构象变化,并计算出了模拟过程中Gnk-2蛋白主链的均方根偏差。
2.1 分子内二硫键断裂的截断型Gnk-2
图2(a)给出了360 K的情况下,野生型和74截断型Gnk-2整体结构D的变化。其中74截断型Gnk-2是去除野生型Gnk-2中74位置上的半胱氨酸残基后模拟所得,分子内二硫键Cys74-Cys99遭到破坏。图中可以看出:(1) 在100 ns的模拟时间内,野生型和74截断型Gnk-2的D值较模拟起始阶段均有所升高,即在水溶液的环境中,野生型和74截断型Gnk-2的整体结构均发生变化。这源于高温下,银杏抗菌蛋白Gnk-2分子结构的热涨落和水分子对Gnk-2的攻击。(2)野生型Gnk-2的D值在模拟后期稳定在0.2 nm之下,而74截断型Gnk-2的D值在模拟后期达到0.3 nm之上。即野生型Gnk-2在模拟过程中的D值相对较低,而74截断型Gnk-2在模拟过程中的D值相对较高,变化显著。这说明野生型Gnk-2的结构稳定性显著高于74截断型Gnk-2,也就是说由于74截断型Gnk-2中,74位置上半胱氨酸残基的缺失,导致蛋白构象发生了显著变化。
74位置上半胱氨酸残基的缺失会对蛋白构象的变化产生两方面的影响,第一,半胱氨酸残基缺失所导致的Gnk-2分子内二硫键Cys74-Cys99的破坏,会对蛋白构象的稳定性产生一定的影响,第二,半胱氨酸残基的缺失使蛋白二级结构H2 helix自身构象发生变化,这也会对蛋白构象的稳定性产生一定的影响。这两方面的影响均有可能使74截断型Gnk-2的整体结构发生失稳,导致模拟过程中D值的增大。为了探究影响蛋白构象变化的主要原因,我们对模拟轨迹做了进一步的分析。
图2(b)给出了360 K的情况下,截断型银杏抗菌蛋白Gnk-2整体结构的D值与该蛋白Gnk-2二级结构H2 helix的D值的变化。结果表明,在100 ns的模拟时间内,截断型银杏抗菌蛋白Gnk-2整体结构的D值的变化与该蛋白二级结构H2 helix的D值的变化趋势基本一致:与模拟起始状态相比,均有所升高,在模拟后期,RMSD值均稳定在0.3 nm之上。因此,我们推测,在100 ns的模拟时间内,74截断型银杏抗菌蛋白Gnk-2蛋白构象的变化主要是由二级结构H2 helix的自身结构变化引起的。也就是说,模拟过程中74截断型抗菌蛋白Gnk-2之所以会发生显著的构象变化的主要原因,并不是因为去掉了74位置上的半胱氨酸残基所导致的Cys74-Cys99之间二硫键的破坏,而是因为去掉了74位置上的半胱氨酸残基,导致H2 helix自身结构发生了变化。
图2(c)和图2(d)给出了相同模拟环境下Gnk-2分子内另外一对二硫键Cys62-Cys71模拟轨迹的数据情况,同理,我们可以分析得出与前一种情况相似的实验结论。

图2 二硫键断裂的截断型Gnk-2的结果。Fig. 2 The results for reduced Gnk2 in the absence of Cys74-Cys99 disul fide bond (R74).
以上两种情况的模拟结果说明,在100 ns的模拟时间内,截断型Gnk-2二级结构H2 helix 自身残基的缺失,才是引发模拟过程中两种截断型蛋白整体构象发生变化的主要原因,这与前人文献[27-28]中仅通过野生型和截断型蛋白D值的变化趋势,便判断出二硫键的断裂是引发蛋白构象发生显著变化的主要原因,并由此推理出二硫键在维持蛋白构象稳定性中发挥重要作用的看法,是不一致的。
2.2 分子内二硫键未断裂的截断型Gnk-2
为了验证蛋白构象发生变化的主要原因是蛋白自身残基的缺失,而不是蛋白分子内二硫键的断裂,我们做了如下分析。
图3(a)给出了360 K的情况下,野生型和72截断型Gnk-2整体结构D的变化。其中72截断型Gnk-2是去除野生型Gnk-2中72位置上的苏氨酸残基所得,分子内二硫键未遭到破坏。图中可以看出:(1) 在100 ns的模拟时间内,野生型和72截断型Gnk-2的D值与模拟起始阶段相比较,均有所升高。也就是说,在水溶液的环境中,野生型和72截断型蛋白的整体构象均发生变化,与71截断型和74截断型蛋白的原因一致,都是温度升高,Gnk-2分子结构的热涨落和水分子的布朗运动所致。(2) 野生型Gnk-2的D值在模拟后期稳定在0.2 nm上下,而72截断型Gnk-2的D值在模拟后期达到0.35 nm以上,这与74截断型和71截断型的结果一致(见图1至2)。即野生型Gnk-2在模拟过程中的D值相对较低,而72截断型Gnk-2在模拟过程中的D值相对较高,变化显著。这说明野生型Gnk-2的结构稳定性显著高于72截断型Gnk-2。也就是说由于截断型Gnk-2 72位置上苏氨酸残基的缺失,引发了蛋白构象发生显著的变化。
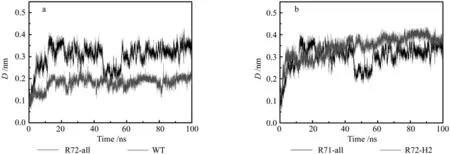
图3 二硫键未断裂的截断型Gnk-2的结果Fig. 3 The results for reduced Gnk2 in the presence of the disul fide bonds (R72)
由于72位置上的苏氨酸残基并不参与二硫键的形成,故此残基的缺失只会对蛋白构象变化产生一种影响,就是使蛋白二级结构H2 helix自身构象发生变化,从而影响蛋白构象的稳定性,使模拟过程中的D值增大。也就是说,模拟过程中,蛋白构象发生显著变化的主要原因是二级结构H2 helix 残基的缺失。
同时,图3(b) 给出了360 K的情况下,72截断型抗菌蛋白Gnk-2整体结构的D值与该蛋白二级结构H2 helix的D值的变化。图中可以看出,在100 ns的模拟时间内,72截断型Gnk-2整体结构的D值与该蛋白二级结构H2 helix的D值的变化基本一致:与模拟起始状态相比,均有所升高。72截断型抗菌蛋白的整体结构的D值在模拟后期稳定在0.3 nm上下,而该蛋白二级结构H2 helix的D值在模拟后期稳定在0.35 nm之上,高于整体蛋白的D值。这可以说明72截断型Gnk-2蛋白构象的变化主要是由二级结构H2 helix自身结构变化引起的,同时,又因为72位置上的苏氨酸残基并不参与二硫键的形成。
因此,我们可以得到结论:72截断型Gnk-2二级结构H2 helix自身残基的缺失,才是引发模拟过程中截断型蛋白整体构象发生变化的主要原因,这与此残基是否参与二硫键的形成,模拟过程中二硫键是否遭到破坏,并不相关。
2.3 分子内二硫键断裂的突变型Gnk-2
为了进一步验证上述模拟过程中二硫键的破坏并不是造成蛋白构象变化的主要原因的观点,我们做了以下分析。
图4给出了360 K的情况下野生型Gnk-2和突变体Gnk-2整体结构D的变化。其中突变体蛋白的10,62,71,74,86,99位置上的半胱氨酸残基均被丙氨酸所替代,分子内的三个二硫键:Cys10-Cys85, Cys62-Cys71和Cys74-Cys99均遭到破坏。图中可以看出,(1) 在100 ns的模拟时间内,野生型和突变体Gnk-2的D值较模拟起始阶段均有所升高,这说明在水溶液的坏境中,野生型和突变体Gnk-2的整体结构均发生变化,与上文所述一致,这都是温度升高,Gnk-2分子结构的热涨落和水分子的布朗运动所致。(2) 模拟过程中,野生型和突变体Gnk-2整体结构的D值的变化基本一致,在模拟后期,两种蛋白的D值基本重合,均稳定在0.2 nm上下。这说明野生型和突变体Gnk-2的构象变化基本一致,突变体蛋白并没有因为分子内三对二硫键的破坏而发生更加显著的构象变化,也就是说,在100 ns的模拟时间内,二硫键的破坏并不是造成蛋白构象变化,使蛋白构象失稳的主要原因。
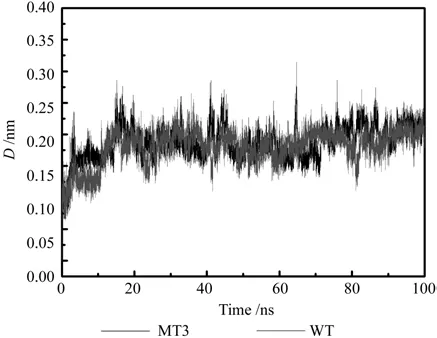
图4 二硫键断裂的突变型Gnk-2的结果Fig. 4 The results for mutant Gnk2 in the absence of the disul fide bonds (MT3)
综上所述,在100 ns的模拟时间内,造成Gnk-2蛋白构象发生显著变化的主要原因,是蛋白自身残基的缺失而并不是二硫键的断裂。这与前人文献中[27,28]仅通过100 ns的模拟时间内野生型和截断型蛋白RMSD值的变化趋势,便判断出二硫键的断裂是引发蛋白构象发生显著变化的主要原因的看法,是不一致的。
3 结 论
本文通过大量的分子动力学模拟,研究了二硫键以及蛋白自身残基在蛋白维持构象稳定中起到的作用,并对野生型,截断型和突变型的银杏抗菌蛋白Gnk-2的构象变化进行了分析。通过对模拟轨迹的分析可以发现在360 K,100 ns的模拟过程中:
截断型Gnk-2的构象变化比野生型Gnk-2的构象变化显著,并且无论分子内二硫键是否断裂,截断型蛋白整体构象的变化均与自身二级结构H2 helix的变化基本一致。其中所截断残基位于二级结构H2 helix上。而突变型蛋白和野生型蛋白的构象变化基本一致,均不显著。综上所述,在100 ns的模拟时间内,造成蛋白构象发生显著变化的主要原因是蛋白自身残基的缺失。短时间内二硫键维持蛋白结构稳定方面的作用并不显著。而Castellanos等[27]和Ning LuLu等学者[28]分别针对的二硫键在HSA和huPrP中100 ns的作用研究。仅过野生型和截断型蛋白RMSD值的变化趋势,便判断出二硫键的断裂是引发蛋白构象发生显著变化的主要原因的看法,是缺乏一定的研究支持的。本研究结果验证短时间构象变化的主因其实是蛋白质自身残基的缺失。
当然,本研究通过对照研究,虽然确定100 ns内二硫键对稳定性影响并不显著,然而真正确定二硫键对蛋白结构稳定的影响,必须做更多更大时间尺度内(微秒级别)的模拟。这将在后续的工作中进行研究。
总之,上述研究结果对理解短时间内影响Gnk-2分子稳定性的因素着重要意义。可以为银杏抗菌蛋白的转基因产品或者新抗菌制剂的开发、储存以及应用提供一定的参考和借鉴。
[1]汪贵斌, 曹福亮, 张往祥. 银杏品种耐盐能力的研究[J]. 林业科学, 2003, 39(5): 168-172.
[2]郭蔼光, 牛卫宁. 银杏种仁中抗菌蛋白的纯化及性质[J]. 西北植物学报, 2003, 23(9): 1545-1549.
[3]荆贝贝. 银杏果仁中抗菌肤的分离纯化、性质鉴定银杏种仁及其总RNA提取[D]. 杨凌:西北农林科技大学, 2006.
[4]黄小炯, 区子弁, 王 琴. 银杏抗菌蛋白的提取及其抗菌性研究[J]. 工艺技术, 2008, 29(10): 139-142.
[5]刘 缙, 王亚红, 王 强, 等. 银杏果仁抗菌蛋白的分离纯化及其基因克隆和原核表达初步研究[J]. 农业生物技术学报,2010, 18(2): 246-253.
[6]贾韶千. 银杏抗氧化肤的制备、结构鉴定及活性研究[D]. 南京:南京林业大学, 2011.
[7]郁万文, 曹福亮, 吴广亮. 叶面配施镁锌钼对银杏苗叶生长和药用品质的影响[J]. 西北植物学报, 2012, 32(6): 1214-1221.
[8]曹福亮, 汪贵斌, 郁万文. 银杏叶用林定向培育技术体系的集成[J]. 南京林业大学学报:自然科学版, 2014, 38(6):146-152.
[9]吴海霞. 银杏种仁抑菌蛋白及其抑菌机制研究[D]. 南京:南京林业大学, 2014.
[10]王欢利, 刘新亮, 郁万文, 等. 银杏叶绿素a/b结合蛋白基因(GbLhcb4) 及其启动子克隆[J]. 中南林业科技大学学报,2015, 35(5): 144-121.
[11]Sawano Y, Miyakawa T, Yamazaki H,et al. Purification,characterization, and molecular gene cloning of an antifungal protein from Ginkgo biloba seeds[J]. Biological Chemistry, 2007,388(3): 273-280.
[12]Wedemeyer W J, Welker E, Narayan M,et al.Current Topics Disulfide Bonds and Protein Folding[J]. Biochemistry, 2000,39(15): 4207-4216.
[13]Hayashi J, Watanabe H, Kurose R,et al.Effects of fuel droplet size on soot formation in spray flames formed in a laminar counter flow[J]. Proceedings of the Combustion Institute, 2011,158(12): 2559-2568.
[14]Steudel R. Properties of Sulfur-Sulfur Bonds[J]. Angewandte Chemie International Edition in English, 1975, 14(10): 655-664.
[15]Creighton T E. Disulphide Bonds and Protein Stability[J].BioEssays, 1988, 8: 655-664.
[16]Cooper A, Eyles S J, Radford S E,et al. Thermodynamic Consequences of the Removal of a Disulphide Bridge from Hen Lysozyme[J]. Journal of Molecular Biology, 1992, 225: 939-943.
[17]Drakopoulou E, Vizzavona J, Neyton J,et al. Consequence of the Removal of Evolutionary Conserved Disulfide Bridges on the Structure and Function of Charybdotoxin and Evidence That Particular Cysteine Spacings Govern Specific Disulfide Bond Formation[J]. Biochemistry,1998, 37(5): 1292-1301.
[18]Siddiqui K S, Poljak A, Guilhaus M,et al.Role of Disulfide Bridges in the Activity and Stability of a Cold-Active-Amylase[J]. Journal of Bacteriology, 1972, 103(1):171-174.
[19]Vaz D C, Rodrigues J R, Sebald W,et al.Enthalpic and entropic contributions mediate the role of disul fide bonds on the conformational stability of Interleukin-4[J]. Protein Science,2006, 15(1): 33-44.
[20]MAITI N R, SUREWICZ W K. The Role of Disul fide Bridge in the Folding and Stability of the Recombinant Human Prion Protein[J].Journal of Biological Chemistry, 2001, 276(4): 2427-2431.
[21]Cho S S, Levy Y, Onuchic J N,et al. Overcoming residual frustration in domain-swapping: the roles of disul fide bonds in dimerization and aggregation[J]. Physical Biology, 2005, 2(2):S44-S55.
[22]Allison J R, Moll G, Gunsteren W F Van. Investigation of Stability and Disul fide Bond Shuf fling of Lipid Transfer Proteins by Molecular Dynamics Simulation[J]. Biochemistry, 2010,49(32): 6916-6927.
[23]Clarke J, Hounslow A M, Bond C J,et al.The effects of disul fide bonds on the denatured state of barnase[J]. Protein Science, 2000,9(12): 2394-2404.
[24]Godwin A, Elisa J C, Balan S,et al. Molecular dynamics simulations of proteins with chemically modified disulfide bonds[J]. Theoretical Chemistry Accounts, 2007,117(2):259-265.
[25]Qin M, Zhang J, Wang W. Effects of Disul fide Bonds on Folding Behavior and Mechanism of the b -Sheet Protein Tendamistat[J].Biophysical Journal, 2006, 90(1): 272-286.
[26]Moghaddam M E, Naderi-manesh H. Role of Disul fide Bonds in Modulating Internal Motions of Proteins to Tune Their Function :Molecular Dynamics Simulation of Scorpion Toxin Lqh III[J].Proteins Structure Function & Bioinformatics, 2006, 63(1): 188-196.
[27]Castellanos M M, Colina C M. Molecular Dynamics Simulations of Human Serum Albumin and Role of Disulfide Bonds[J].Journal of Physical Chemistry B, 2013, 117(40):11895-11905.
[28]Ning L, Guo J, Jin N,et al.The role of Cys179-Cys214 disul fide bond in the stability and folding of prion protein: insights from molecular dynamics simulations[J]. Journal of Molecular Modeling, 2014, 20(2): 1-8.
[29]Betz S F. Disul fide bonds and the stability of globular proteins[J].Protein Science, 1993, 2(2): 1551-1558.
[30]Miyakawa T, Miyazono K, Sawano Y,et al. Crystal structure of ginkbilobin-2 with homology to the extracellular domain of plant cysteine-rich receptor-like kinases[J]. Proteins: Structure,Function, and Bioinformatics, 2009, 77(1): 247-251.
[31]Daggett V, Levitt M. Protein Unfolding Pathways Explored Through Molecular Dynamics Simulations[J]. Journal of Molecular Biology, 1993, 232(2): 600-619.
[32]Day R, Bennion B J, Ham S,et al. Increasing temperature accelerates protein unfolding without changing the pathway of unfolding[J]. Journal of Molecular Biology, 2002,322(1):189-203.
[33]Hess B, Bekker H, Berendsen H J C,et al.LINCS: A linear constraint solver for molecular simulations[J]. Journal of Computational Chemistry, 1997, 18(12): 1463-1472.
[34]Essmann U, Perera L, Berkowitz M L,et al.A smooth particle mesh Ewald method[J]. Journal of Chemical Physics, 1995,103(19): 8577-8593.
[35]Bussi G, Donadio D, Parrinello M. Canonical sampling through velocity rescaling[J]. Journal of Chemical Physics, 2007, 126(1):1-7.
[36]Berendsen H J C, Postma J P M, Van Gunsteren W F,et al.Molecular dynamics with coupling to an external bath[J]. The Journal of Chemical Physics, 1984, 81(8): 3684-3690.
[37]Humphrey W, Dalke A, Schulten K. VMD: Visual molecular dynamics[J]. Journal of Molecular Graphics, 1996, 14(1): 33-38.
Roles of removal of disul fide bonds and of protein residues in the stability of Ginkbilobin-2
SHI Xiao-xuan, CHEN Hong
(Material Science and Engineering Institute, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
Molecular dynamics (MD) simulations were used within a short time of 100 ns to study and compare the conformational changes of the wild type form with the reduced form of the protein, where the cysteine residues that formed the disul fide bonds were removed. However, an important issue is that upon the removal of residues, besides the effect of elimination of disul fide bonds, the removal of residues itself is also expected to affect the protein conformation. To determine which effect plays a critical role in affecting the conformation within the short simulation time, we take the ginkbilobin-2 as an example. The simulation results show that the conformational changes of the proteins in the short simulation time stem from the removal of residues rather than the elimination of the disul fide bond. This conclusion is important to understand the effects of disul fide bonds on protein stability and promote the development of ginkbilobin-2 genetic engineering.
molecular dynamics simulation; disul fide bonds; protein residue; Ginkbilobin-2; structure stability
S792.95
A
1673-923X(2016)10-0065-07
10.14067/j.cnki.1673-923x.2016.10.012
2016-03-29
国家科技部公益行业专项(201504507)资助
史晓璇,硕士研究生
陈 洪,教授;E-mail:chenhongcs@126.com
史晓璇,陈 洪. 去除二硫键和蛋白残基对银杏抗菌蛋白构象的影响[J].中南林业科技大学学报,2016, 36(10): 65-71.
[本文编校:吴 彬]
