一株枯草芽孢杆菌的饲料学特性研究
2015-12-31巨向红叶小妹张金燕徐中文孙建华雍艳红广东海洋大学动物医学系湛江54088广东绿百多生物科技有限公司
巨向红,叶小妹,张金燕,徐中文,孙建华,雍艳红(.广东海洋大学动物医学系,湛江 54088;.广东绿百多生物科技有限公司)
营养与饲料
一株枯草芽孢杆菌的饲料学特性研究
巨向红1,叶小妹1,张金燕2,徐中文2,孙建华2,雍艳红1
(1.广东海洋大学动物医学系,湛江 524088;2.广东绿百多生物科技有限公司)
枯草芽孢杆菌(Bacillus Subtilis)具有调节肠道微生态平衡、提高饲料转化率和提高动物免疫力等功能,是微生物饲料添加剂的常用菌种。但由于对选育、传代和保藏等技术的不重视,导致其性能严重退化,选择抗逆性强和发酵效果佳的菌株用于动物饲料添加具有重要意义。该研究观察了一株枯草芽孢杆菌的形态特征,测定了其生长曲线、抗逆性及所发酵饲料的pH值和几种消化酶的活力变化,以为其推广应用提供依据。结果表明:该株枯草芽孢杆菌具有本种所特有的形态特征;在37℃、180 r/min条件下培养,无生长延滞期,生长对数期为0~6 h,生长稳定期为6~10 h,生长衰亡期为10 h以后;分别在37℃、70℃、80℃、90℃和100℃的水浴中处理10min后,其存活率差异不显著(P>0.05);在1%~5%的胆盐中生长存活率均大于100%;在pH值为2的酸性环境中培养60min,存活率高达58.8%(P≤0.05);发酵饲料的pH值随发酵时间的延长而明显降低,而蛋白酶、淀粉酶和纤维素酶活力显著升高(P≤0.05)。表明该株枯草芽孢杆菌的饲料学特性优良,是理想的有益微生物饲料添加剂。
枯草芽孢杆菌;生长曲线;抗逆性;酶活力
畜牧养殖过程对抗生素的不规范使用,导致了病原微生物耐药性增强、药物残留和食品安全等诸多问题,并最终威胁到人类健康[1]。开发绿色新型饲用添加剂来替代或减少抗生素的使用将有助于我国畜牧业的可持续发展。微生态制剂是较理想的饲用抗生素替代品。其能生成乳酸、短链脂肪酸和抑菌活性物质等有益因子,这不仅有利于胃肠道酸性环境的形成[2],还能调节动物肠道菌群平衡,促进消化代谢和提高饲料转化率[3]。对猪的饲喂试验结果表明,益生菌能明显提高猪的生长速度,改善饲料的利用率,提高仔猪存活率以及降低腹泻的发病率[4]。
枯草芽孢杆菌(Bacillus Subtilis)是我国农业部批准的可直接饲喂动物的益生菌菌种之一[5]。近年,人们围绕枯草芽孢杆菌菌株的筛选、发酵技术和添加策略的优化等开展了大量的工作。但由于饲料加工过程中的高温处理(可达90℃以上)和制粒等环节对有益微生物有明显的杀灭作用,动物采食后,益生菌也会被肠道环境中的胃酸、胃液和胆盐等抑制甚至杀灭。故选择抗逆性强、发酵效果好的有益微生物菌株具有重要意义。鉴于此,本研究对一株枯草芽孢杆菌的饲料学特性进行了检测,从而为该菌株的推广应用提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验菌株 枯草芽孢杆菌LBD-1菌株由广东绿百多生物科技有限公司惠赠。
1.1.2 主要试剂 营养琼脂培养基和营养肉汤培养基均购自北京陆桥技术有限公司;Folin Ciocalteu试剂盒为北京鼎国昌盛生物技术有限责任公司;革兰氏染色盒购自广东微生物科技有限公司;人工胃液、胆盐均参照文献制备,所用试剂为国产分析纯。发酵所用饲料为正大102小鸡料。
1.1.3 主要仪器 BC/BD-27生化恒温培养箱购于上海博迅实业有限公司医疗设备厂,SPX-250B-Z超净工作台购于上海博迅实业有限公司医疗设备厂,SW-CJ-2F震荡培养箱购于中国哈尔滨市东联电子技术开发有限公司,HHS-11-4可见光分光光度计购于上海精科科技有限公司,密封型手提式粉碎机购于广州市旭朗机械设备有限公司。
1.2 方法
本研究过程主要参照杨锋等[5]、董尚智等[6]、Alonso 等[7]的研究报告及行业标准GB 8275—2009[8]、SB/T 10317—1999[9]和NY/T912—2004[10]的方法进行。
1.2.1 枯草芽孢杆菌菌落形态观察和菌体镜检 将枯草芽孢杆菌LBD-1菌株进行平板划线后放入37℃生化培养箱中培养24 h和48 h,然后挑取典型菌落菌体进行革兰氏染色及镜检。
1.2.2 种子液制备 无菌条件下,从菌种保存斜面中挑取1环菌苔,接入营养肉汤培养基中,于37℃生化培养箱中培养24 h,即得到细菌种子培养液。
1.2.3 生长曲线的测定 取250mL三角瓶,装入100mL无菌营养肉汤培养基,按5%的接种量加入枯草芽孢杆菌种子液,混匀,于37℃和180 r/min的恒温振荡培养箱中培养。在接入菌种后的0 h、1.5 h、3 h、4h、6h、8h、10h、12 h、14 h、16 h以及20 h无菌条件下取出适量培养液,分光光度计420 nm波长处测定OD值,记录结果并以时间为横坐标,OD420为纵坐标绘制生长曲线。每组3个重复,试验重复3次。
1.2.4 耐酸性试验 以pH值为7.4的PBS缓冲液为基础的营养肉汤,用稀盐酸调节pH值为2.0、3.0、3.5、4.0、5.0、6.0、6.5、7.0、7.5、8.0的培养基。取枯草芽孢杆菌菌液1mL加入9mL上述梯度pH值的营养肉汤培养基中,对照组则加入9mL的灭菌生理盐水。置于37℃、180 r/min振荡培养箱中培养1 h,分光光度计420 nm波长处测定OD值,将不同pH值的OD值与相应空白对照OD值之比记为该菌株的存活率。每组3个重复,试验重复3次。
1.2.5 耐高温试验 在营养肉汤培养基中按5%的接种量加入枯草芽孢杆菌种子液,分别置入37℃、70℃、80℃、90℃和100℃水浴锅中作用10min,冷却后于37℃恒温振荡培养箱中培养9、15和20 h,测定其OD420值,观察和记录生长情况。每组3个重复,试验重复3次。
1.2.6 耐胆盐试验 在胆盐浓度分别为0%、0.1%、0.2%、0.3%、0.4%、0.5%的液体营养肉汤培养基中,按5%接种量加入枯草芽孢杆菌,于37℃震荡培养箱恒温培养18 h,在420 nm波长下测定吸光度,不同胆盐浓度的OD420值与相应空白对照OD420值之比为该菌株的存活率。每组3个重复,试验重复3次。
1.2.7 发酵试验
1.2.7.1 菌液的制备 将10mL含有0.1%吐温80的无菌水分别倒入枯草芽孢杆菌斜面培养基上,用接种环将斜面上的菌种和孢子刮下,置入盛有90mL无菌水的三角瓶中,用磁力搅拌器将其搅拌均匀,适当稀释,使密度达到1×107cfu/mL。
1.2.7.2 菌液的接种 饲料经粉碎后,过60目筛,称取60 g饲料装入100mL三角瓶中,高压灭菌25min。冷却后将饲料粉打散,接入1×107cfu的发酵种子液,37℃恒温培养箱培养。每组设3个重复,试验重复3次。
1.2.7.3 发酵饲料的酸度及酶活性测定 发酵饲料的酸度、淀粉酶活性、蛋白酶活性和纤维素酶活性测定主要参照钟青萍等[11]、吴胜莲等[12]和国家轻工行业[13]、农业部[10]酶活力测定相关的行业标准方法进行。
1.2.8 数据处理 检测不同处理组和对应对照组在OD420波长时的吸光度,用两者的比值代表芽孢杆菌存活率。数据以平均值±标准差表示,采用SPSS 13.0软件进行数据分析,两组间的差异显著性比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 枯草芽孢杆菌的形态学观察
该株枯草芽孢杆菌呈革兰氏阳性,在接种后12 h内,杆端钝圆,单生或呈短链状(图1-A)。在接种后48 h,出现芽孢,且芽孢一般生在菌体中间或两端,呈椭圆形或长筒形(图1-B)。呈现典型的枯草芽孢杆菌形态特征。
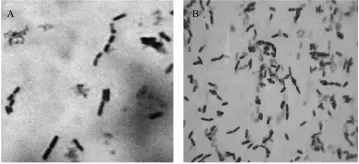
图1 菌株的形态观察
2.2 菌株的生长曲线和抗逆性能观察
对生长曲线观察发现,该菌株无明显的生长延滞期,生长对数期为0~6 h,生长稳定期为6~10 h,生长衰亡期为第10小时以后(图2-A)。以1.5 h的OD420为标准,不同时间点的OD420值与其均差异极显著(P<0.01)。
菌株分别经37℃、70℃、80℃、90℃和100℃水浴处理10min后,在培养的9、15和20 h测定菌液OD420,发现随着处理温度的升高,同一时间点的吸光度下降(图2-B)。但在培养9 h后,吸光度与37℃处理组相比差异不显著(P>0.05)。而在培养15 h和20 h后,不同处理组与37℃处理组间差异极显著(P<0.01)。存活率则随处理温度的升高而逐渐降低,分别为90.83%、86.81%和87.26%。
该菌株在pH值为2的培养基中培养时存活率最低,仅为59%,说明酸性环境对其生长有一定的影响。随着培养液pH值的逐渐升高,存活率明显增加。在培养液pH值为7.5时,菌株的存活率最高,达150%(图2-C)。说明该菌株最适宜在中性环境中生长。
该菌株在胆盐浓度分别为0、0.1%、0.2%、0.3%、0.4% 和0.5%的液体营养肉汤培养基中培养18 h,存活率随胆盐浓度升高而逐渐降低。最高为131.22%,最低为115.45%,但均高于100%,说明该菌株具有较强的耐胆盐能力(图2-D)。
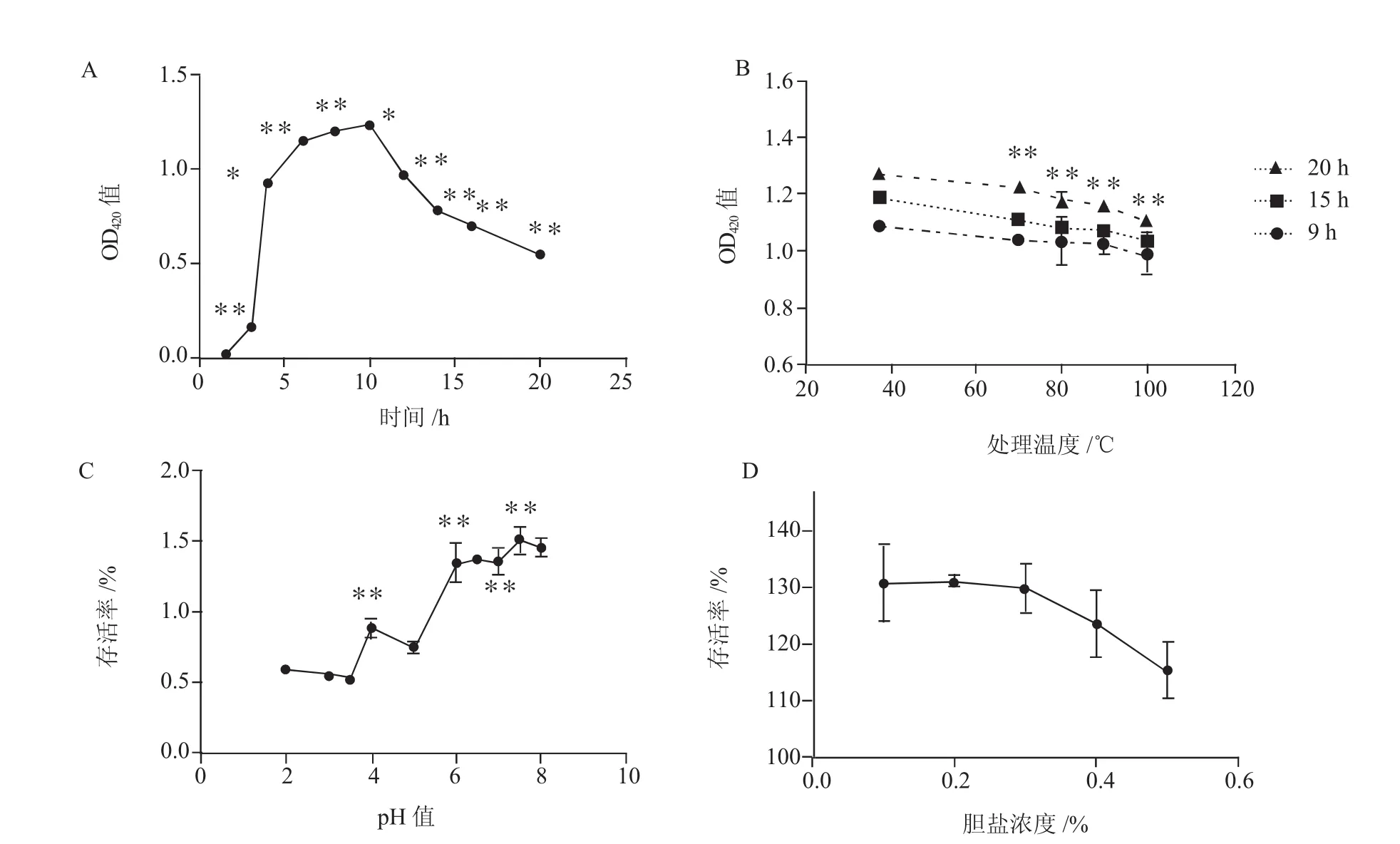
图2 菌株生长特性观察
2.3 菌株发酵饲料的效果观察
发酵试验结果发现,经该菌株发酵的饲料pH值随发酵时间的推移而下降,发酵第7天为5.1,发酵第15天为4.7,均极显著低于发酵第0天的5.6(P<0.01)(图3-A)。对该株枯草芽孢杆菌发酵饲料淀粉酶、蛋白酶和纤维素酶活性的动态监测发现(图3-B),淀粉酶活性在发酵的第7天和第15天分别为802U/mL和919U/mL,均极显著高于对照组的729U/mL(P<0.01)。蛋白酶活性在发酵第7天为93 U/mL,第15天为255 U/mL,均极显著高于对照组的53U/mL(P<0.01)。纤维酶活性在发酵第7天为2.3 U/mL,第15天为2.5 U/mL,也均高于对照组的1.35 U/mL(P<0.01)。可见该菌株能显著降低发酵饲料的pH值,增高淀粉酶、蛋白酶和纤维素酶的活性。
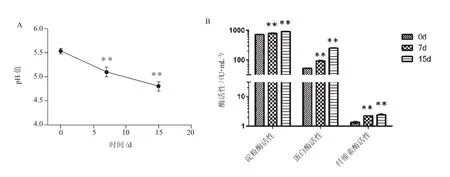
图3 经枯草芽孢杆菌LBD-1菌株发酵的饲料特性
3 分析与讨论
枯草芽孢杆菌在生长过程中可产生枯草菌素、多粘菌素、制霉菌素、短杆菌肽等活性物质,这些活性物质对致病菌或内源性感染的条件致病菌有明显的抑制作用。另一方面,其能迅速消耗环境中的游离氧,造成肠道低氧,促进有益厌氧菌生长,并产生乳酸等有机酸类,降低肠道pH值,间接抑制其他致病菌的生长。枯草芽孢杆菌还可刺激动物免疫器官的生长发育,激活T、B淋巴细胞,提高免疫球蛋白和抗体水平,增强细胞免疫和体液免疫功能,提高群体免疫力[5]。鉴于其良好的益生效果和优良的抗逆性能,目前在人类健康和动物养殖中被广泛应用。
枯草芽孢杆菌为革兰氏阳性菌,单生或呈短链状,杆端钝圆。在恶劣环境中或者细菌衰败期,出现芽孢。芽孢位于菌体中间或者两端,呈椭圆形,是菌体抗逆性最强的休眠体状态[14]。本研究所观察的LBD-3菌株符合枯草芽胞杆菌的典型特征。据报道,枯草芽胞杆菌采用活化斜面培养基和种子培养基在最佳生长条件下培养时,没有延缓期,0~8 h生长速率最快,8~20 h生长速度减慢,20~32 h生长速率进一步降低,但生长量仍在增加[5]。而本试验发现,该株枯草芽孢杆菌无生长延滞期,生长对数期为0~6 h,生长稳定期为6~10 h,生长衰亡期为第10小时以后。可见该菌株生长期相对较短,说明不同菌株的生长特性可能会有差异。
成年动物正常胃液酸度为pH值2.0~3.5,适合于消化饲料蛋白质和抑制多种病原微生物,而仔畜分泌胃酸能力差,其胃液酸度为pH值4左右[15],这是外源益生菌进入动物肠道并定居的主要障碍。此外,pH值依赖性的酸水解作用是胃内细菌结构被破坏的主要途径。本研究发现该枯草芽孢杆菌即使在pH值为2.0~3.5的培养基中培养,存活率也高于53%,说明其有较强的耐酸能力。由于饲料的制粒温度最高可达70~90℃,并持续25~30 s,故选择耐高温的益生菌菌株非常重要。据杨锋等[5]报道,枯草芽孢杆菌在90℃水浴处理10min后存活率接近80%,这与本研究结果一致。枯草芽孢杆菌LBD-1株在100℃高温处理10min后,其存活率仍达86%。另外,对胆盐耐受也是益生菌选育的一个重要指标。据报道,枯草芽孢杆菌在0.03%至0.30%的猪胆盐培养基中存活率超过90%,但其生长依然受胆盐浓度抑制[5]。在本研究中,枯草芽孢杆菌LBD-1株在含0.1%~0.5%的胆盐培养基中的存活率高于100%,说明该枯草芽孢杆菌有较强的耐胆盐能力。
配合饲料中含有淀粉、蛋白质、脂肪、纤维素、半纤维素和果胶等多种营养成分,它们由生 物多聚物组成,必须依靠水解酶类将其降解后才能被动物肠道吸收。枯草芽孢杆菌发酵过程中可分泌多种消化酶,如蛋白酶、脂肪酶和淀粉酶等可促进营养物质的消化和吸收。在本研究中,该株枯草芽孢杆菌能明显提高发酵饲料中淀粉酶、纤维素酶和蛋白酶活力。另一方面,益生菌还可显著降低饲料的pH值。胃内pH值降低,可增强胃蛋白酶的活性,间接性激发胰腺的分泌,加强胃肠道活动及免疫力[16]。在本研究中,随发酵时间的延长,饲料的pH值显著降低,这与郑德富等[17]的研究结果一致。但究竟发酵多长时间时酶活性及饲料营养价值最高还需进一步研究。
4 结论
枯草芽孢杆菌LBD-1株是理想的饲料添加剂用有益微生物,可用于动物饲料添加。
[1] 窦茂鑫,赵迪,王蕾,等.猪源枯草芽孢杆菌的分离鉴定及生物学特性研究[J].养殖与饲料,2012(4):11-14.
[2] 彭军,李勇.益生菌与肠道功能[C]//北京市营养学会第四届会员代表大会暨膳食与健康研讨会论文集.2010:187-190.
[3] AliakbarpourH R,Chamani M,Rahimi G,etal.The Bacillus subtilis and lactic acid bacteria probiotics influences intestinal mucin gene expression,histomorphology and growth performance in broilers[J]. Asian-Australasian Journal of Animal Sciences,2012,25(9):1285-1293.
[4] 周瑜.微生态制剂在养殖业中的应用[J].兽医导刊,2013(8):49-51.
[5] 杨锋,章亭洲.枯草芽孢杆菌生物学特性的研究[J].饲料研究,2011(3):34-36.
[6] 董尚智,陈远凤,黄燕华,等.纳豆芽孢杆菌的饲料学特性研究[J].动物营养学报,2009,21(3):371-378.
[7] Alonso S,Arevalo-VillenaM,Beda J,etal.Study of starch degradation by yeasts during fermentation for using in animal feed[J].Applied Biochemistryand Biotechnology,2010,162(7):2058-2066.
[8] GB 8275—2009,食品添加剂α-淀粉酶制剂[S].
[9] GB/T 28715—2012,饲料添加剂酸性、中性蛋白酶活力的测定分光光度法[S].
[10]NY/T 912—2004,饲料添加剂纤维素酶活力的测定分光光度法[S].
[11]钟青萍,王发祥,钟士清,等.纳豆菌微生态制剂的稳定性研究[J].食品科学,2006(3):34-36.
[12]吴胜莲,刘惠知,周映华,等.纳豆芽孢杆菌发酵条件的优化[J].湖南农业科学,2011(19):16-19.
[13]QB/T 1803—1993,工业酶制剂通用试验方法[S].
[14]辛娜,刁其玉,张乃锋,等.芽孢杆菌在动物营养与饲料中的应用[J].中国饲料,2010(14):26-29.
[15]覃树华.关于保育仔猪胃液酸度的问题[J].广西畜牧兽医,2007,23(2):95.
[16]惠明,窦丽娜,田青,等.枯草芽孢杆菌的应用研究进展[J].安徽农业科学,2008,36(27):11623-11624.
[17]郑德富,冯艳忠.科学开发益生菌饲料添加剂降低畜产品药残[J].中国畜牧杂志,2010,46(6):59-60,63.
Study on the Feed Perform ance ofa Strain of BacillusSubtilis
Ju Xianghong,Ye Xiaomei,Yong Yanhong,etal
(DepartmentofVeterinaryMedicine,GuangdongOcean University,Zhanjiang524088,China)
Bacillus Subtilis isan idealprobiotic formaintaining andmodulation the flora balance ofanimal intestinalgut,aswell improving the feed conversion rateand theproduction performanceofanimal.But theperformanceof BacillusSubtilis degenerated due to thedeficiency ofbreed and unsuitable transferofculture.Choosinga strain of BacillusSubtilis thathavea strong resistance and good effecton feed fermentation asanimal feed additivesare very important.In thisstudy,themorphologicalcharacteristic ofa strain of Bacillus Subtilis whichwere donated by abiotechnological companywereobserved,aswellas thegrowth curves,the resistances tohigh temperatureand acid bileweredetected by traditionalprotocol.Furthermore,the pH valueand theactivityofdigestive enzyme of the feed fermented by Bacillus Subtilis were investigated in different time point after treatment.The results showed that thisstrain of BacillusSubtilis had noobviously lag phase,and its logarithmic growth phase,stationary phaseand decline phasewas2~6 h,6~10 h and above10 h after culturebegan respectively.No obvious changes in the survive ratewere found when pretreated by 37℃,70℃,80℃,90℃and 100℃environment for 10min aswellexposed to differential concentration of Bilesalts.Thesurvive rateof BacillusSubtilis attained to58.8%when treated by apH of2 culturebuffer for60min.ThepH value of feed fermented by the Bacillus Subtilis progressively decreased over time,in parallelwith activity of protease,amylase and cellulose increased significantly.It was concluded that this strain of Bacillus subtilis was a valuable probiotic to use in feed addition.
Bacillus subtilis;growth curve;resistance;enzyme activity
S816
A
2095-3887(2015)04-0032-05
10.3969/j.issn.2095-3887.2015.04.010
2015-05-26
湛江市科技计划项目(2012C0201)
巨向红(1977-),男,副教授,博士。
雍艳红(1977-),女,讲师,博士,主要从事应激性致病机理研究。
