7种绵羊和4种山羊GDF9基因G1突变检测
2015-12-31古丽格娜艾买提买买提於建国杨会国储明星买买提明郭晓飞潘章源刘秋月新疆畜牧科学院畜牧研究所乌鲁木齐80000中国农业科学院北京畜牧兽医研究所农业部畜禽遗传资源与种质创新重点实验室北京009新疆畜牧厅南山种羊场
古丽格娜,艾买提·买买提,於建国,郝 耿,杨会国,储明星,买买提明,郭晓飞,潘章源,狄 冉,刘秋月(.新疆畜牧科学院畜牧研究所,乌鲁木齐80000;.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京009;.新疆畜牧厅南山种羊场)
遗传育种
7种绵羊和4种山羊GDF9基因G1突变检测
古丽格娜1,艾买提·买买提1,於建国1,郝 耿1,杨会国1,储明星2,买买提明3,郭晓飞2,潘章源2,狄 冉2,刘秋月2
(1.新疆畜牧科学院畜牧研究所,乌鲁木齐830000;2.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京100193;3.新疆畜牧厅南山种羊场)
前人研究表明生长分化因子9(GDF9)基因G1突变对部分绵羊品种的繁殖力有显著影响。文章采用PCR-RFLP方法在不同繁殖力的7个绵羊品种(小尾寒羊、湖羊、洼地绵羊、陶赛特羊、特克塞尔羊、杜泊羊、德国肉用美利奴羊)和4个山羊品种(济宁青山羊、贵州白山羊、辽宁绒山羊、内蒙古绒山羊)中检测GDF9基因G1突变,探究该突变与绵羊和山羊高繁殖力的关联性。结果显示:内蒙古绒山羊没有G1突变,只检测到AA基因型;其余10个绵羊和山羊品种都有G1突变,均检测到AA和AB两种基因型。
绵羊;山羊;繁殖力;GDF9基因;PCR-RFLP
生长分化因子9(growth differentiation factor9,GDF9)是由卵母细胞分泌的一种因子,它通过旁分泌方式对卵泡的生长和分化起重要作用,且对卵巢颗粒细胞的增殖、卵丘的膨胀和卵泡膜的形成均有促进作用[1-6]。绵羊GDF9基因定位于5号染色体标记BM7247和SRCRSP14之间[7]。在绵羊体内,GDF9基因在发育卵泡中特异性表达[8];在山羊体内,GDF9基因在整个发育过程的卵泡和黄体中都表达[9]。Hanrahan等[10]发现Cambridge和Belclare绵羊GDF9基因编码区260 bp处存在一个碱基突变G→A,导致第87个氨基酸残基由精氨酸改变为组氨酸,并且引起了HhaⅠ酶切位点的消失,将其命名为G1突变。
Barzegari等[11]和Javanmard等[12]报道,G1突变对一些绵羊品种的排卵数或产羔数有显著影响。目前国内有关GDF9基因G1突变与羊繁殖力关联方面的报道比较少,仅有研究表明内蒙古地区的德国肉用美利奴羊和新疆地区的巴音布鲁克羊存在该突变[13-14]。本文以繁殖力存在差异的7个绵羊品种(小尾寒羊、湖羊、洼地绵羊、陶赛特羊、特克塞尔羊、杜泊羊、德国肉用美利奴羊)和4个山羊品种(济宁青山羊、贵州白山羊、辽宁绒山羊、内蒙古绒山羊)为实验材料,采用PCR-RFLP方法检测GDF9基因G1突变在不同绵羊和山羊品种中的分布差异,旨在寻找与繁殖力相关的遗传标记,为羊高繁殖力的标记辅助选择提供依据。
1 材料与方法
1.1 材料
小尾寒羊母羊40只,湖羊母羊30只,洼地绵羊母羊37只,陶赛特母羊40只,杜泊羊母羊38只,特克塞尔羊母羊40只,德国肉用美利奴羊母羊39只,济宁青山羊母羊37只,贵州白山羊母羊36只,辽宁绒山羊母羊40只,内蒙古绒山羊母羊40只。颈静脉采血10mL/只,用柠檬酸葡萄糖抗凝,-20℃冻存。用酚氯仿抽提法提取基因组DNA,溶于TE缓冲液中,4℃保存。
1.2 主要试剂
限制性内切酶HhaⅠ、Taq DNA聚合酶、dNTPs均购自北京鼎国生物技术有限公司。
1.3 引物设计
根据GenBank公布的GDF9基因序列(GenBank:HE866499.1)设计引物,由上海英骏生物技术有限公司合成。预计引物扩增片段为410 bp。引物碱基序列为:Forward:5′-GAAGACTGGTATGGGGAAATG-3′;Reverse:5′-CCAATCTGCTCCTACACACCT-3′。
1.4 PCR扩增
PCR扩增总体积为25μL,其中10×PCR缓冲液2.5μL(不含Mg2+),10μmol/L上下游引物各1.0μL,2.5mmol/L dNTPs2.0μL,25mmol/LMg2+1.5μL,50 ng/μL DNA模板2.5μL,2.5U/μL Taq DNA聚合酶0.5μL,去离子水14.0μL。PCR扩增条件:94℃预变性5min;94℃变性30 s,60℃退火40 s,72℃延伸30 s,32个循环;72℃延伸10min,4℃保存。PCR产物用1.5%的琼脂糖凝胶电泳检测。
1.5 PCR-RFLP分析
引物的PCR扩增产物用HhaⅠ限制性内切酶进行酶切。酶切反应总体积20μL,其中PCR产物4μL,10×缓冲液2.0μL,10 U/μL HhaⅠ限制性内切酶0.5μL,去离子水13.5μL。均匀后振荡、短暂离心(转速达12 000 r/min即可)。酶切反应条件为37℃水浴过夜。酶切产物用2%的琼脂糖凝胶电泳检测。10μL酶切产物加2μL溴酚兰(6×DNA Loading Buffer)上样;DNAMarker I用量5μL;检测电压120 V、时间1 h。
2 结果
2.1 PCR扩增
对11个不同绵羊和山羊品种的基因组进行PCR扩增,该扩增片段为GDF9基因G1突变所在区域,PCR产物用1.5%的琼脂糖凝胶电泳检测。结果表明,扩增片段与目的片段大小一致(410 bp)(见图1),且条带特异性好,可直接进行RFLP分析。

图1 PCR产物电泳检测
2.2 RFLP检测
对11种羊的PCR扩增产物(410 bp)进行酶切分析,结果如图2所示,共检测到两种基因型。其中定义3条带型(410 bp,254 bp,156 bp)为杂合型(AB),2条带型(254 bp,156 bp)为纯合型(AA)。
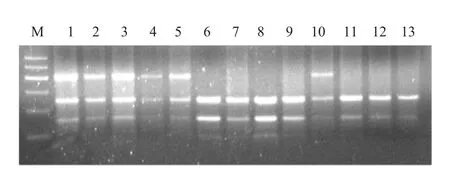
图2 GDF9基因G1突变引物的PCR产物酶切
2.3 G1突变在11个羊品种中的等位基因频率和基因型频率
对11个羊品种进行GDF9基因G1突变基因型检测,计算了其基因型频率和等位基因频率(表1)。由表1可见,内蒙古绒山羊没有G1突变,仅检测到AA型;其余10个绵羊和山羊品种都有G1突变,且均检测到AA、AB两种基因型。
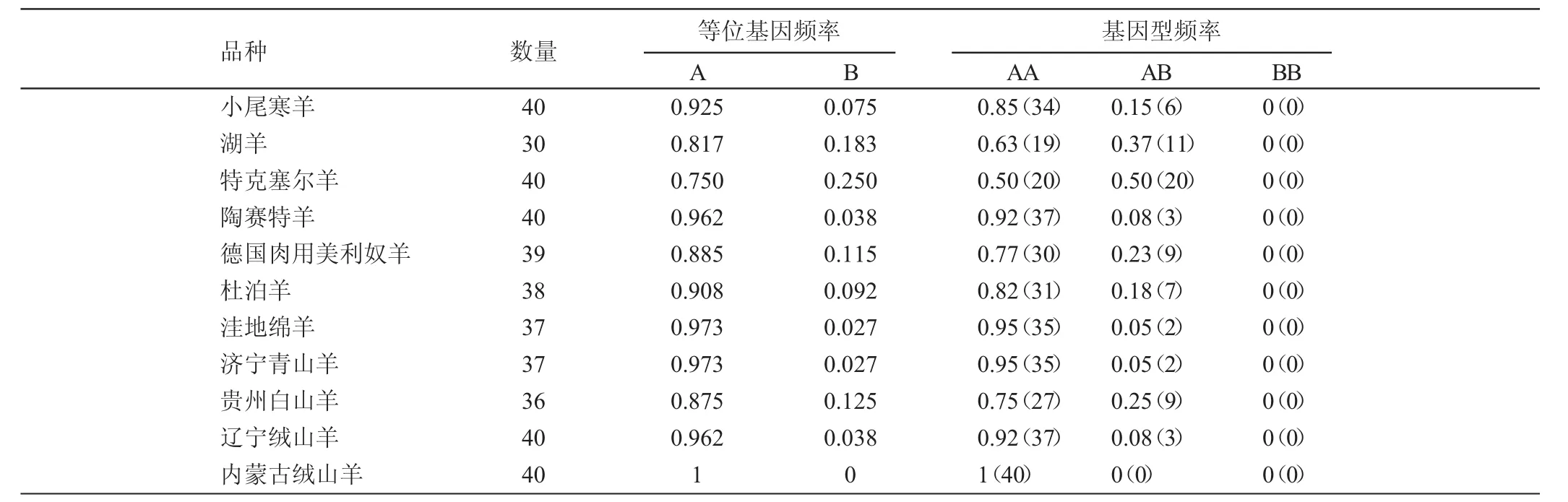
表1 GDF9基因G1突变在11个羊品种中的等位基因频率和基因型频率
3 讨论
大量研究表明,GDF9基因在人、啮齿类动物以及反刍家畜卵母细胞中均特异性表达,它对卵巢卵泡的发育起着关键的调节作用[7-8,15-19]。GDF9可以促进原始卵泡向初级卵泡发育,GDF9基因缺陷型母羊的卵母细胞能够发育到正常大小,但不能完成有丝分裂,并停止于初级卵泡阶段;其卵巢表面外观呈现“斑纹”状,且上皮颗粒脱落,卵泡周围的颗粒细胞也呈现异常状态[20]。Dong等[16]将敲除了GDF9基因外显子2的两只杂合子(gdf9ml/+)小鼠进行杂交,发现纯合子(gdf9ml/gdf9ml)雄性小鼠能正常繁殖,而纯合子(gdf9ml/gdf9ml)雌性小鼠则表现为不育,主要原因是GDF9缺陷型的纯合子雌性小鼠卵泡发育到初级卵泡就停止而不能继续生长分化。
GDF9基因在不同绵羊、山羊品种中存在多个位点突变,其多态性较丰富[10-12,21-30]。Hanrahan等[10]用PCR-SSCP和直接测序的方法共发现绵羊GDF9基因上有8个突变,分别命名为G1~G8,其中5个(G1、G4、G6、G7、G8)位点突变导致了转录后氨基酸水平的变化。最值得研究者们关注的G8突变又命名为FecGH,是位于编码区1 184 bp处的C→T碱基突变,导致氨基酸序列第395位的丝氨酸转变为苯丙氨酸,该突变杂合子在Belclare母绵羊和Cambridge母绵羊上表现为排卵数显著增加,而其纯合子Belclare母绵羊和Cambridge母绵羊则表现为不育。G8突变对Belclare绵羊和Cambridge绵羊排卵数的增加效应分别为1.79枚±0.55枚(P<0.01)和2.35 枚±0.39枚(P<0.001)。
针对G1突变,Barzegari等[11]在伊朗的Moghani和Ghezel绵羊、Polley等[21]在印度的Garole绵羊、Roy等[22]在印度的Bonpala绵羊、Liandris等[31]在希腊的Chios绵羊和Karagouniki绵羊、Paz等[32]在智利的Araucano Creole绵羊群体中均检测到该突变。Barzegari等[11]报道,在97个个体中,5只G1位点野生型的个体产双羔(6.3%);13只G1位点突变杂合型个体中,7只产双羔(53.8%);4 只G1位点突变纯合型个体都能繁殖,且产单羔;仅1只母羊因同时携带GDF9基因G1纯合子突变和BMP15基因B2纯合子突变而不育。Barzegari等[11]认为在Moghani 和Ghezel绵羊群体中,同时携带G1和B2杂合突变的个体排卵数更高,即高于携带单个突变的个体,并猜测这两个基因的突变对排卵数效应是相等的。Javanmard等[12]在伊朗脂尾型地毯毛绵羊品种(Afshari=19、Baluchi=18、Makui=30和Mehraban=30)中检测到BMP15基因B2突变和GDF9基因G1突变,其中在Baluchi和Makui品种中检测到突变纯合子。研究表明,B2或G1突变可显著提高以上绵羊品种的产羔数(P<0.01),单独携带B2或G1突变的纯合子个体也表现出正常的生殖能力,没有检测到同时携带B2和G1突变的个体。4个绵羊品种G1突变杂合个体平均每胎产羔数为1.78只±0.07只(n=38),显著高于野生型个体平均每胎产羔数1.16只± 0.05只(n=58)(P≤0.01)。Liandris等[31]统计Chios绵羊产羔数后发现,G1突变纯合子平均产羔数2.25只,显著高于其杂合子(平均产羔数为1.45只)和野生型纯合子(平均产羔数为1.59只)(P≤0.05)。Barzegari等[11]、Javanmard等[12]和Liandris等[31]均发现,G1突变纯合子在所研究的绵羊个体上都繁育正常,未出现纯合子不育现象。
本研究在不同繁殖力的7个绵羊品种(小尾寒羊、湖羊、洼地绵羊、陶赛特羊、特克塞尔羊、杜泊羊、德国肉用美利奴羊)和4个山羊品种(济宁青山羊、贵州白山羊、辽宁绒山羊、内蒙古绒山羊)中检测了G1突变。结果显示:内蒙古绒山羊均为AA基因型,没有G1突变;其余10个绵、山羊品种均有G1突变,且都只有AA和AB两种基因型,均没有G1突变纯合体的BB基因型。
[1] Elvin JA,Clark A T,Wang P,etal.Paracrineactionsofgrowth differe-ntiation factor-9 in themammalian ovary[J].Molecular Endocrinology,1999,13(6):1035-1048.
[2] Juengel JL,Hudson N L,Heath DA,etal.Growth differentiation factor 9 and bonemorphogenetic protein 15 areessential forovarian follicular developmentin sheep[J].Biology ofReproduction,2002,67(6):1777-1789.
[3] Kaivo-OjaN,Bondestam J,Kamarainen M,etal.Growth differentiation factor-9 inducesSmad2 activation and inhibin Bproduction in cultured human granulosa-luteal cells[J].Journal of Clinical Endocrinology& Metabolism,2003,88(2):755-762.
[4] Roh JS,Bondestam J,Mazerbourg S,etal.Growth differentiation factor -9 stimulates inhibin production and activates Smad2 in cultured rat granulosa cells[J].Endocrinology,2003,144(1):172-178.
[5] LiaoW X,Moore RK,ShimasakiS.Functionalandmolecular characterization of naturally occurringmutations in the oocyte-secreted factors bonemorphogenetic protein-15 and growth and differentiation factor-9 [J].JournalofBiologicalChemistry,2004,279(17):17391-17396.
[6] Wang J,Roy SK.Growth differentiation factor-9 and stem cell factor promote primordial follicle formation in the hamster:modulation by follicle-stimulating hormone[J].Biology of Reproduction,2004,70 (3):577-585.
[7] SadighiM,Bodensteiner K J,Beattie A E,et al.Genetic mapping of ovinegrowth differentiation factor9(GDF9)tosheep chromosome5[J]. AnimalGenetics,2002,33(3):244-245.
[8] Bodensteiner K J,Clay CM,Moeller CL,etal.Molecular cloningof the ovinegrowth/differentiation factor-9 geneand expression ofgrowth/differentiation factor-9 in ovineand bovine ovaries[J].Biology ofReproduction,1999,60(2):381-386.
[9] Silva JRV,Van den Hurk R,Van TolH TA,etal.Expression ofgrowth differentiation factor9(GDF9),bonemorphogenetic protein15(BMP15), and BMP receptors in theovariesofgoats[J].Molecular Reproduction and Development,2005,70(1):11-19.
[10]Hanrahan JP,Gregan SM,MulsantP,etal.Mutations in the genes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovis aries)[J].Biology of Reproduction,2004,70(4):900-909.
[11]BarzegariA,Atashpaz S,GhabiliK,etal.Polymorphisms in GDF9 and BMP15 associated with fertility and ovulation rate in Moghani and Ghezelsheep in Iran[J].Reproduction in Domestic Animals,2010,45 (4):666-669.
[12]Javanmard A,Azadzadeh N,Esmailizadeh A K.Mutations in bonemorphogenetic protein 15 and growth differentiation factor 9 genes are associated with increased litter size in fat-tailed sheep breeds[J]. Veterinary Research Communications,2011,35(3):157-167.
[13]左北瑶,钱宏光,刘佳森,等.德国肉用美利奴羊BMPR-IB,BMP15 和GDF9基因10个突变位点的多态性检测分析[J].南京农业大学学报,2012,35(3):114-120.
[14]Zuo B Y,Qian H G,Wang Z Y,et al.A study on BMPR-IB genes of Bayanbulak Sheep[J].Asian-Australasian Journalof AnimalSciences,2013,26(1):36-42.
[15]McGrath SA,EsquelaAF,LeeSJ.Oocyte-specificexpressionofgrowth/ differentiation factor-9[J].MolecularEndocrinology,1995,9(1):131-136.
[16]Dong J,AlbertiniDF,NishimoriK,etal.Growth differentiation factor-9 is required duringearlyovarian folliculogenesis[J].Nature,1996,383 (6600):531-535.
[17]Chu M X,LiB X,Wang JY,etal.Association between PCR-SSCP of growth differentiation factor 9 gene and high prolificacy in Small Tail Han sheep[J].AnimalBiotechnology,2004,15(2):111-120.
[18]HayashiM,McGee E A,Min G,et al.Recombinantgrowth differentiation factor-9(GDF-9)enhancesgrowth and differentiation of cultured earlyovarian follicles[J].Endocrinology,1999,140(3):1236-1244.
[19]Juengel J L,Hudson N L,Whiting L,et al.Effects of immunization againstbonemorphogenetic protein 15 and growth differentiation factor 9 on ovulation rate,fertilization,and pregnancy in ewes[J].Biology of Reproduction,2004,70(3):557-561.
[20]李碧侠,储明星,王金玉.生长分化因子9基因的研究进展[J].中国畜牧兽医,2002,29(6):33-36.
[21]Polley S,De S,Brahma B,et al.Polymorphism of BMPR1B,BMP15 and GDF9 fecunditygenesin prolificGarolesheep[J].TropicalAnimal Health and Production,2010,42(5):985-993.
[22]Roy J,Polley S,De S,et al.Polymorphism of fecundity genes(FecB,FecX,and FecG)in the Indian Bonpala sheep[J].Animal Biotechnology,2011,22(3):151-162.
[23]Polley S,De S,Batabyal S,et al.Polymorphism of fecundity genes (BMPR1B,BMP15 and GDF9)in the Indian prolific Black Bengal goat[J].SmallRuminantResearch,2009,85(2):122-129.
[24]Chu M X,Yang J,Feng T,etal.GDF9 asa candidategene for prolificacy of Small TailHan sheep[J].Molecular Biology Reports,2011,38(8):5199-5204.
[25]储明星,桑林华,王金玉,等.小尾寒羊高繁殖力候选基因BMP15 和GDF9的研究[J].遗传学报,2005,32(1):38-45.
[26]耿彩霞,冯涛,储明星,等.绵羊GDF9基因FecTT突变检测[J].安徽农业大学学报,2011,38(3):341-345.
[27]王金鑫,冯涛,储明星,等.山羊生长分化因子9基因FecTT突变检测[J].中国畜牧兽医,2013,40(3):123-125.
[28]Chu M X,Wu ZH,Feng T,etal.Polymorphism of GDF9 gene and its association with litter size in goats[J].Veterinary Research Communications,2011,35(6):329-336.
[29]Feng T,Geng C X,Lang X Z,et al.Polymorphisms of caprine GDF9 gene and their association with litter size in Jining Grey goats[J]. Molecular Biology Reports,2011,38(8):5189-5197.
[30]金慧慧,储明星,潘章源,等.16种山羊和6种绵羊GDF9基因G7 和FecGV突变检测[J].安徽农业大学学报,2015,42(1):104-109.
[31]Liandris E,Kominakis A,Andreadou M,et al.Associations between single nucleotide polymorphismsof GDF9 and BMP15 genesand litter size in twodairysheep breedsofGreece[J].SmallRuminantResearch,2012,107(1):16-21.
[32]PazE,Quinones J,Bravo S,etal.Identification ofG1 and G8 polymorphismsof GDF9geneinAraucanoCreolesheep[J].ArchivosDeMedicina Veterinaria,2014,46(2):327-331.
Detection of the G1Mutation of the GDF9Gene in Seven Sheep and Four Goat Breeds
Guligena1,Aimaiti·Maimaiti1,Chu Mingxing2,etal
(1.Institute of Animal Science,Xinjiang Academy of Animal Sciences,Urumqi830000,China; 2.Key Laboratory of Farm Animal Genetic Resources and Germplasm Innovation of Ministry of Agriculture,Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing100193,China)
Previous studies had shown that the G1mutation of the GDF9 gene had significanteffecton fecundity of some sheep breeds.Theaim of thisstudywas todetect the distribution ofG1mutation of GDF9 gene in seven sheep breeds(Small TailHan,Hu,Wadi,Dorset,Texel,Dorper,Germany Mutton Merino sheep)and four goatbreeds(Jining Grey,GuizhouWhite,Liaoning Cashmere,InnerMongolia Cashmere goat)by using PCR-RFLP.The results indicated that InnerMongolia Cashmeregoathad no theG1mutation,theother ten breeds tested had theG1mutation.
sheep;goat;fecundity;GDF9 gene;PCR-RFLP
S826.2
A
2095-3887(2015)04-0001-04
10.3969/j.issn.2095-3887.2015.04.001
2015-04-27
新疆维吾尔自治区科技支疆项目(2013911056);中国农业科学院科技创新工程(ASTIP-IAS13);国家肉羊产业技术体系专项(CARS-39)
古丽格娜,女,副研究员。
储明星,男,研究员,博士,博士生导师。
