水分胁迫对桂花幼苗生长及保护酶的影响
2015-12-28夏伟琦常慧萍邢文会
夏伟琦 ,常慧萍,邢文会,杨 雪 ,王 丁
(1.河南省舞钢市国有石漫滩林场,河南舞钢462500;2.河南教育学院,河南郑州450046)
水分是限制植物生长发育的重要因子,抗旱性是植物的一个重要生理指标,水分胁迫下植物细胞产生大量的活性氧,引起细胞膜出现过氧化作用,导致细胞膜系统发生变性,严重影响植株的生长发育[1]。生物体经过长期进化,形成复杂和完善的酶类及非酶类抗氧化保护系统以清除活性氧[2]。各酶协调的综合作用对整个保护酶系统的防御能力起着决定作用。桂花(Osmanthus fragrans Lour.)属木犀科木犀属常绿木本植物,为我国十大传统名花之一,也是重要的经济树种,被广泛应用于酿造、茶叶加工、食品和饮料中。该研究通过盆栽试验,探讨不同程度水分胁迫下桂花幼苗的生理生化响应,分析幼苗的抗旱能力,以期为桂花的水分管理和抗逆性栽培提供理论依据。
1 材料与方法
1.1 材料
桂花苗木为生长健壮、长势一致的2年生扦插苗。土壤取自林地,有效氮、磷、钾含量分别为202.5、14.7、91.6mg/kg,有机质含量为 15.3g/kg,pH 6.6。
1.2 方法
1.2 .1 试验设计。试验在舞钢市石漫滩林场苗圃进行。试验设计5个水分胁迫梯度,分别为土壤田间持水量的 10%(A1)、25%(A2)、40%(A3)、55%(A4)、70%(A5,CK)。将苗木移栽到 16.0 cm×17.5 cm×13.0 cm的加仑盆中,每盆装土2.5 kg,每处理3个重复,每重复5盆,共15盆。按试验要求进行水分胁迫处理,每天8:00采用称重法补水、控水并记录,试验期间除土壤水分明显差异外其他管理相同,确保土壤田间持水量控制在设定范围内。水分胁迫处理开始后分别于第1天、第10天、第20天采集2~3轮完整的功能叶,每处理采集10棵植株叶片作为混合样品,测定各项生理指标。生物量指标在水分胁迫试验结束后测定。
1.2.2 测定指标与方法。
1.2.2.1 生物量的测定。试验结束后,测定各处理桂花苗地下部分根鲜重、地上部分茎叶鲜重,然后80℃烘干至恒重,再分别测定各部分的干重。根据公式:根冠比=根干重/地上部分干重,计算根冠比。
1.2.2.2 生理生化指标的测定。采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性[3];采用愈创木酚显色法测定过氧化物酶(POD)活性[4];采用硫代巴比妥酸法测定丙二醛(MDA)含量[3]。
1.2.3 数据处理。采用Excel 2013软件对试验数据进行分析。
2 结果与分析
2.1 水分胁迫对桂花幼苗生物量的影响
在不同程度的水分胁迫下,桂花幼苗生物量与根冠比见表1。A1、A2、A3、A4和A5(CK)处理下,桂花幼苗总生物量分别为 7.26、8.21、9.87、11.47、12.02 g,各处理为对照的60.4%、68.3%、82.1%和95.4%,说明水分胁迫抑制桂花幼苗的生长,抑制程度与水分胁迫强度有关,重度水分胁迫的A1处理最显著。不同程度的水分胁迫,影响桂花幼苗生物量的分配,根冠比反映了植物地下部分与地上部分的相关性。各种处理下,根冠比为A1>A2>A3>A4>A5(CK),随水分胁迫程度增加,根冠比增大,说明在水分匮乏时,植物通过促进根系生长增大根冠比,增强其抗逆性。
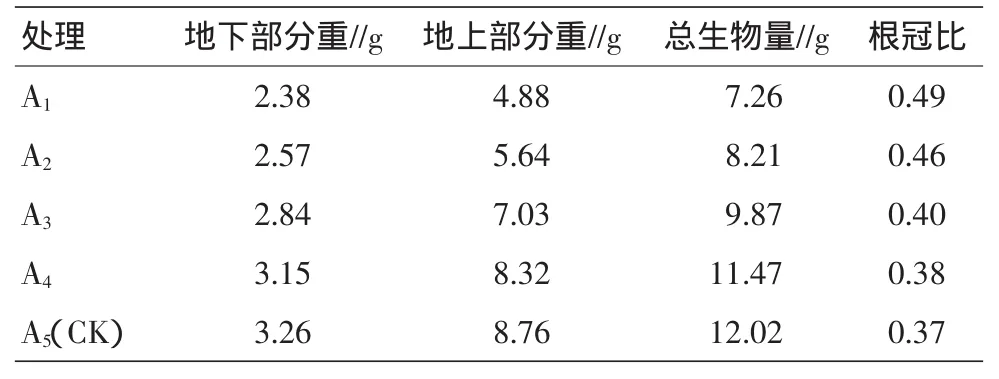
表1 水分胁迫下桂花幼苗的生物量和根冠比
2.2 水分胁迫对桂花幼苗叶片SOD活性的影响
不同程度水分胁迫下桂花幼苗叶片SOD活性的变化见图1。由图1可以看出,不同处理SOD的活性均呈现“升高-降低”的变化趋势,变化幅度因水分胁迫程度各异。水分胁迫第 10 天时,A1、A2、A3、A4各处理叶片的SOD活性较第l天分别升高了110.2%、103.7%、69.0%、43.7%,说明干旱程度大,SOD活性提高更迅速,清除自由基的能力加强。第20天时,各处理的SOD活性急剧下降,较第10天时分别下降了68.6%、55.7%、40.1%、21.6%,表明随着胁迫时间的延长,自由基大量增加,SOD迅速被消耗,活性下降。A1处理SOD活性的升高(110.2%)和下降(68.6%)表现最为显著,而正常水分供应情况下A5(CK)处理的SOD活性变化不显著(比第1天升高了18.6%)。

图1 水分胁迫下桂花幼苗叶片SOD活性的变化
2.3 水分胁迫对桂花幼苗叶片POD活性的影响
水分胁迫下,桂花幼苗叶片POD活性的变化见图2。由图2可知,POD的活性在不同处理下均呈现“升高-降低”的变化趋势,变化幅度与水分胁迫程度有关。水分胁迫第 10 天时,A1、A2、A3、A4各处理叶片的 POD活性较第 l天升高了 177.3%、136.8%、76.0%、22.6%,说明水分胁迫程度越大,POD活性提高越快。第20天时,各处理的POD活性趋于下降,较第 10天时分别下降了 30.0%、21.6%、15.4%、10.5%,表明随着水分胁迫程度的增加,胁迫时间的延长,POD活性下降较快。A1处理POD活性的升高(177.2%)和下降(30.0%)表现最为明显。而正常水分供应情况下,A5(CK)的POD活性变化不显著,比第1天升高了15.1%。
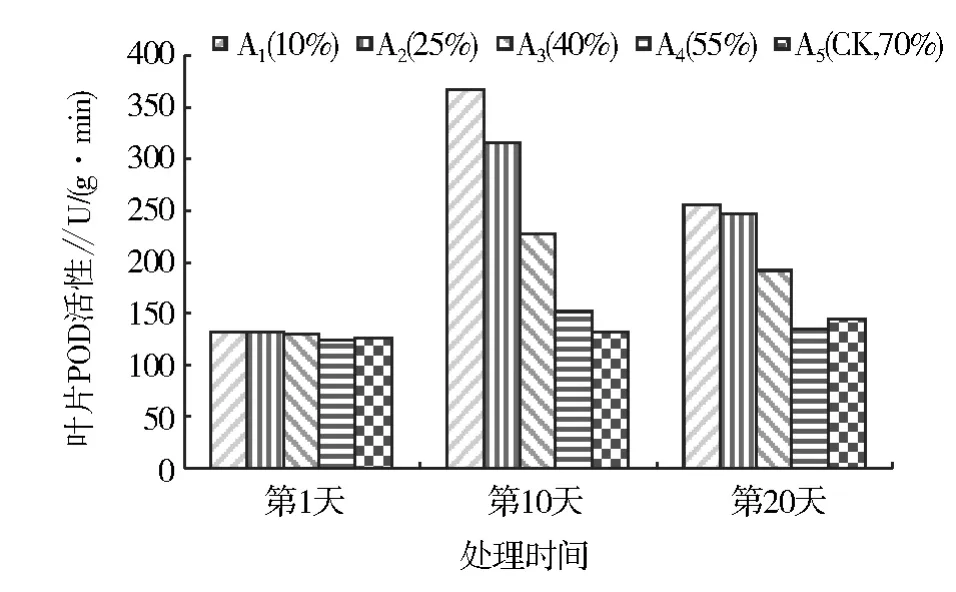
图2 水分胁迫下桂花幼苗叶片POD活性的变化
2.4 水分胁迫对桂花幼苗叶片MDA含量的影响
桂花幼苗叶片MDA活性受水分胁迫的影响见图3。由图3可知,在水分胁迫下,桂花幼苗叶片MDA含量随着水分胁迫程度的增加和时间的延长而增大。A1、A2、A3、A4各处理的第 20 天较第 1 天,MDA分别增加了65.7%、57.6%、46.9%、17.1%,分别比对照增加了70.6%、52.9%、38.2%、20.6%,说明水分胁迫程度越大,细胞膜脂过氧化程度越强,对植物的毒害越大。
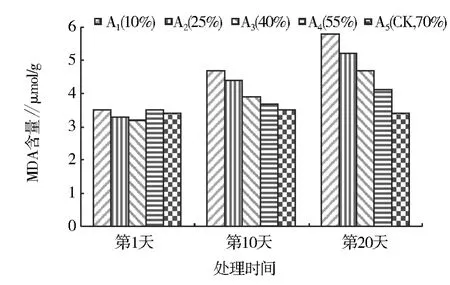
图3 水分胁迫下桂花幼苗叶片MDA含量的变化
3 结论与讨论
普遍认为,水分胁迫是限制植物生长的重要逆境因子,影响植物光合产物的生产、运输、积累与分配。当土壤水分含量降低时,光合产物更多地向根系分配以促进植物生长。研究表明,根系发达程度与抗旱性呈正相关,根冠比大可作为选择抗旱品种的形态指标[5]。SOD和POD是植物体内负责清除自由基和活性氧的主要酶类。水分胁迫下,桂花叶片SOD和POD的活性呈现出“升高-降低”的模式,说明水分胁迫短时间内可能激发桂花叶片的防御机制,诱导植物合成更多的SOD和POD来清除体内产生的自由基和活性氧,使其免受干旱伤害[6]。但桂花通过提高SOD和POD活性增加其抗干旱能力有限,当水分胁迫到达一定程度时,SOD和POD活性就开始下降。SOD和POD活性的变化趋势基本一致,说明在桂花的抗旱机制中,SOD和POD是协同作用的。MDA是膜脂过氧化的产物之一,在细胞内含量反映了脂质过氧化强度和膜系统受伤害的程度,是逆境生理中的一个重要指标。轻度水分胁迫桂花叶片内MDA含量较低,是植物自身防御的结果,重度水分胁迫叶片受害较明显,叶片MDA含量略有所增加。
[1]吴志华,曾富华,马生健,等.水分胁迫下植物活性氧代谢研究进展(综述Ⅰ)[J].亚热带植物科学,2004,33(2):77-80
[2]赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的相应机制[J].西北植物学报,2005,25(2):413-418
[3]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术,2002.
[4]汤章城,魏家绵,陈因,等.现代植物生理学实验指南[M].北京:科学技术出版社,1990.
[5]杨洪强,贾文锁,张大鹏.水分胁迫下湖北海棠根系脂氧合酶活性与 ABA 积累的关系[J].植物学报,2000,42(3):244-248.
[6]徐广平,何成新,李先琨.园林植物桂花叶片矿质元素及生理特征对冬季异常低温的响应[J].核农学报,2013,27(3):365-372.
