结核分枝杆菌中O-甘露糖基化蛋白功能的研究进展
2015-12-27杨淑凤邓国英王晓丽孙文长
杨淑凤, 刘 欣, 邓国英, 王晓丽, 孙文长
(大连医科大学 微生物学教研室,辽宁 大连 116044)
结核分枝杆菌中O-甘露糖基化蛋白功能的研究进展
杨淑凤, 刘 欣, 邓国英, 王晓丽, 孙文长*
(大连医科大学 微生物学教研室,辽宁 大连 116044)
蛋白质的O-甘露糖基化修饰不仅在真菌和哺乳类细胞中广泛存在,在原核生物中例如分枝杆菌属、棒状杆菌属和链霉菌属中也存在,尤其在引起人类疾病的结核分枝杆菌中研究最多。许多O-甘露糖基化蛋白在结核分枝杆菌毒力以及与宿主相互作用过程中发挥了重要作用。本文就结核分枝杆菌中O-甘露糖基化蛋白生物学功能的进展加以综述。
结核分枝杆菌;O-甘露糖基化;Apa蛋白;ConA-lectin
蛋白质O-甘露糖基化修饰在真菌和哺乳类细胞中广泛存在,近年来发现在原核生物中也存在着这种翻译后修饰形式,例如分枝杆菌属(Mycobacterium)、棒状杆菌属(Corynebaterium)以及链霉菌属(Streptomyces)等,其中以引起人类结核病的结核分枝杆菌(Mycobacteriumtuberculosis)研究最多。结核分枝杆菌中存在的O-甘露糖基化蛋白多为免疫活性分子,在细菌致病性以及细菌与宿主细胞相互作用中发挥了重要作用[1]。本文将重点介绍结核分枝杆菌中O-甘露糖基化蛋白生物学作用的进展。
1 概 述
结核分枝杆菌O-甘露糖基化蛋白多为细菌分泌蛋白和细菌表面蛋白[2]。该菌几乎所有的O-甘露糖基化蛋白都带有一个分泌用的信号肽[2],这种定位也预示着在蛋白甘露糖基化过程与蛋白穿梭细菌外膜过程即分泌-转位(Sec-translocation)存在密切联系[3]。从最先确定带有甘露糖基化修饰的38 ku磷酸结合蛋白(Phosphate-Binding Lipoproteins,Pst-1)和45~47 ku的Apa蛋白(alanine and proline rich secreted protein,Apa)以来,陆续约有30多种O-糖基化蛋白得以确定[4]。表1列出了目前在结核分枝杆菌中发现的主要的O-甘露糖基化蛋白及其大致功能。
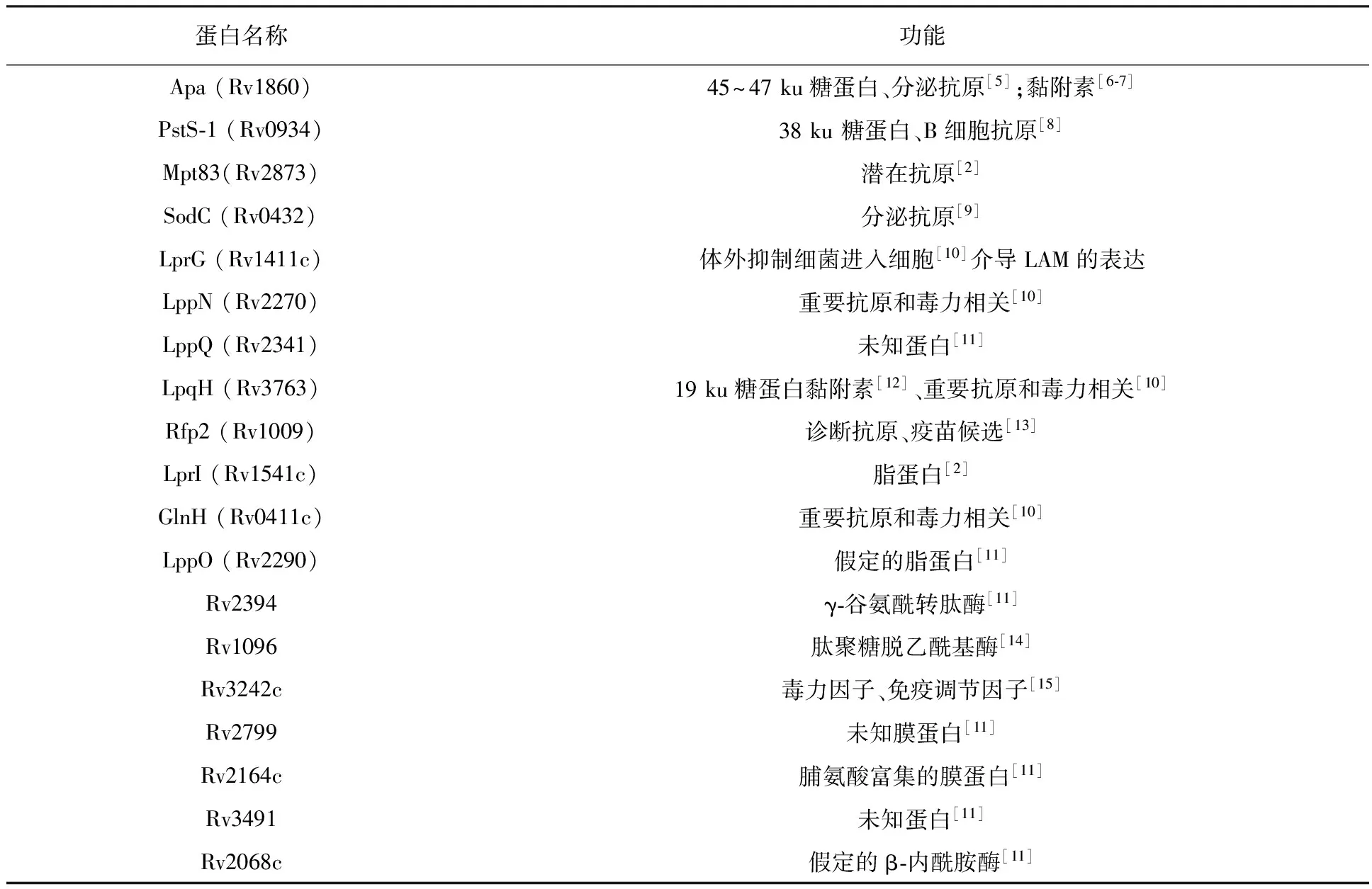
表1 结核分枝杆菌存在的主要O-甘露糖基化蛋白
2 O-甘露糖基化蛋白参与细菌与宿主细胞的相互作用
2.1 结核分枝杆菌的甘露糖受体(mannose receptor,MR)识别方式
甘露糖定殖基化蛋白在结核分枝杆菌入侵和定殖的过程中发挥了重要作用。该菌能够运用多种策略适应和逃避宿主免疫应答,其中借助细菌表面的甘露糖基化生物分子与巨噬细胞表面特定受体的相互作用,并介导进入巨噬细胞的过程就是其中之一[16]。巨噬细胞表面识别甘露糖生物分子的受体主要为C型凝集素受体,例如甘露糖受体、DC-SIGN(DC-specific intercellular adhesion molecule-3 grabbing nonintegrin,DC-SIGN)以及人类肺表面活性蛋白A(surfactant Protein A,SP-A)等。而通过MR等介导进入巨噬细胞内的受体识别途径并不引起NADPH(Nicotinamide Adenine Dinucleotide Phosphate,烟酰胺腺嘌呤二核苷磷酸即还原型辅酶Ⅱ)的激活和吞噬小体的成熟,从而使结核分枝杆菌存活在利于其存活的吞噬囊泡中[16]。细菌的甘露糖基化生物分子除了甘露糖帽脂阿拉伯甘露聚糖(ManLAM) 之外还包括甘露糖基化蛋白[16]。
2.2 O-甘露糖基化蛋白参与受体识别
结核分枝杆菌O-甘露糖基化蛋白可以作为黏附素(adhesin)与巨噬细胞表面特定的C型凝集素受体(lectin receptor, CR)结合[17]。例如最早发现的结核O-甘露糖基化蛋白Apa与肺SP-A结合并介导细菌定殖到细胞内[6];19 ku的LpqH (Rv3763)能在体外与人单核吞噬细胞THP-1表面MR结合,提高巨噬细胞对结核菌的嗜菌作用并定殖在细胞内[12]。有些糖蛋白能被巨噬细胞表面的另外一种受体——Toll样受体(Toll-like Receptors,TLR)2识别。例如PstS-1能通过激活TLR2、TNF-α和FasL来诱导巨噬细胞的凋亡[18]。其他的糖脂蛋白如LpqH和LprG通过与TLR2相互作用能引起宿主细胞发生一系列的生物学效应。例如抑制MHC-II和MHC-I的抗原加工和递呈,从而干扰CD4+和CD8+T细胞效应[10,19]。而且值得一提的是LprG在体内激活MHC II类T细胞依赖其甘露糖基化的修饰结构[19]。
2.3 O-甘露糖基化蛋白是重要的抗原
最近的研究表明,结核分枝杆菌的很多脂蛋白是宿主多克隆T细胞的主要靶分子[20],而O-甘露糖基化蛋白大部分为脂蛋白。因此,结核分枝杆菌O-甘露糖基化蛋白可以作为重要的B细胞抗原和T细胞抗原用于血清诊断甚至疫苗研发。除了研究较为明确的Apa抗原和Mbp83之外,B细胞抗原PstS-1[8,18]和复发促进因子Rpf[13]等就是潜在的血清诊断抗原;Apa同时又是重要的T抗原,这里需要指出的是Apa的O-甘露糖基化修饰是T细胞抗原所需的,但在免疫反应性和免疫保护性却是非必需的[6-7],这也意味着Apa可以联合免疫佐剂作为疫苗的候选。
3 O-甘露糖基化蛋白提高细菌的致病性
3.1 O-甘露糖基化蛋白提高细菌的毒力
结核分枝杆菌的毒力研究多集中在LAM上,除此之外,O-甘露糖基化蛋白也表现出和毒力相关的功能。Marisol O等[10]利用高活性结合肽(high activity binding peptides,HABPs) 的方法从Rv1411c(LprG)、Rv2270(LppN)和Rv3763 (LpqH)等脂蛋白中分离到5个肽段,这些肽段均具有与肺泡上皮细胞和单核巨噬细胞高度特异结合的特性。进一步的体外试验结果显示,肺泡上皮细胞和单核巨噬细胞与这些特异性肽段特异结合后,对结核分枝杆菌的吞噬下降。换而言之,在LprG、LppN 和LpqH脂蛋白上存在着与宿主细胞相互作用的核心结构,而且这些核心结构极有可能影响细菌的抗原和毒力[10]。最新的研究表明,LprG是通过其甘露糖修饰来影响结核毒力因子ManLAM在菌体表面的表达[19]。结核磷酸核酮糖激酶Rv3242c也是O-甘露糖基化蛋白,在斑马鱼体内能够通过抑制氧压力和自噬途径来提高细菌在巨噬细胞内的存活[15]。
3.2 Rv1002c是重要的毒力因子
结核分枝杆菌中催化蛋白质发生O-甘露糖基化修饰的关键酶本身也是毒力因子。原核生物中蛋白质O-甘露糖基化的过程远没有真核生物中研究的广泛。真核生物中蛋白质O甘露糖基化过程的关键酶是蛋白O-甘露糖基转移酶(PMT),通过生物信息学比对的方法发现,在结核分枝杆菌中存在的唯一PMT是Rv1002c。Chia-Fang等[21]分别将结核分枝杆菌的Rv1002c和非致病性的耻垢分枝杆菌的pmt(Ms5447)敲除后,发现在非致病结核分枝杆菌中,pmt的敲除并不影响细菌的存活;而在有毒的结核分枝杆菌中Rv1002c的敲除严重影响了细菌体外生长甚至菌落的形成;除此之外,敲除株的生长受限性在补充野生株Rv1002c基因后又得到恢复。这些结果说明Rv1002c是结核分枝杆菌重要的生长必需因子。而进一步的动物实验结果表明,Rv1002c基因突变的结核分枝杆菌丧失对免疫缺陷小鼠的致病性[21]。可见O-甘露糖基化修饰对于维持结核分枝杆菌毒力的重要性。
4 结 语
蛋白质的翻译后修饰对于蛋白功能有着重要的影响,尤其是甘露糖基化修饰。蛋白质O-甘露糖基化修饰在真核生物中尤其哺乳类细胞中分布非常广泛,也影响着许多蛋白例如钙粘蛋白等的功能。原核生物中蛋白质O-甘露糖基化修饰存在也说明这种翻译后修饰非常保守并且非常重要。对于蛋白质O-甘露糖基化的修饰研究更多依赖于技术方法的改进,相信随着质谱技术和分子生物学技术的突飞猛进,对于细菌中这种重要的翻译后修饰过程和功能的认识将日益清晰,也必将为结核病的控制和治疗提供新的思路。
[1] van Els CA, Corbiere V, Smits K, et al. Toward Understanding the Essence of Post-Translational Modifications for the Mycobacterium tuberculosis Immunoproteome[J]. Front Immunol, 2014,5:361.
[2] Espitia C, Servin-Gonzalez L, Mancilla R. New insights into protein O-mannosylation in actinomycetes[J]. Mol Biosyst, 2010,6(5):775-781.
[3] VanderVen BC, Harder JD, Crick DC, et al. Export-mediated assembly of mycobacterial glycoproteins parallels eukaryotic pathways[J]. Science, 2005,309(5736):941-943.
[4] 杨淑凤,刘欣,邓国英,等. 放线菌蛋白O甘露糖基化的研究进展[J]. 生命的化学, 2015,35(2):4.
[5] Horn C, Namane A, Pescher P, et al. Decreased capacity of recombinant 45/47-kDa molecules (Apa) ofMycobacteriumtuberculosisto stimulate T lymphocyte responses related to changes in their mannosylation pattern[J]. J Biol Chem, 1999,274(45):32023-32030.
[6] Ragas A, Roussel L, Puzo G, et al. TheMycobacteriumtuberculosiscell-surface glycoprotein apa as a potential adhesin to colonize target cells via the innate immune system pulmonary C-type lectin surfactant protein A[J]. J Biol Chem, 2007,282(8):5133-5142.
[7] Nandakumar S, Kannanganat S, Dobos KM, et al. O-mannosylation of theMycobacteriumtuberculosisadhesin Apa is crucial for T cell antigenicity during infection but is expendable for protection [J]. PLoS Pathog, 2013,9(10):e1003705.
[8] Steingart KR, Dendukuri N, Henry M,et al. Performance of purified antigens for serodiagnosis of pulmonary tuberculosis: a meta-analysis [J]. Clin Vaccine Immunol, 2009,16(2):260-276.
[9] Sartain MJ, Belisle JT. N-Terminal clustering of the O-glycosylation sites in theMycobacteriumtuberculosislipoprotein SodC [J]. Glycobiology, 2009,19(1):38-51.
[10]Ocampo M, Curtidor H, Vanegas M, et al. Specific interaction betweenMycobacteriumtuberculosislipoprotein-derived peptides and target cells inhibits mycobacterial entryinvitro[J]. Chem Biol Drug Des, 2014,84(6):626-641.
[11]Smith GT, Sweredoski MJ, Hess S. O-linked glycosylation sites profiling inMycobacteriumtuberculosisculture filtrate proteins [J]. J Proteomics, 2014,97:296-306.
[12]Diaz-Silvestre H, Espinosa-Cueto P, Sanchez-Gonzalez A, et al. The 19kDa antigen ofMycobacteriumtuberculosisis a major adhesin that binds the mannose receptor of THP-1 monocytic cells and promotes phagocytosis of mycobacteria [J]. Microb Pathog, 2005,39(3):97-107.
[13]Romano M, Aryan E, Korf H,et al. Potential ofMycobacteriumtuberculosisresuscitation-promoting factors as antigens in novel tuberculosis sub-unit vaccines[J]. Microbes Infect, 2012,14(1):86-95.
[14]Yang S, Zhang F, Kang J,et al.MycobacteriumtuberculosisRv1096 protein: gene cloning, protein expression, and peptidoglycan deacetylase activity[J]. BMC Microbiol, 2014,14:174.
[15]Mohanty S, Jagannathan L, Ganguli G, et al. A mycobacterial phosphoribosyltransferase promotes bacillary survival by inhibiting oxidative stress and autophagy pathways in macrophages and zebrafish[J]. J Biol Chem, 2015,290(21):13321-13343.
[16]Torrelles JB, Schlesinger LS. Diversity inMycobacteriumtuberculosismannosylated cell wall determinants impacts adaptation to the host[J]. Tuberculosis (Edinb), 2010,90(2):84-93.
[17]Killick KE, Ni Cheallaigh C, O’Farrelly C, et al. Receptor-mediated recognition of mycobacterial pathogens[J]. Cell Microbiol,2013,15(9):1484-1495.
[18]Araujo LS, Mello FC, Silva Nde B,et al. Evaluation of gamma interferon immune response elicited by the newly constructed PstS-1(285-374):CFP10 fusion protein to detectMycobacteriumtuberculosisinfection[J]. Clin Vaccine Immunol, 2014,21(4):552-560.
[19]Gaur RL, Ren K, Blumenthal A, et al. LprG-mediated surface expression of lipoarabinomannan is essential for virulence ofMycobacteriumtuberculosis[J]. PLoS Pathog, 2014,10(9):e1004376.
[20]Seshadri C, Turner MT, Lewinsohn DM, et al. Lipoproteins are major targets of the polyclonal human T cell response toMycobacteriumtuberculosis[J]. J Immunol, 2013,190(1):278-284.
[21]Liu CF, Tonini L, Malaga W, et al. Bacterial protein-O-mannosylating enzyme is crucial for virulence ofMycobacteriumtuberculosis[J]. Proc Natl Acad Sci U S A, 2013,110(16):6560-6565.
Advances in O-Mannosylated Proteins in Mycobacterium tuberculosis
YANG Shu-feng, LIU Xin, DENG Guo-ying, WANG Xiao-li, SUN Wen-chang
(Dept.ofMicrobiol.,DalianMed.Uni.,Dalian116044)
O-mannosylation decoration of proteins not only widely exists in fungal and mammalian cells, but also exists in prokaryotes, e.g.Mycobacterium,CorynebateriumandStreptomyces, especially inMycobacteriumtuberculosisthat causes human illness and draw studies the most. Many O-mannosylated proteins play important role during mutual actions inM.tuberculosisvirulence and the host. Advances in biological function of O-mannosylated proteins inM.tuberculosiswere summarized in this paper.
Mycobacteriumtuberculosis;O-mannosylation;Apa;ConA-lectin
杨淑凤 女,讲师,博士。从事结核分枝杆菌细胞壁甘露糖基化蛋白功能研究。Tel:0411-86110303,
E-mail:shufengyang78@163.com
2015-06-12;
2015-07-07
Q936
A
1005-7021(2015)04-0098-04
10.3969/j.issn.1005-7021.2015.04.017
* 通讯作者。男,博士,副教授。从事病原微生物学研究。Tel:0411-86110303,E-mail:2981264350@qq.com