螺旋藻蛋白酶解剂的筛选与优化
2015-12-26张军,邹宁,孙东红等
螺旋藻蛋白酶解剂的筛选与优化
张 军, 邹 宁*, 孙东红, 曲青梅, 李小慧
(鲁东大学生命科学学院,山东烟台 264000)
摘要[目的]筛选并优化螺旋藻蛋白酶解剂。 [方法]采用酶解法初步研究了中性蛋白酶、复合蛋白酶、风味蛋白酶、碱性蛋白酶4种蛋白酶对螺旋藻蛋白质的水解效果,同时研究了底物浓度和酶的添加量对水解率的影响。[结果]结果表明,蛋白酶按酶解螺旋藻蛋白质的水解率,可由高到低依次排列为:碱性蛋白酶、风味蛋白酶、复合蛋白酶、中性蛋白酶。通过对酶解条件进行优化,发现碱性蛋白酶的作用效果受pH影响最大,最高水解率为60.5%(底物浓度20 g/L、E/S=4%、pH=8.9、55 ℃、酶解5 h)。同时得出,碱性蛋白酶、复合蛋白酶、中性蛋白酶的最佳底物浓度均为20 g/L,最佳酶添加量均为4%,而风味蛋白酶的最佳底物浓度为20 g/L,最佳酶添加量为2%。[结论]研究可为后续功能性多肽的提取利用提供参考依据。
关键词螺旋藻;蛋白质;酶解;水解率;优化
中图分类号S917;Q7
作者简介张军(1991- ),男,山东枣庄人,硕士研究生,研究方向:藻类活性物质提取利用。*
收稿日期2015-06-01
Screening and Optimization of Hydrolysis of Spirulina Proteins by Enzymes
ZHANG Jun, ZOU Ning*, SUN Dong-hong et al (School of Life Science, Ludong University, Yantai, Shandong 264000)
Abstract[Objective] To screen and optimize Spirulina proteinase solution.[Method] Hydrolysis efficiency of four kinds of enzymes(neutral protease, complex protease, flavor protease, alkaline protease) on Spirulina proteins were preliminarily studied in this work. The effects of substrate concentration and enzyme adding amount on hydrolysis rate were studied. [Result] The results showed that the hydrolysis of alkali protease had the maximal HE which was followed by the efficiency of flavor enzyme, compound proteinase, neutral protease, sequentially. The efficiency of the alkali protease was apparently affected by pH compared with the others. Its maximal HE was 60.5%(substrate 20 g/L, E/S=4%, pH=8.9, 55 ℃, hydrolysis 5 h). The ratios of enzyme to substrate (E/S) and the substrate concentrations were optimized as well. The optimal substrate concentrations for the three kinds of enzymes was 20 g/L. The optimal enzyme concentrations was 4% for them. Whileoptimal flavor enzyme concentration was 2%, and its optimal substrate concentration was 20 g/L. [Conclusion] The study can provide reference basis for extraction and utilization of follow-up functional peptide.
Key wordsSpirulina; Proteins; Hydrolysis; HE; Optimization

螺旋藻中蛋白质含量可达60%~70%,含有丰富的维生素、叶酸和植物中罕见的γ-亚麻酸。试验表明,螺旋藻的摄入能提高机体免疫力[1-2],抗氧化功能也得到了证实[3]。螺旋藻含有具有防癌、抗癌功能的多糖[4]。不饱和脂肪酸及γ-亚麻酸,可以作为具有多种生理调节活性的前列腺素的前体,这些前体的衍生物具有使血管平滑肌舒张、降低血压的作用[5]。除各种用于常见防御、治疗用途外,螺旋藻在食品添加、污水处理等方面也有应用[6-8]。
酶法水解具有反应条件温和、反应进程容易控制、无毒害反应等特点,可有效去除螺旋藻腥味[9],且酶解后的蛋白有更高的优越性和更广泛的应用范围。螺旋藻蛋白酶解后的产物中,具有保健效果的寡肽和具有鲜味的氨基酸的含量均较丰富,酶解提取出的物质具有比水提和有机溶剂提取的物质更高的活性[10]。笔者对螺旋藻蛋白酶解进行初步探究,为后续功能性多肽的提取利用作准备。
1材料与方法
1.1材料该试验所用的钝顶螺旋藻(Spirulinaplatensis)由烟台华融生物科技有限公司生产提供。主要试剂:复合蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶均为诺维信品牌蛋白酶。主要仪器:分析天平(FC204),上海精科电子天平;水浴锅(HH-S),金坛市恒丰仪器厂;自动电位滴定仪(ZD-3A)、离心机(AK-1000)、恒温干燥箱(KA-1000),上海安亭科学仪器厂;凯氏定氮仪等。
1.2螺旋藻含水量与总蛋白质含量的测定水分测定:用已烘干至恒重0.259 0 g称量纸,精确称取螺旋藻1.000 2 g , 105 ℃烘至总恒重1.161 4 g,计算得螺旋藻水分为9.78%。蛋白测定:采用凯氏定氮法测螺旋藻中总蛋白质含量[11]。准确称取螺旋藻0.500 9 g,测得所用螺旋藻蛋白质含量为68.15%。
1.3螺旋藻的细胞破壁该试验采用反复冻融法进行螺旋藻的细胞破壁:配置一定体积浓度的螺旋藻溶液,反复冻融3次[12-13](室温避光融解,避免色素受到破坏)。
1.4螺旋藻的酶解配制一定浓度的螺旋藻溶液,反复冻融3次,转移至250 ml锥形瓶,水浴加热至55 ℃。
pH优化试验:用 NaOH溶液(0.05 mol/L)、柠檬酸溶液(5%)调节已转移至锥形瓶内的溶液的pH。对于风味蛋白酶、复合蛋白酶,溶液的pH梯度为6、7、8,对碱性蛋白酶,溶液的pH梯度为8.0、8.5、8.8、8.9、9.0、9.1、9.5。其他酶解条件:底物浓度40 g/L、E/S=4%、55 ℃、酶解5 h。
酶添加量优化试验:设置酶添加量为2%、4%、6%的梯度,其他试验条件为:底物浓度40 g/L、55 ℃、酶解5 h,中性蛋白酶、复合蛋白酶、风味蛋白酶作用时pH为7,碱性蛋白酶作用时pH为8.9。
底物浓度优化试验:设置底物浓度为20、40、60、80 g/L的梯度,优化碱性蛋白酶酶解时的底物浓度。其他酶解条件为pH 8.9,底物浓度为4%,反应温度为55 ℃。
酶解过程中每1 h测定溶液pH。酶解完成后,90 ℃灭酶20 min,降至室温后3 000 r/min离心20 min,待测。
1.5酶解液中氨基氮含量的测定该试验采用甲醛滴定法测定酶解液中氨基氮的含量[14]:
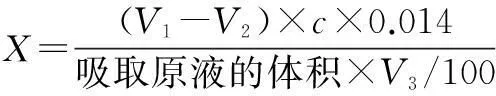
式中,X为试样中氨基酸态氮的含量(g/L);V1为酶解液稀释液在加入甲醛后滴定至pH 9.2所用NaOH标准溶液的体积(ml);V2为空白滴定在加入甲醛后滴定至pH 9.2所用NaOH标准溶液的体积(ml);V3为吸取稀释液体积20 ml;c为NaOH标准溶液的浓度(mol/L)。
1.6螺旋藻蛋白质水解率的计算[15]具体计算公式如下:
HE(%)=(样品游离氨基含量/样品蛋白质含量-0.663)/8.2 mmol/g×100
2结果与分析
2.1pH对螺旋藻蛋白质水解率的影响pH影响酶分子活性部位上有关基团的解离,从而影响与底物的结合或催化,使酶活性降低,也可能影响到中间络合物的解离状态,不利于催化生成产物[16]。图1、2、3为蛋白酶酶解时pH对风味蛋白酶、复合蛋白酶、碱性蛋白酶酶解螺旋藻蛋白质的水解率的影响(底物浓度40 g/L、E/S=4%、55 ℃、酶解5 h)。酶的活力受环境pH影响,在一定pH下,蛋白酶表现最大活力,高于或低于此pH,酶活力降低,该pH为最适pH。由图1、2、3可见,复合蛋白酶和风味酶的最适pH为7,碱性蛋白酶的最适pH为8.9。过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,酶丧失活性。当pH改变不很剧烈时,酶虽未变性,但pH影响了底物的解离状态,或使底物不能和酶结合,或者结合后不能产生产物。因此在非最适pH条件下水解率降低。
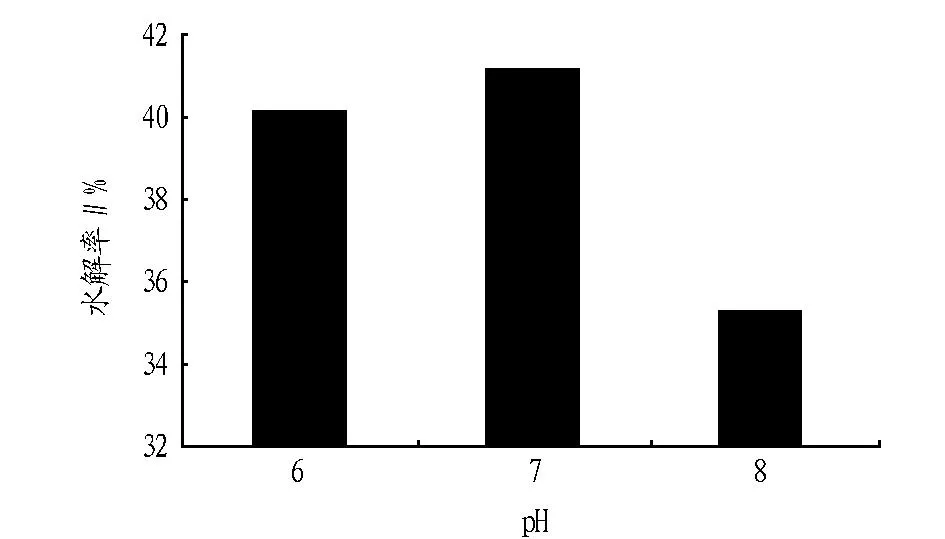
图1 pH对风味酶水解率的影响
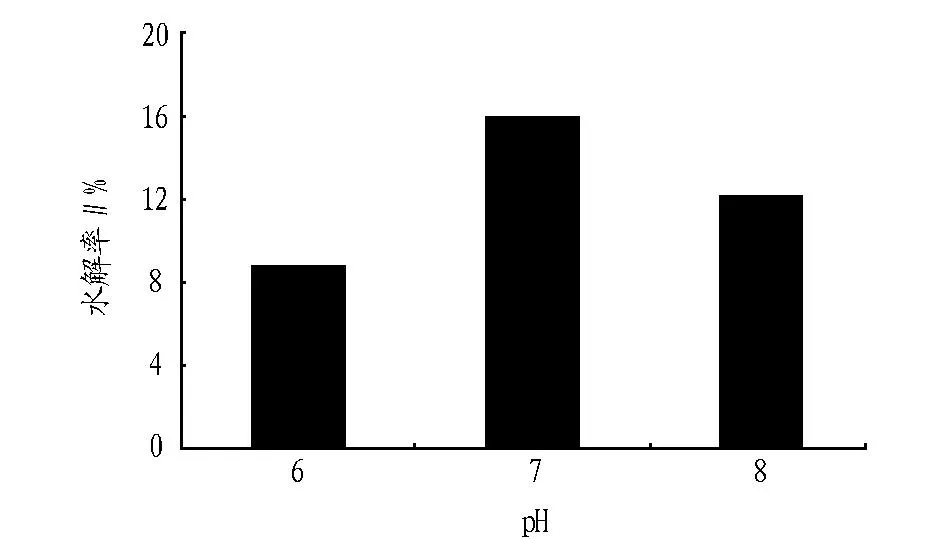
图2 pH对复合蛋白酶水解率的影响
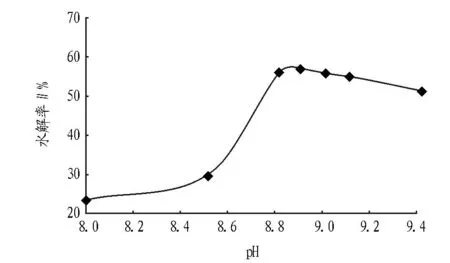
图3 pH对碱性蛋白酶水解率的影响
2.2E/S对螺旋藻蛋白质水解率的影响在一定添加量范围内,酶解效果随蛋白酶的添加量增大而提高。图4为不同的蛋白酶添加量下对应的水解率。碱性蛋白酶、中性蛋白酶和复合蛋白酶,在酶浓度较低时,底物过量,增加蛋白酶的量,可降低没有与酶的活性中心结合的底物的量,明显提高螺旋藻的水解率。超过4%的添加量,其用量接近足量,再继续添加蛋白酶,水解率升高幅度不大。而对于风味蛋白酶,2%的添加量已经接近足量,其用量提高对水解率的影响一直不大。
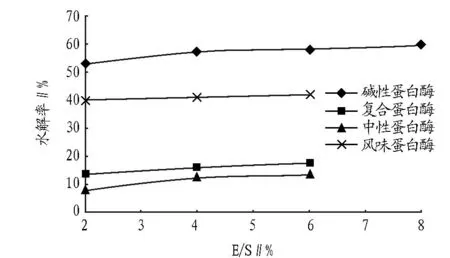
图4 蛋白酶添加量对水解率的影响
2.3底物浓度对螺旋藻蛋白质水解率的影响在一定添加量范围内,酶解效果随底物浓度增加而减小。图5所示碱性蛋白酶在不同底物浓度(pH 8.9、E/S为4%、55 ℃、水解5 h)下的水解率,可以看出,在该条件下,水解率随底物浓度的增大而减小。随着底物浓度的增加,溶液密度增高,变得黏稠,底物的有效浓度减小,底物中能与酶的活性中心结合并反应的底物比例下降,导致水解率降低。
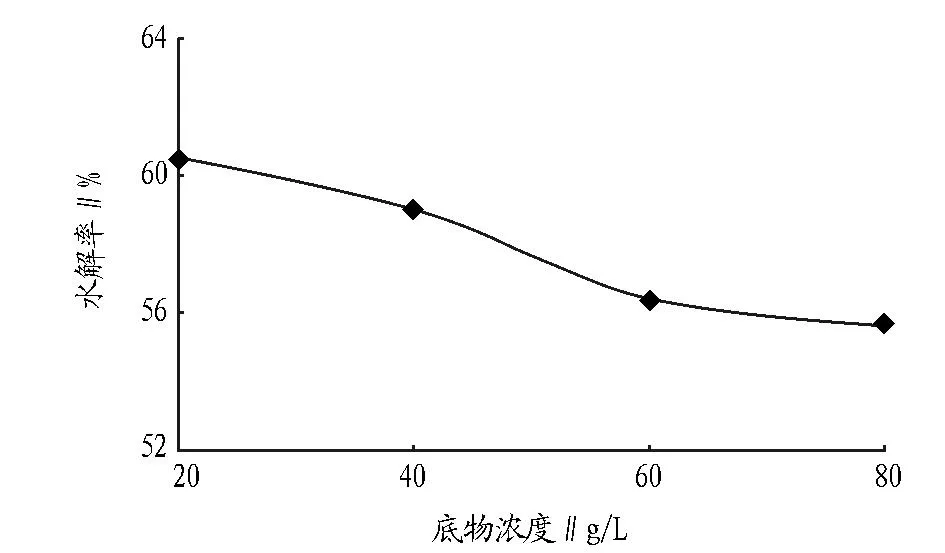
图5 底物浓度对螺旋藻蛋白质的水解率的影响
3结论与讨论
通过该试验可以看出,所用4种蛋白酶按对螺旋藻蛋白的水解率,由高到低依次为:碱性蛋白酶、风味蛋白酶、复合蛋白酶、中性蛋白酶。最佳水解条件为:底物浓度20 g/L,酶添加量为4%,反应温度为55 ℃,碱性蛋白酶的最适pH为8.9,其水解率可达到60.5%。复合蛋白酶、中性蛋白酶、风味蛋白酶的最适pH为7,最高水解率分别为16.0%、12.5%、41.1%。
试验过程中所算得氨基氮的量在酱油质量的评定中作为风味的指标。在底物浓度为20、40、60、80 g/L,其他条件为碱性蛋白酶的最适条件下,其氨基氮的含量分别为660、1 271、1 760、2 471 mg/L,具有良好的鲜味。蛋白酶主要催化水解蛋白质内部的肽键。水解率均在3~4 h后才变得平缓。如果希望得到更小分子的多肽和游离氨基酸,可通过延长水解时间实现[17]。该试验水解时间经反复试验确定为5 h。
酶解温度:所购买的碱性蛋白酶,推荐使用温度50~60 ℃,pH使用范围6.0~9.5;风味蛋白酶推荐使用温度45~50 ℃,pH使用范围4.5~8.0;若2种酶同时使用,反应温度为50 ℃。复合蛋白酶及中性蛋白酶推荐使用温度55 ℃,试验中反应温度定为55 ℃。考虑离心后的残渣的进一步酶解及酶解得到的多肽生物学功能,有待进一步试验。
参考文献
[1] HAYASHI O,KATOH T,OKUWAKI Y. Enhancement of antibody production in mice by dietarySpirulinaplatensis[J]. Nutr Sci Vitaminol, 1994,40(5):431-441.
[2] HIRAHASHI T,MATSUMOTO M,HAZEKI K,et al. Aetivation of the human innate immune system by Spirulina augmentation of interferon production and NK cytotoxicity by oral administration of hot water extract of spirulina platensis[J].Int Immunopharmacol, 2002,2(4):423-434.
[3] 张成武,吴洁,欧阳平凯. 钝顶螺旋藻的药用价值[J].中国海洋药物,1998(4):26-29.
[4] RUPERÉZ P,AHRAZEM O,LEAL J A.Potential antioxidant capacity of sulfated polysaccharides from the edible marine brown seaweed Fucus vesiculosus[J].Journal of Agriculture Food Chemistry,2002,50:840-845.
[5] PIFIERO ESTRADA J E,BERMEJO BESCOS P,VILLAR FRESNO A M.Antioxidant activity of different fractions of spirulina platensis protean extract [J]. Farmaco, 2001, 56(57):497-500
[6] 陈志华. 活性污泥—螺旋藻体系处理污水的研究[D].长春:东北师范大学,2010.
[7] 赵强强. 酱油制曲及螺旋藻酱油生产工艺的研究[D].青岛:中国海洋大学,2012.
[8] 刘玉环,史晓洁,巫小丹,等. 螺旋藻和菌-藻共生系统处理啤酒废水[J].环境工程学报,2014(1):82-86.
[9] 张丽君,刘冬,李世敏. 螺旋藻脱腥工艺研究[J].食品与发酵工业,2008(6):95-97.
[10] HEO S J,PARK E J,LEE K W,et al.Antioxidant activities of enzymatic extracts from brown seaweeds[J]. Bioresource Technology,2005,96:1613-1623.
[11] 中华人民共和国卫生部.食品中蛋白质的测定方法:GB/T 5009.5-2010[S].北京:中国标准出版社,2010.
[12] 郭卫芸,杜冰,袁根良,等.反复冻融法破壁啤酒废酵母的研究[J].酿酒科技,2009(3):103-105.
[13] 刘杨,王雪青,庞广昌.反胶团萃取分离螺旋藻藻蓝蛋白[J].天津科技大学学报,2008,23(2):30-33.
[14]北京市卫生防疫站.酱油卫生标准的分析方法:GB/T 5009.39-2003[S].北京:中国标准出版社,2003.
[15] 冯志彪,李冬梅.酶法改善螺旋藻蛋白质性质的研究[J].食品与器械,2001(3):19-20,22.
[16] 王镜岩.生物化学:上册[M].3版.北京:高等教育出版社,2002.
[17] 冯志彪,李冬梅. 中性蛋白酶水解螺旋藻蛋白质的研究[J].食品研究与开发,2001(2):22-24.

