融合双亲短肽提高腈水合酶的热稳定性研究
2015-12-26房月芹崔文璟刘中美周哲敏
房月芹, 崔文璟, 刘 义, 周 丽, 刘中美, 周哲敏*
(1. 江南大学 环境与土木工程学院,江苏 无锡 214122;2. 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
融合双亲短肽提高腈水合酶的热稳定性研究
房月芹1, 崔文璟2, 刘 义2, 周 丽2, 刘中美2, 周哲敏2*
(1. 江南大学 环境与土木工程学院,江苏 无锡 214122;2. 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
腈水合酶(Nitirle hydratase, NHase)催化腈类物质转化为酰胺类物质,目前用于工业生产丙烯酰胺。但在催化过程中释放的热量易导致酶分子失活。研究通过蛋白质融合技术对腈水合酶进行分子改造,提高热稳定性。将2种双亲自组装肽(self-assembling peptides, SAPs)EAK16和ELK16分别融合至恶臭假单胞菌PseudomonasputidaNRRL-18668来源NHase非催化亚基β的N末端,构建出2种融合型NHase:EAK16-NHase和ELK16-NHase。经过表达、纯化后测定酶活力,发现EAK16-NHase和ELK16-NHase的酶活力分别为(426±14) U/mg和(372±12) U/mg,保留野生型酶活力的97%和85%。在50 ℃条件下孵育0~60 min,每5 min取样后测定残存酶活力,EAK16-NHase和ELK16-NHase酶活力半衰期(T50)分别为35 min和40 min,野生型NHase为20 min。说明融合EAK16和ELK16均能提高NHase的热稳定性。研究表明融合SAPs能在不显著影响酶活力的条件下提高酶的热稳定性。
双亲短肽;融合蛋白;腈水合酶;酶催化;热稳定性
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基 恶臭假单胞菌PseudomonasputidaNRRL-18668购自NBRC,E.coliJM109、E.coliBL21 (DE3)表达载体pET24a(+)为本实验室保存;模板质粒pET24a-BAP为本实验室前期构建;TB培养基:胰蛋白胨1.2%(质量分数),酵母提取物2.4%(质量分数),甘油0.4%(质量分数), KH2PO417 mmol/L, K2HPO472 mmol/L,pH 7.0,121 ℃灭菌20 min。
1.1.2 主要试剂和仪器 DNA marker、Protein marker、质粒小量提取试剂盒、蛋白定量试剂盒等购自上海生生物工程有限公司,KOD plus neo、Ligation high LGK-100、胶回收试剂盒购自上海硕盟生物科技有限公司,CloneEZ试剂盒购自GenScript(Piscataway, NJ, USA),底物3-氰基吡啶(3-cyanopyridine)购自梯希爱(上海)化成工业发展有限公司,PCR引物合成及测序由上海生工生物工程公司完成。
1.1.3 引物、基因和蛋白质序列 基因序列:EAK16和ELK16基因由上海生工生物工程有限公司合成。序列:EAK16:CTGGAACTGGAACTGAAACTGAAACTGGAACTGGAACTGAAACTGAA-ACCGACCCCGCCGACCACCCCGACCCCGCCGAC-CACCCCGACCCCGACCCCG;ELK16:GCGGAAGC-GGAAGCGAAAGCGAAAGCGGAAGCGGAAGCGA-AAGCGAAACCGACCCCGCCGACCACCCCGACCC-CGCCGACCACCCCGACCCCGACCCCG。 蛋白质序列:EAK16:AEAEAKAKAEAEAKAKPTPPTTPTPPTTPTPTP;ELK16:LELELKLKLELELKLKPTPPTTPTPPTTPTPTP。引物序列:SAP1F:TAAGAAG-GAGATATACATATGGCGGAAGCGGAAGCG;SAP1-R:ATCGTGAATGCCATTCATATGCGGGGTCGGGG-TCGG;SAP2F:TAAGAAGGAGATATACATATGCTGGAACTGGAACTG;SAP2R:ATCGTGAATGCCATTCATATGCGGGGTCGGGGTCGG。
1.2 方法
1.2.1 质粒构建 利用CloneEZ快速构建质粒方法将2种自组装肽EAK16和ELK16分别构建到模板质粒pET24a-BAP上。首先利用SAP1F和SAP1R扩增EAK16基因,纯化PCR产物备用。提取pET24a-BAP质粒载体,用NdeI进行单酶切后,将EAK16纯化的PCR产物与酶切后的载体及CloneEZ酶混合按CloneEZ说明书方法操作,将产物转化E.coliJM109,过夜培养后挑取单菌落,37 ℃培养,测序验证,构建的含有NHase和EAK16融合基因的重组质粒命名为pET24a-SAP1-NHase。同样,利用此方法将ELK16融合到NHase的β亚基N末端,构建出的重组载体命名为pET24a-SAP2-NHase。
1.2.2 腈水合酶在大肠埃希菌中的表达和纯化 具体参考余越春等[17]的方法。将以上构建的2种重组质粒分别转化E.coliBL21(DE3),挑取单菌落分别接入含有Kan(50 g/mL)的TB液体培养基,过夜活化,次日转接,培养至OD600为1.0,添加IPTG(0.6 mmol/L)、CoCl2·6H2O(0.1 g/L)诱导表达16 h,SDS-PAGE检测重组蛋白质的表达水平。野生型NHase和融合NHase的纯化方法参考Liu等[18]报道。
1.2.3 酶活测定 酶活力采用高效液相色谱法测定 反应液体积为0.5 mL,组成为450 μL 20 mmol/L KPB缓冲液、40 μL 200 mmol/L的底物3-cyanopyridine以及10 μL的酶液。25 ℃反应10 min后,加入等量乙腈终止反应。将终止的反应液过0.22 μm滤膜,然后用C18柱进行高效液相层析(high performance liquid chromatography, HPLC)进行酶活检测,流动相为体积比2∶1的磷酸缓冲液(pH 7.4)与乙腈的混合溶液,流速1 mL/min。腈水合酶的酶活力单位:该酶在25 ℃时每分钟催化产生1 μmoL烟酰胺所需要的酶量为1 U。
1.2.4 热稳定性测定 纯化后的野生型NHase和2种融合NHase (SAP1-NHase和SAP2-NHase)溶解于10 mmol/L pH 7.5的磷酸钾缓冲液(KPB)中,使酶终浓度为0.3 mg/mL。酶蛋白分为12组,每组样品200 μL,分别置于50 ℃金属浴中孵育,每隔5 min取出1组,立刻置冰上冷却5 min。待孵育60 min组结束后。利用1.2.3中的方法测定酶活力。野生酶和融合酶以未热浴的活力定义为100%,半衰期T50定义为酶活力降低一半时所经历的热浴时间。每组样品分别进行3个平行样测定,数据以Mean±SD表示。
2 结果与分析
2.1 N-末端融合EAK16和ELK16对NHase的影响
腈水合酶催化活性中心存在于α亚基上,而β亚基不直接参与催化。因此,本研究将2种SAPs融合与NHase的β亚基N末端,构建出2种β亚基N末端分别融合EAK16和ELK16的融合NHase,为EAK16-NHase和ELK16-NHase,基因结构如图1所示。
经过在E.coliBL21(DE3)中诱导,细胞经超声波破碎,SDS-PAGE检测,结果如图2所示。重组蛋白成功实现了大量可溶表达。由于野生NHase中α亚基和β亚基理论分子量分别为25 kDa和26.1 kDa,因而在泳道2中2个亚基不容易分离出来,呈现单一条带。而β亚基融合了EAK16和ELK16后,理论分子量分别增加了3.6 kDa和3.3 kDa,因而α亚基和β亚基通过SDS-PAGE得以分离。图2中的电泳条带位置和理论值相符,表明野生型和融合型NHase成功表达。
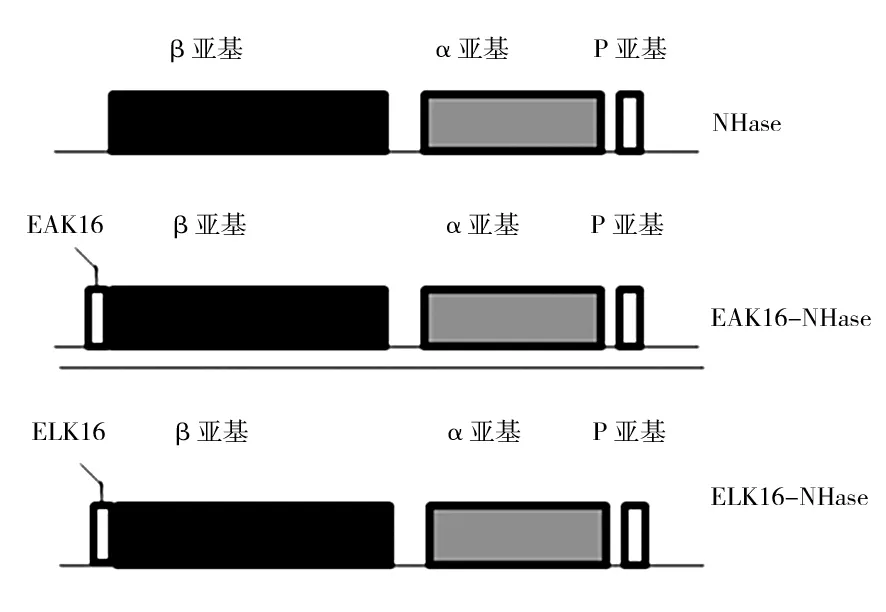
图1 野生NHase和融合NHase的基因结构Fig.1 Gene structure of the wild-type NHase and fused NHase
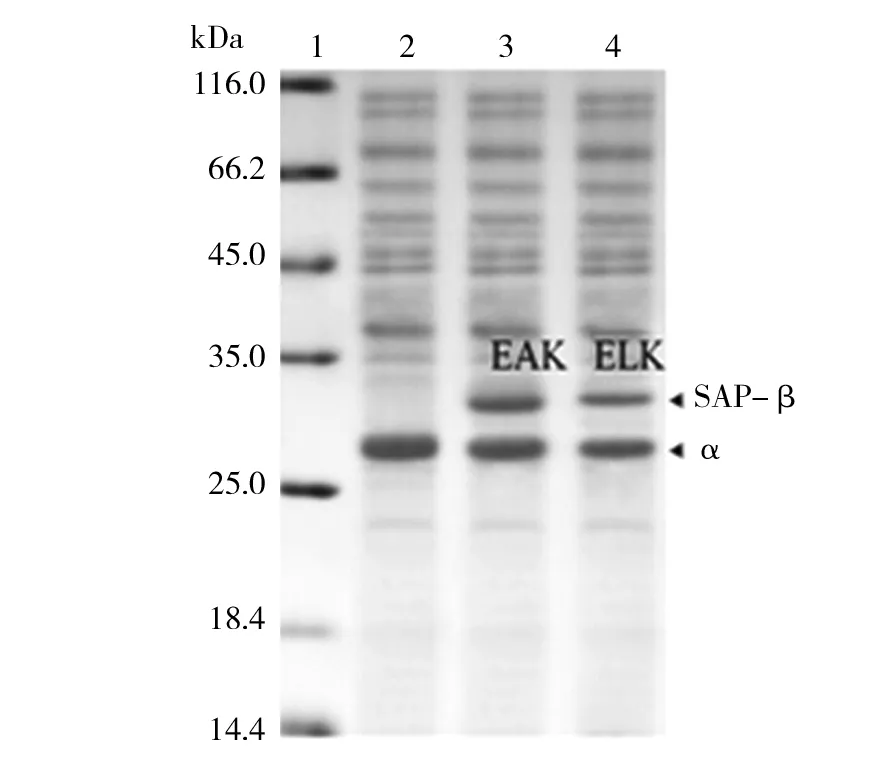
图2 NHase野生酶和融合酶在E.coli中重组表达Fig.2 Heterogenous expression of wild-type and fused NHase in E.coli1:蛋白质Marker;2:野生NHase的重组表达;3:融合EAK16的NHase重组表达;4:融合ELK16的NHase重组表达1: Protein Marker; 2:wild-type NHase;3:EAK16-NHase; 4:ELK16-NHase
2.2 野生型和融合型NHase的纯化及酶活性鉴定
含有重组质粒的E.coli细胞经过离心收集菌体,超声波破碎细胞后,将上清液通过硫酸铵分级沉淀(40%~75%)粗分离,透析后再利用Hitrap Q HP 1mL阴离子柱和Superdex 75 10/300GL凝胶层析柱进行进一步分离纯化,经过SDS-PAGE检测,得到纯度较高的酶,结果如图3所示。

图3 野生型NHase和融合型NHase的分离纯化Fig.3 Separation and purification of wild-type and fused NHase1:蛋白质marker;2:纯化后的野生型NHase;3:纯化后的EAK16-NHase;4:纯化后的ELK16-NHase1:protein marker; 2:purified wild-type NHase; 3:purified EAK16-NHase; 4:purified ELK16-NHase
以3-cyanopyridine为底物,分别测定野生NHase、融合EAK16-NHase和ELK16-NHase的酶活力。结果显示,野生酶比酶活为(439±11) U/mg,EAK16-NHase比酶活为(426±14) U/mg,ELK16-NHase比酶活为(372±12) U/mg。融合了EAK16的NHase比酶活与野生型酶相比,没有明显降低,而融合了ELK16的NHase少有降低,但也保留了原始酶活的84.7%。表明融合后的NHase酶活均没有大幅度降低。
2.3 融合EAK16和ELK16对NHase酶热稳定性的影响
为了探讨NHase分别融合EAK16和ELK16后热稳定的变化,实验以3-cyanopyridine为底物,定义没有经过50 ℃热处理的3种酶本身的比活力为100%,在50 ℃下分别孵育NHase、EAK16-NHase和ELK16-NHase至60 min,每隔5 min检测残存酶活力,与各自不经热处理的比活力相比,计算残存酶的百分比,结果如图4所示。野生型NHase在经过热处理20 min后,残存酶活力即低于50%,融合了EAK16或ELK16的NHase酶活半衰期T50延长至30 min和35 min。热处理40 min后,野生型NHase残存活力为零,完全失活。而融合了ELK16和EAK16的NHase在同样处理40min后,残存酶活力分别为33%和28%。结果表明,融合EAK16或ELK16均可提高NHase在50 ℃下的热稳定性,且融合ELK16对抗热变性的作用稍强。
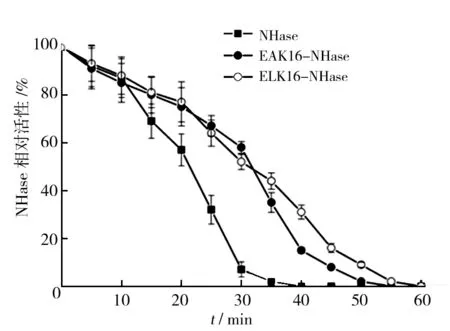
图4 融合EAK16和ELK16对NHase热稳定性的影响Fig.4 Effect on thermo-stability of NHase after fusing EAK16 and ELK16, respectively
3 讨 论
随着腈水合酶在转化生产丙烯酰胺中的广泛应用,研究人员对其酶学性质如酶活性、Km、Kcat、抑制剂以及底物特异性进行长期系统的探讨,多种细菌来源的腈水合酶及其酶学性质被准确表征。研究发现,绝大多数细菌来源的腈水合酶最适的催化温度都在20~37 ℃,其中包括了工业中已经广泛应用的丙烯酰胺第3代生产用菌——玫瑰红球菌RhodococcusrhodochrousJ1,其最适催化温度也为35 ℃[19]。然而,在转化丙烯腈生产丙烯酰胺的过程中,反应大量放热,使体系温度迅速上升,即使采取不断导热或散热的工艺,也不可避免地使体系温度有较大波动。这种情况对提高丙烯酰胺生产的稳定性尤为不利。虽然之前的研究也鉴定出睾丸酮丛毛单胞菌Comamonastestosterone来源的NHase热稳定性较强,但其催化的活性远低于R.rhodochrousJ1以及Pseudomonasputida来源的NHase。由于目前对嗜热酶的耐热机理已有比较系统的研究,已知酶蛋白的一级结构中氨基酸的序列与耐热之间有直接联系,并且其他因素如氢键、离子键等也能影响热稳定性[20]。这些理论对利用蛋白质工程手段提高腈水合酶的热稳定性起到重要作用。
本研究利用融合自组装小肽的策略实现了提高P.putida来源NHase的热稳定性。这一类型的小肽最早由麻省理工学院的Zhang等[21]发现,并证明这些离子化的自互补肽通过正负电荷交替排列的方式形成稳定的β折叠结构,从而使其在水溶液中经历自组装后形成有序的纳米结构[20]。目前这种人工肽已广泛应用于纳米技术的许多领域,如生物医学纳米技术、细胞培养、分子电子学等[22]。迄今,具有这种性质的多种自组装肽已应用于生物医学、药学领域,如RAD16-I、RAD16-II、EAK16和ELK16[23-26]。其中EAK16和ELK16用于融合一些蛋白质或酶分子后能引起蛋白质之间的集聚,形成活性聚集体(active aggregates),能实现蛋白质抵抗不利因素的影响,在一定程度上提升酶的稳定性。本研究中选用2种自组装肽与腈水合酶β亚基的N末端融合,结果发现融合后的2种新型NHase热稳定性均有提高,且融合ELK16的NHase 50 ℃处理后的半衰期从未融合的约20 min提高到了35 min,并且热处理后期酶活丧失的速率相比于野生型酶也较低(图3、图4)。值得注意的是,之前报道融合了ELK16的蛋白质在大肠埃希菌细胞内表达时能形成相互聚集的活性包涵体 (active inclusion body)[26],提高细胞生产蛋白质的效率。而本研究融合ELK16后发现绝大多数蛋白都存在于细胞破碎液的上清中,并不形成大量活性包涵体,这可能由于腈水合酶是个四聚体蛋白质,1个酶分子中有2个同源的β亚基,这2个β亚基之间的电荷发生了相互抵消,从而使酶分子之间正负电荷的相互作用减弱,从而没有形成分子间集聚所得到的活性包涵体。但这对于最大程度保存酶活性有积极意义。本研究中所得到的2种融合型腈水合酶分别保留了野生酶活力的97%和85%。相对于通过定向进化、理性设计和定点突变等蛋白质工程手段,此方法具有靶向性强、构建过程简单、通用性好等优点。
本研究通过将自组装肽融合到腈水合酶非催化亚基的N末端,使得融合酶的热稳定性有一定程度地提高。这种方法对于进一步改造多种酶分子的热稳定性或抗蛋白酶降解性有着借鉴意义。
[1] Prasad S, Bhalla TC. Nitrile hydratases (NHases): at the interface of academia and industry[J]. Biotechnol Adv, 2010, 28(6): 725-741.
[2] Wang YJ, Zheng YG, Xue JP, et al. Characterization of nitrile hydratation catalysed byNocardiasp. 108[J]. World J Microb Biot, 2007, 23(3): 355-362.
[3] Okamoto S,Eltis LD. Purification and characterization of a novel nitrile hydratase fromRhodococcussp. RHA1[J]. Mol Microbiol, 2007, 65(3): 828-838.
[4] Alfani F, Cantarella M, Spera A, et al. Operational stability ofBrevibacteriumimperialisCBS 489-74 nitrile hydratase[J].J Mol Catal B-Enzym, 2001, 11(4-6): 687-697.
[5] Miyanaga A, Fushinobu S, Ito K, et al. Crystal structure of cobalt-containing nitrile hydratase[J]. Biochem Biophys Res Commun, 2001, 288(5): 1169-1174.
[6] Petrillo KL, Wu S, Hann EC, et al. Over-expression inEscherichiacoliof a thermally stable and regio-selective nitrile hydratase fromComamonastestosteroni5-MGAM-4D[J]. Appl Microbiol Biotechnol, 2005, 67(5): 664-670.
[7] Foerstner KU, Doerks T, Muller J, et al. A nitrile hydratase in the eukaryoteMonosigabrevicollis[J]. PLoS One, 2008, 3 (12): e3976.
[8] Nagashima S, Nakasako M, Dohmae N, et al. Novel non-heme iron center of nitrile hydratase with a claw setting of oxygen atoms[J]. Nat Struct Biol, 1998, 5(5): 347-351.
[9] Kobayashi M, Shimizu S. Cobalt proteins[J]. Eur J Biochem, 1999, 261(1): 1-9.
[10]Cui Y, Cui W, Liu Z, et al. Improvement of stability of nitrile hydratase via protein fragment swapping[J]. Biochem Biophys Res Commun, 2014, 450(1): 401-408.
[11]Zhou Z, Hashimoto Y, Kobayashi M. Self-subunit swapping chaperone needed for the maturation of multimeric metalloenzyme nitrile hydratase by a subunit exchange mechanism also carries out the oxidation of the metal ligand cysteine residues and insertion of cobalt[J]. J Biol Chem, 2009, 284 (22): 14930-14938.
[12]Fung SY, Yang H, Bhola PT, et al. Self-Assembling Peptide as a Potential Carrier for Hydrophobic Anticancer Drug Ellipticine: Complexation, Release and In Vitro Delivery[J]. Adv Funct Mater, 2009, 19(1): 74-83.
[13]Ge J, Lu DN, Yang C, et al. A Lipase-Responsive Vehicle Using Amphipathic Polymer Synthesized with the Lipase as Catalyst[J]. Macromol Rapid Comm, 2011, 32(6): 546-550.
[14]Schoch GA, Attias R, Belghazi M, et al. Engineering of a water-soluble plant cytochrome P450, CYP73A1, and NMR-based orientation of natural and alternate substrates in the active site[J]. Plant Physiol, 2003, 133(3): 1198-1208.
[15]Lu X, Liu S, Zhang D, et al. Enhanced thermal stability and specific activity ofPseudomonasaeruginosalipoxygenase by fusing with self-assembling amphipathic peptides[J]. Appl Microbiol Biotechnol, 2013, 97(21): 9419-9427.
[16]Wang Q, Yang Z, Gao Y, et al. Enzymatic hydrogelation to immobilize an enzyme for high activity and stability[J]. Soft Matter, 2008, 4(3): 550-553.
[17]余越春, 崔文璟, 刘义, 等.RhodococcusrhodochrousJ1腈水合酶在大肠杆菌中的表达策略[J]. 工业微生物, 2014, 44 (2): 14-19.
[18]Liu Y, Cui W, Xia Y, et al. Self-subunit swapping occurs in another gene type of cobalt nitrile hydratase[J]. PLoS One, 2012, 7(11): e50829.
[19]Nagasawa T, Takeuchi K,Yamada H. Characterization of a New Cobalt-Containing Nitrile Hydratase Purified from Urea-Induced Cells ofRhodococcus-RhodochrousJ1[J]. Eur J Biochem, 1991, 196(3): 581-589.
[20]沈嘉澍, 沈标. 嗜热酶的耐热机理[J]. 微生物学杂志, 2010, 30(2): 80-85.
[21]Zhang S. Fabrication of novel biomaterials through molecular self-assembly[J]. Nat Biotechnol, 2003, 21(10): 1171-1178.
[22]Zhao XB, Pan F,Lu JR. Recent development of peptide self-assembly[J]. Prog Nat Sci-Mater, 2008, 18(6): 653-660.
[23]Davis ME, Hsieh PC, Takahashi T, et al. Local myocardial insulin-like growth factor 1 (IGF-1) delivery with biotinylated peptide nanofibers improves cell therapy for myocardial infarction[J]. Proc Natl Acad Sci U S A, 2006, 103(21): 8155-8160.
[24]Bokhari MA, Akay G, Zhang S, et al. The enhancement of osteoblast growth and differentiation in vitro on a peptide hydrogel-polyHIPE polymer hybrid material[J]. Biomaterials, 2005, 26(25): 5198-5208.
[25]Fung SY, Yang H,Chen P. Formation of colloidal suspension of hydrophobic compounds with an amphiphilic self-assembling peptide[J]. Colloid Surface B, 2007, 55(2): 200-211.
[26]Wu W, Xing L, Zhou BH, et al. Active protein aggregates induced by terminally attached self-assembling peptide ELK16 inEscherichiacoli[J]. Microb Cell Fact, 2011, 10(1):9.
Enhancement of Nitrile Hydratase by Translational Fusion of Amphiphilic Short Peptide
FANG Yue-qin1, CUI Wen-jing2, LIU Yi2, ZHOU Li2, LIU Zhong-mei2, ZHOU Zhe-min2
(1.Schl.ofEnvir't&CivilEngin., 2.Schl.ofBiotech.,KeyLab.ofIndust.Biotech.,JiangnanUni.,Wuxi214122)
Nitrile hydratase (NHase) catalyzes nitriles to the amides, it is at present widely used in industrial production of acrylamide. However, the heat released during the catalysis process easily inactivated the enzyme molecule involved. In this study, protein engineering by translational fusion was employed to enhance the thermo-stability of the enzyme. Herein, two types of self-assembling peptides (SAPs) EAK16 and ELK16 was translationally fused to the non-catalytic subunit β of NHase fromPseudomonasputidaNRRL-18668, yielding two chimeric fusions NHase EAK16-NHase and ELK16-NHase. Next, the two types of recombinant proteins were expressed inE.coliand purified before the enzyme activity were determined. It was found that the specific activity for EAK16-NHase and ELK16-NHase was (426±14) U/mg and (372±12) U/mg respectively, reserved 97% and 85% of that in wild-type NHase. Furthermore, after incubation of the wild-type NHase and chimeric NHase at 50 ℃ for a period of 0 min to 60 min and sampled at the interval of 5 min, the residual activity was determined. The data showed that the half-life of the enzymatic activity (T50) for EAK16-NHase and ELK16-NHase was 35 min and 40 min, respectively, while the wild-type enzyme was 20 min, indicating that translational fusion of SAPs was able to augment the thermo-stability of NHase. These results manifested that the thermo-stability was actually able to enhance that was not bound to at the cost of losing activity.
amphiphilic short peptide; fused protein; Nitrile hydrase; enzyme catalysis; thermo-stability
国家863计划项目(2014AA021304);国家自然科学基金项目(31400058);江苏省自然科学基金(青年基金)项目(BK20130139)
房月芹 女,讲师,硕士。研究方向为工业生物技术。Tel:0510-85197551,E-mail:fangyq_1@163.com
* 通讯作者。男,博士,教授,博士生导师。研究方向为微生物分子酶技术。Tel:0510-85325210,E-mail:zhmzhou@jiangnan.edu.cn
2015-01-28;
2015-03-07
Q936
A
1005-7021(2015)05-0013-06
10.3969/j.issn.1005-7021.2015.05.003