平贝母醇提物对小鼠免疫功能的影响
2015-12-26于晓龙杨建玲朱乐朴美善郭建鹏
于晓龙, 杨建玲, 朱乐, 朴美善, 郭建鹏,2*
( 1.延边大学药学院, 吉林 延吉 133002; 2.长白山生物资源与功能分子教育部重点实验室(延边大学), 吉林 延吉 133002 )
平贝母醇提物对小鼠免疫功能的影响
于晓龙1, 杨建玲1, 朱乐1, 朴美善1, 郭建鹏1,2*
( 1.延边大学药学院, 吉林 延吉 133002; 2.长白山生物资源与功能分子教育部重点实验室(延边大学), 吉林 延吉 133002 )
应用流式细胞术测定平贝母醇提物对小鼠免疫功能的影响.结果显示,平贝母醇提物对小鼠外周血T淋巴细胞CD69+/CD3+比值、腹腔巨噬细胞吞噬荧光微球吞噬百分率具有显著性影响(P<0.05),对脾脏NK细胞CD69+/NKG2D+比值具有极显著性影响(P<0.01).这表明平贝母醇提物具有增强小鼠免疫功能的作用.
平贝母; 免疫功能; 流式细胞术
平贝母(FritillariaussuriensisMaxim)为百合科贝母属多年生草本植物,主产于我国东北地区的长白山脉和小兴安岭南部山区,其味苦、甘、微寒,临床用于肺热燥咳、干咳少痰、阴虚劳嗽、咳痰带血等[1].研究表明,平贝母中含有生物碱类、生物碱苷类及核苷类成分,其提取物具有镇咳、祛痰、平喘、抗溃疡、抗炎等作用[2-4].免疫功能是机体自身的防御机制,是识别和消灭外来侵入的异物,处理衰老、损伤、死亡、变性的自身细胞以及识别和处理体内突变细胞和病毒感染细胞的能力,免疫功能的强弱与遗传和环境因素有关.本研究采用流式细胞术,以细胞免疫功能、单核/巨噬细胞功能、NK细胞活性测定结果为评价指标[5-6],初步考察平贝母醇提物对小鼠免疫功能的影响,为平贝母的进一步开发利用提供依据.
1 实验材料
1.1 实验动物
无特定病原体(specific pathogen free, SPF)昆明种雄性小鼠90只(体重18~22 g),豚鼠5只(体重250~300 g),均由延边大学实验动物中心提供(实验动物生产许可证号SCXK(吉)2011-0007).饲料由延边大学实验动物中心提供.实验室为SPF级动物实验室,室温为(20±2) ℃,湿度为50%~60%.
1.2 实验药材
平贝母采收于吉林省敦化市平贝母栽培基地,并经延边大学药学院吕惠子副教授鉴定.
1.3 实验仪器
实验仪器有流式细胞仪(美国Becton Dickinson公司),数码倒置显微镜(XDS-100D),冷冻干燥机(VIRTIS-BT2K).
1.4 实验试剂
小鼠CD69异硫氰酸荧光素(FITC)标记(Cat:1715-02)、CD3藻红色素(PE)标记(Cat:553067)、NKG2D藻红色素(PE)标记(Cat:E008303)单克隆抗体、溶血素均为美国BD PharMingen公司产品;荧光微球(F-20880)为美国Moleculer Probes公司产品;Hank’s液(H1020)为Solarbio公司产品;牛血清白蛋白(bovine serumalbumin,BSA)为美国Ameresco公司产品;胎牛血清(fetal bovine serum, FBS)为美国Gibco公司产品;绵羊血红细胞液(SRBC)与磷酸盐缓冲液(PBS)为本实验室自行制备,其他试剂均为分析纯.
2 实验方法
2.1 平贝母醇提物的制备
将平贝母除去杂质后粉碎,得粗颗粒;加10倍量80%(体积比)乙醇超声(240 W,40 kHz)提取2次,每次30 min,过滤,合并滤液;滤液浓缩,冷冻干燥,得平贝母醇提物粉末,备用.
2.2 给药方式[6]
给药方式采取灌胃法,平贝母醇提物混悬于水中,每日灌喂1次,空白对照组以等量生理盐水灌胃.给药期间动物自由摄水、摄食,各受试组小鼠连续灌胃30 d后,测定各项指标.
2.3 平贝母醇提物对小鼠外周血及脾脏T淋巴细胞表面活化抗原的影响
小鼠连续灌胃30 d后,脱颈椎处死,参照文献[7]方法测定.小鼠无菌取脾,制成浓度为5×105的单细胞悬液,然后与1 μL小鼠CD69异硫氰酸荧光素(FITC)标记单克隆抗体和5 μL小鼠CD3藻红色素(PE)标记单克隆抗体混合,室温下避光孵育30 min;用0.5 mL溶血素准确裂解红细胞10 min,在1 300 r/min条件下离心5 min获取有核细胞,用PBS洗涤2次后上流式细胞仪分析.
2.4 平贝母醇提物对小鼠腹腔巨噬细胞吞噬功能的影响
小鼠连续灌胃30 d后,脱颈椎处死,参照文献[8-10]方法测定.荧光微球预调理:用PBS配制体积浓度为1% 的BSA溶液,按1∶100稀释微球储存液,37 ℃孵育30 min后,超声处理5 min.小鼠腹腔巨噬细胞分离:实验4 d前腹腔注射0.2 mL 2%(体积比) SRBC激活巨噬细胞,实验当天将小鼠颈椎脱臼处死,暴露腹膜,经腹腔注射7 mL Hank’s液(含5% FBS);将小鼠腹部向上置于摇床上摇晃3 min,剪开腹部,吸取腹腔洗液于15 mL离心管中,冰浴.细胞计数:取6×105个细胞至1.5 mL试管中,每个试管加入220 μL预调理过的荧光微球悬液.吞噬作用:室温避光孵育30 min后,以2 mL PBS轻柔洗涤2次(洗除多余未消化的荧光微球),然后用细胞刮刮下尚未脱壁的巨噬细胞,收集细胞悬液,75 μm过滤器过滤,根据细胞密度用0.2 mL PBS定容后上流式细胞仪分析.
2.5 平贝母醇提物对小鼠外周血及脾脏NK细胞表面活化抗原的影响
小鼠连续灌胃30 d后,参照文献[7]方法测定.采小鼠眼球血,肝素抗凝;取50 μL全血与1 μL小鼠CD69异硫氰酸荧光素(FITC)标记单克隆抗体和5 μL小鼠NKG2D藻红色素(PE)标记单克隆抗体混合,室温下避光孵育30 min;用0.5 mL溶血素准确裂解红细胞10 min,在1 300 r/min条件下离心5 min获取有核细胞,用PBS液洗涤2次后上流式细胞仪分析.
2.6 流式细胞仪分析
标记的细胞经前向散射(FSC)和纵向散射(SSC)在二维Dot-Plot图中划出巨噬细胞区,然后对巨噬细胞作FITC荧光强度检测,485 nm处作为激发波长,530 nm处作为发射波长,数据显示于FL1-FSC二维散点图和FL1直方图中.每组分析10例动物样本,每例样本获取10 000个巨噬细胞,用Cell-Quest软件分析吞噬不同荧光微球的巨噬细胞的比例.
2.7 统计分析结果
所有数据均采用SSPS 19.0统计软件进行方差分析.首先进行方差齐性检验,方差齐,计算F值.F≥F0.05, P≤0.05表明各组间呈显著性差异.
3 结果
3.1 平贝母醇提物对小鼠外周血及脾脏T淋巴细胞表面活化抗原的影响
结果如图1、表1所示:与对照组相比,高剂量组小鼠外周血T淋巴细胞CD69+/CD3+比值明显增高,差异具有统计学意义(P<0.05);中、高剂量组小鼠脾脏T细胞CD69+/CD3+比值略有增高,但差异无统计学意义(P>0.05).
3.2 平贝母醇提物对小鼠腹腔巨噬细胞吞噬荧光微球的影响
结果如图2、图3和表2所示:与对照组相比,中剂量组小鼠腹腔巨噬细胞吞噬荧光微球吞噬百分率明显增高,差异具有统计学意义(P<0.05);高剂量组小鼠腹腔巨噬细胞吞噬荧光微球吞噬百分率略有增高,但差异无统计学意义(P>0.05).
3.3 平贝母醇提物对小鼠外周血及脾脏NK细胞表面活化抗原的影响
结果如图4、表3所示:与对照组相比,中剂量组小鼠脾脏NK细胞CD69+/NKG2D+比值明显增高,差异具有统计学意义(P<0.01);中、高剂量组小鼠外周血NK细胞CD69+/NKG2D+比值略有增高,但差异无统计学意义(P>0.05).
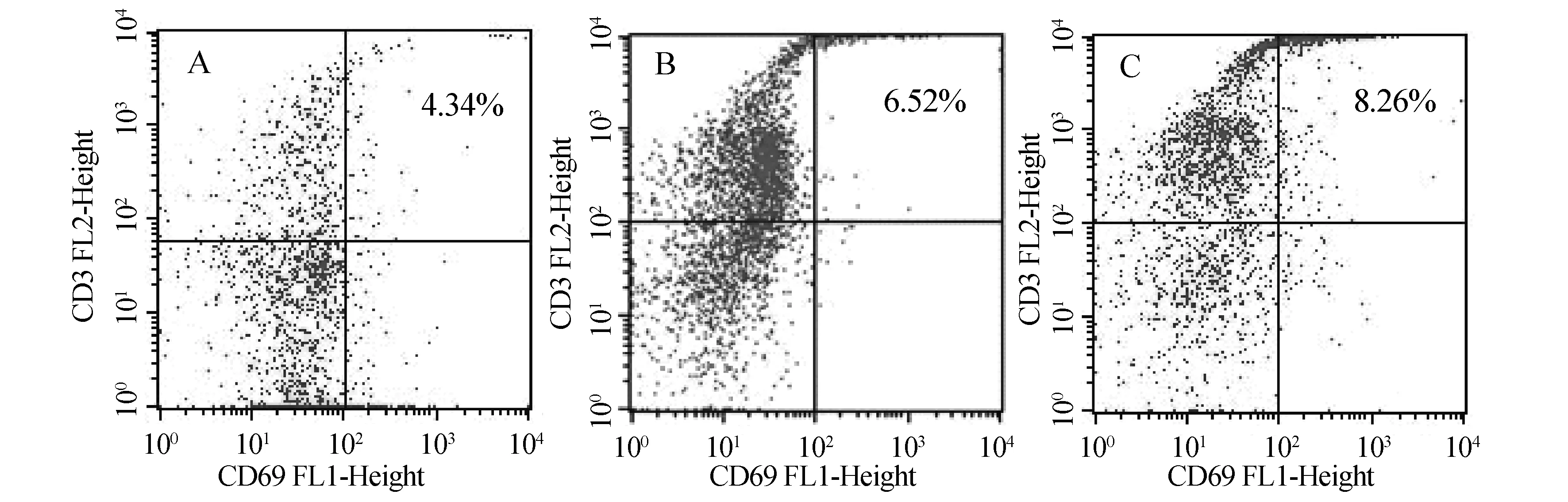
A: 空白对照组 B: 中剂量组 C: 高剂量组 (右上限为CD69+/CD3+比值)图1 平贝母醇提物对小鼠外周血T淋巴细胞CD69+/CD3+比值的影响

组别剂量/(g·kg-1)外周血T淋巴细胞(CD69+/CD3+)/%脾脏T淋巴细胞(CD69+/CD3+)/%对照组0.03.89±2.491.92±1.95中剂量组0.145.45±1.844.60±4.79高剂量组0.428.39±5.48∗4.25±4.06
注:*表示与对照组比较具有显著性差异(P<0.05).

R1:总巨噬细胞群 R2:未吞噬荧光微球的巨噬细胞群 R9:吞噬1个荧光微球的巨噬细胞群 R10:吞噬2个荧光微球的巨噬细胞群 R11:吞噬3个荧光微球的巨噬细胞群图2 吞噬荧光微球后的小鼠腹腔巨噬细胞FSC-SSC和FL1-SSC二维散点图
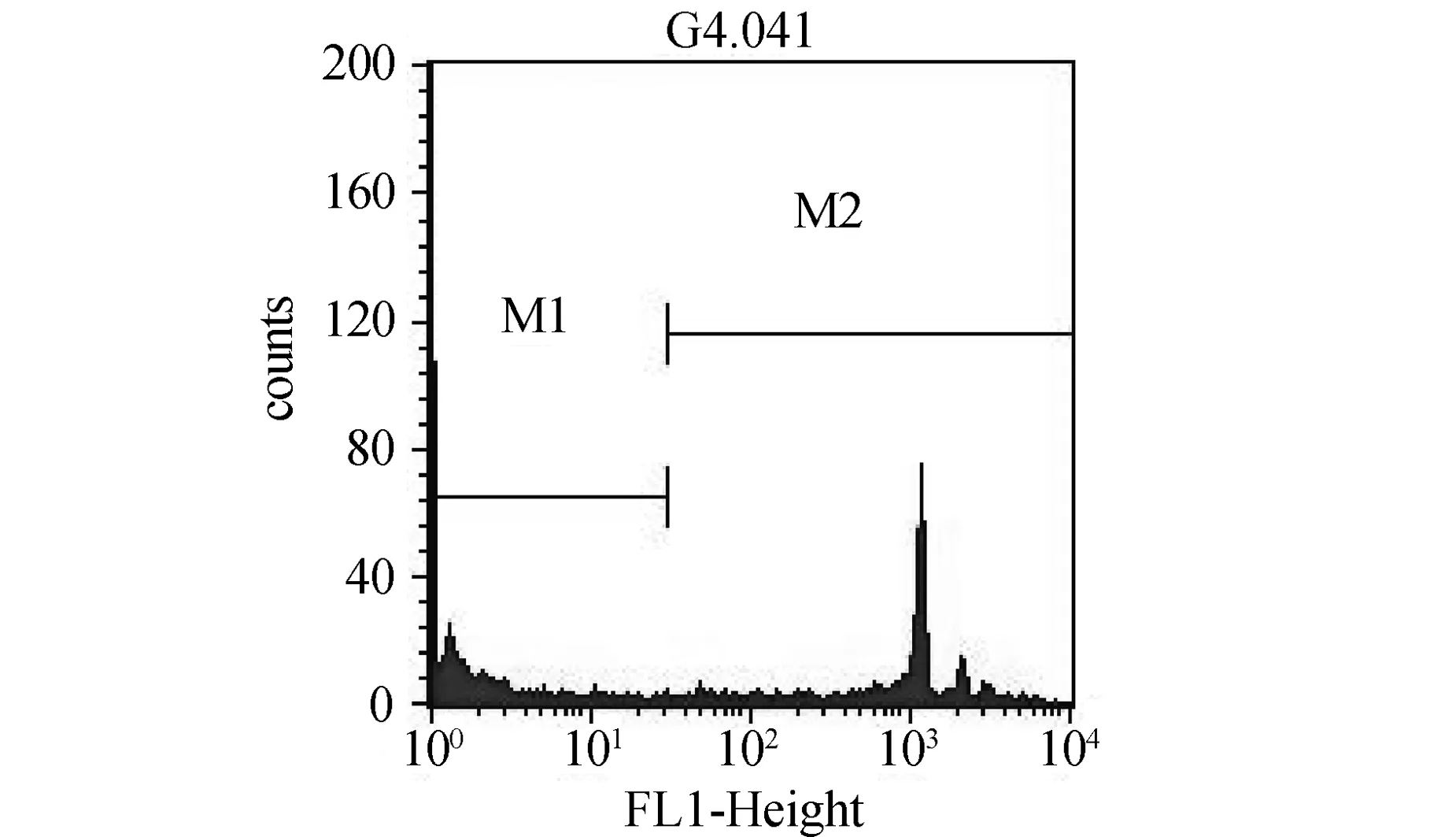
图3 吞噬荧光微球后的小鼠腹腔巨噬细胞FL1直方图
表2 平贝母醇提物对小鼠腹腔巨噬细胞吞噬 荧光微球的影响

组别剂量/(g·kg-1)吞噬指数/%P值对照组0.09.29±2.94—中剂量组0.1413.55±1.47∗0.047高剂量组0.4214.94±2.930.132
注:*表示与对照组比较具有显著性差异(P<0.05).
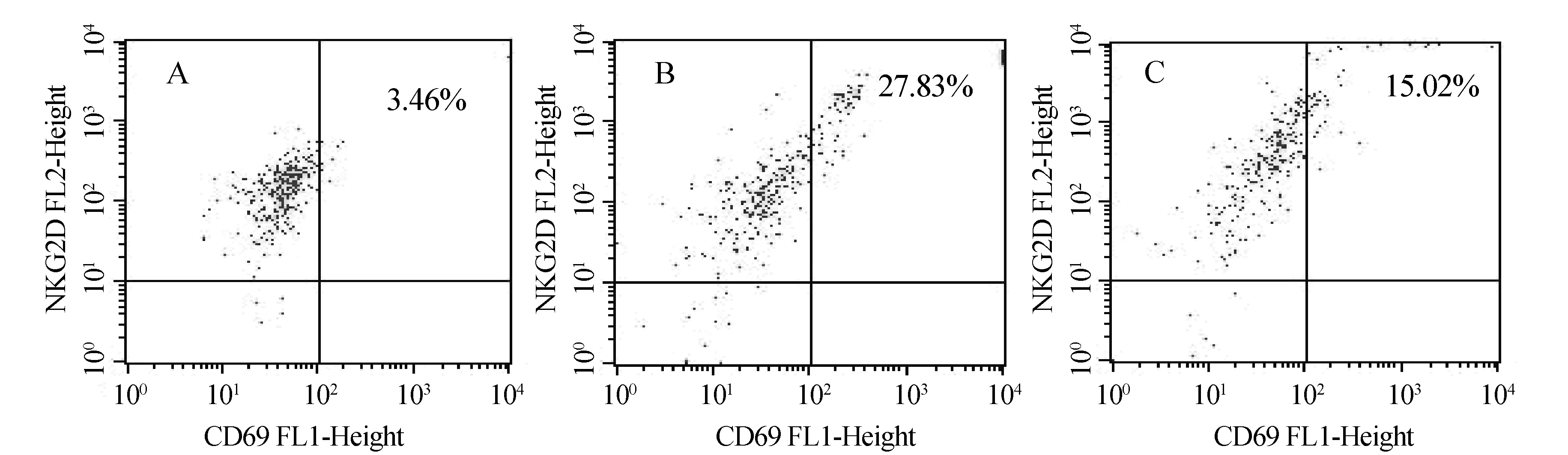
A: 空白对照组 B: 中剂量组 C: 高剂量组 (右上限为CD69+/NKG2D+比值)图4 平贝母醇提物对小鼠脾脏NK细胞CD69+/NKG2D+比值的影响

组别剂量/(g·kg-1)外周血NK细胞(CD69+/NKG2D+)/%脾脏NK细胞(CD69+/NKG2D+)/%对照组0.03.70±2.743.40±2.31中剂量组0.145.54±3.4334.55±28.27∗∗高剂量组0.425.39±4.644.77±6.08
注:**表示与对照组比较具有极显著性差异(P<0.01).
4 结论
实验结果显示,平贝母醇提物能显著提高小鼠外周血T淋巴细胞CD69+/CD3+比值(P<0.05)和小鼠脾脏NK细胞CD69+/NKG2D+比值(P<0.01),表明其具有促进免疫细胞活化的作用.另外,平贝母醇提物还能增加小鼠腹腔巨噬细胞吞噬荧光微球吞噬百分率(P<0.05),表明其具有提高单核/巨噬细胞吞噬能力的作用,有利于增强机体非特异性免疫功能.以上结果表明平贝母醇提物有助于增强小鼠的免疫功能,具备进一步开发为保健食品的潜力.
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:65.
[2] 李兴斌,高燕飞,李吉良.平贝母化学成分及药理活性研究进展[J].中医药信息,2004,21(4):28-29.
[3] 王艳红,鲍建材,张崇禧,等.中药平贝母的研究进展[J].人参研究,2004(3):13-17.
[4] 黄丽晶,高文远,李霞,等.平贝母水提物抗炎作用研究[J].天津中医药,2009,26(6):495-496.
[5] 杨杏芬,黄琼,黄俊明,等.流式细胞术在保健食品功能评价中的应用[J].中华预防医学杂志,2005,39(5):335-341.
[6] 中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:中国标准出版社,2003:697.
[7] Marzio R, Mauel J, Betz-Corradin S. CD69+and regulation of the immune function[J]. Immunopharmacol Immunotoxicol, 1999,21(3):565-582.
[8] 李煜,齐丽娟,迈一冰,等.比较流式细胞术和鸡红细胞法检测小鼠腹腔巨噬细胞吞噬功能[J].毒理学杂志,2012,26(2):133-135.
[9] 黄琼,李志,杨杏芬,等.应用流式细胞术研究大蒜粉对小鼠巨噬细胞吞噬功能的影响[J].华南预防医学,2006,32(3):19-22.
[10] Mitsuyuki Ichinose, Nobumasa Hara, Masashi Sawada, et al. A flow cytometric assay reveals an enhancement of phagocytosis by platelet activating factor in murine peritoneal macrophages[J]. Cellular Immunology, 1994,156(2):508-518.
The effect of the ethanol extract of Fritillaria ussuriensis Maxim on mice immune function
YU Xiaolong1, YANG Jianling1, ZHU Le1, PIAO Meishan1, GUO Jianpeng1,2*
( 1.CollegeofPharmacy,YanbianUniversity,Yanji133002,China; 2.KeyLaboratoryofNaturalResourcesofChangbaiMountain&FunctionalMolecules(YanbianUniversity),MinistryofEducation,Yanji133002,China)
We measure the effect ofFritillariaussuriensisMaxim ethanol extract on mice immune function based on the flow cytometry. The experimental results show that the ethanol extract ofFritillariaussuriensisMaxim have a significant effect on the ratio of T lymphocytes CD69+/CD3+in mice peripheral blood and phagocytic index for fluospheres in mice peritoneal macrophages (P<0.05), and have a very significant effect on the ratio of NK cell CD69+/NKG2D+in mice spleen (P<0.01). TheFritillariaussuriensisMaxim ethanol extract can enhance the immune function of mice.
FritillariaussuriensisMaxim; immune function; flow cytometry
2015-01-26 *通信作者: 郭建鹏(1971—),男,教授,研究方向为中药新剂型与新技术研究.
吉林省科技发展计划项目(20140204034YY);吉林省医药产业发展专项资金资助项目(YYZX201269)
1004-4353(2015)01-0085-04
R285
A
