人成纤维细胞生长因子8a在大肠杆菌中的表达研究
2015-12-23徐轶彦
徐轶彦
(福建卫生职业技术学院,福建 福州350025)
成纤维生长因子(Fibroblast growth factors FGFs)家族是一群具多种生理功能的生长因子,通过细胞表面的酪氨酸激酶受体将胞外信号传到胞内,其功能涉及胚胎发育、血管生成和伤口愈合等,对组织和细胞的增殖和分化起重要作用[1-2]。FGFs在哺乳动物中至少有22个成员,从FGF1~23,在人类中没有FGF15。FGF8是其中的一个成员,最初从雄激素依赖的小鼠乳腺癌细胞系SC-3克隆出来[3]。通过可变剪接,FGF8基因可转录加工成多种亚型。在小鼠中可产生FGF8a~h8种亚型,在人类中产生四种亚型:FGF8a、FGF8b、FGF8e和FGF8f[3-5]。本文利用大肠杆菌系统表达人FGF8a,并对表达的人FGF8a进行纯化、复性及体外活性检测。本研究将为进一步了解FGF8a的功能奠定一定的基础。
1 材料与方法
1.1 材料
含FGF8a cDNA序列的质粒pBluescript-FGF8a为本实验室保存;大肠杆菌Top 10′被用于分子克隆;大肠杆菌BL21(DE3)pLysS用于蛋白表达;T4DNA连接酶和限制性内切酶均购于TaKaRa公司;Ni Sepharose 6 Fast Flow和Sephacryl S-200 HR购于美国通用公司;抗6×His一抗和碱性磷酸酶标记的二抗购于中杉金桥(北京)生物技术;其它试剂为国产分析纯。
1.2 方法
1.2.1 pET14b-FGF8a重组表达质粒的构建
以克隆有FGF8a cDNA序列的质粒pBluescript-FGF8a为模板,设计引物(上游引物:5′-GCCATATGGGCAGCCCCCGCTC-3′;下游引物:5′-CCGCTCGAGTTATCGGGGCTCGG-3′),扩增FGF8a阅读框序列。扩增的序列连接到载体pET14b的NheI/XhoI位点上,与6×His标签在同一阅读框。连接后的重组质粒转化TOP10′感受态细胞,涂布到含有氨苄青霉素的LB平板上筛选。鉴定后的阳性转化子进行测序确定表达序列和阅读框的正确性。
1.2.2 重组人FGF8a在大肠杆菌中诱导表达
转化了pET14b-FGF8a重组表达质粒的大肠杆菌BL21(DE3)pLysS在LB培养基中培养过夜,过夜培养的细菌以1‰的接菌量接到新鲜的LB培养基中,培养至OD=0.3~0.6时,加入终浓度约1mmol/L的IPTG进行诱导表达4h。10000rpm 4℃离心10min,收集菌体,-20℃储存备用。
1.2.3 重组人FGF8a色谱纯化和复性
经IPTG诱导后的菌体进行超声破碎,7000rpm离心10min,收集包涵体。包涵体用20mmol/LTris-HCl,2mol/L尿素,2%TritonX-100洗涤30min,15000rpm离心10min,收集沉淀。洗涤后包涵体在室温下用20mmol/LTris-HCl,8mol/L尿素,0.1mol/L NaCl,pH8.0缓冲液进行溶解2h,15000rpm离心30min,取上清。Ni Sepharose 6 Fast Flow柱用上样缓冲液(20mmol/L Tris-HCl,8mol/L尿素,0.1mol/L NaCl,pH8.0)平衡。变性溶解后的上清以1ml/min的流速过Ni亲和柱,随后Ni柱用淋洗缓冲液(20mmol/LTris-HCl,8mol/L尿素,0.1mol/LNaCl,0.05mol/L咪唑,pH8.0)清洗非特异性吸附的杂蛋白。
采用在位复性的方式对变性后的重组人FGF8a进行复性。具体做法如下:吸附有重组人FGF8a的Ni亲和柱采用线性梯度的方式将尿素从8mol/L浓度逐渐下降到0mol/L,流速为0.1ml/min,梯度时间24h。随着尿素浓度的逐渐下降,吸附在Ni上的重组人FGF8a开始复性。最终柱上的重组人FGF8a用洗脱缓冲液(20mmol/LTris-HCl,0.1mol/L NaCl,0.5mol/L咪唑,pH8.0)进行洗脱。经Ni纯化的重组人FGF8a用Sephacryl S-200凝胶层析柱做进一步纯化和缓冲液更换。S-200 Sephocryl凝胶层析所用缓冲液为PBS,流速为1min/ml。收集重组人FGF8a洗脱峰,并用Bradford法对其进行蛋白定量。
1.2.4 重组人FGF8a Western blot鉴定
待测样品经12%SDS-PAGE电泳后转移到NC膜上,条件100V,2h。5%脱脂奶粉封闭1h,在鼠抗6×His抗体中4℃孵育过夜。一抗孵育后的NC膜经TTBS清洗三次,每次10min。随后在碱性磷酸酶标记的二抗中孵育1h,膜清洗后用NBT/BCIP系统进行显色。
1.2.5 重组人FGF8a活性检测
按文献方法进行[6],将NIH3T3细胞以500个细胞/孔接种于96孔培养板,在含10%胎牛血清DMEM培养基中过夜培养后,去除未贴壁细胞,并向每孔中加入100μl的新鲜培养液。实验组中培养液中加入800μg/ml纯化后的FGF8蛋白,空白对照加入等体积的PBS溶液,每组实验重复5个复孔,培养24h后MTT法检测细胞增殖情况。
2 结果
2.1 人FGF8a表达载体的构建
利用特异性引物从克隆质粒pBluescript-FGF8a中扩增出FGF8a全长阅读框序列(图1)。扩增片段5′端含NheI位点,3′端含XhoI位点。PCR扩增片段经NheI和XhoI内切酶消化后与NheI和XhoI双酶切的原核表达载体pET14b进行连接,构建人FGF8a表达载体pET14b-FGF8a。表达载体中FGF8a序列在6×His序列下游,并与之同一阅读框。因此,表达的重组人FGF8a蛋白N端将带有6×His。表达序列与载体利用酶切技术对重组载体进行鉴定。连接载体经酶切鉴定正确后(图2),进行测序以确定表达序列和阅读框是否正确。
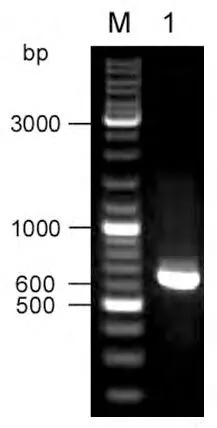
图1 PCR扩增的人FGF8a片段电泳分析
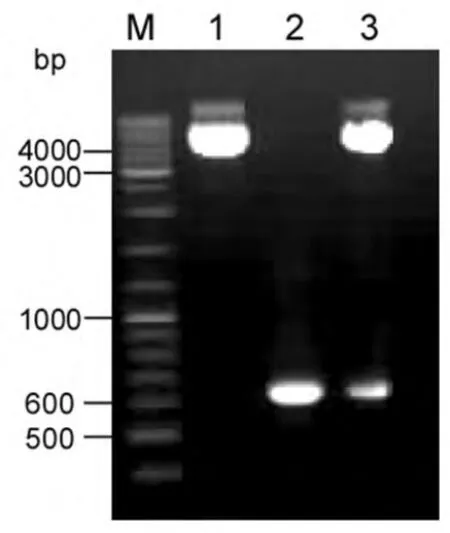
图2 FGF8a重组表达质粒限制性内切酶酶切鉴定
2.2 人FGF8a在大肠杆菌中有表达与纯化
转化了pET14b-FGF8a质粒的宿主菌BL21(DE3)pLysS用1mmol/L IPTG进行诱导表达,4小时诱导后在预期分子量大小的位置产生明显的蛋白条带(图3A)。Western blot鉴定该蛋白条带为重组FGF8a(图3B)。包涵体经8M脲变性溶解后过Ni亲和柱,并在柱上在位复性。Ni亲和柱洗脱峰再经Sephacryl S-200分子筛柱纯化。经Ni亲和柱和Sephacryl S-200分子筛柱纯化到的蛋白能被特异性抗原识别(图4B),且纯度达到电泳纯(图4A)。
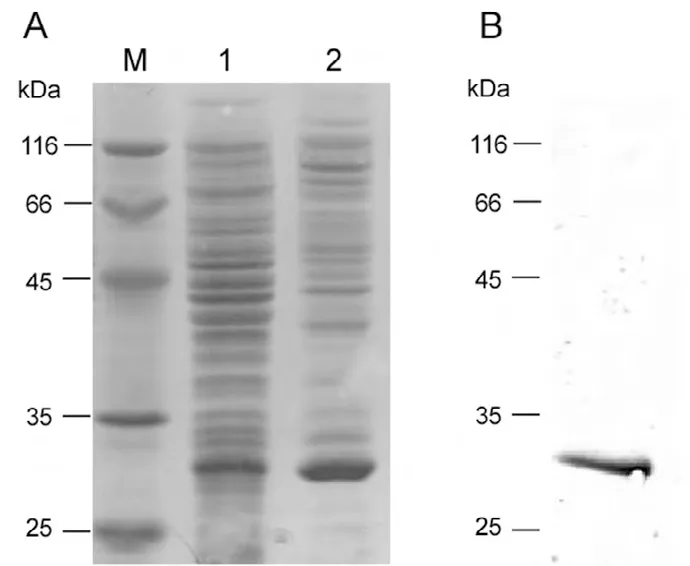
图3 人FGF8a在大肠杆菌中表达
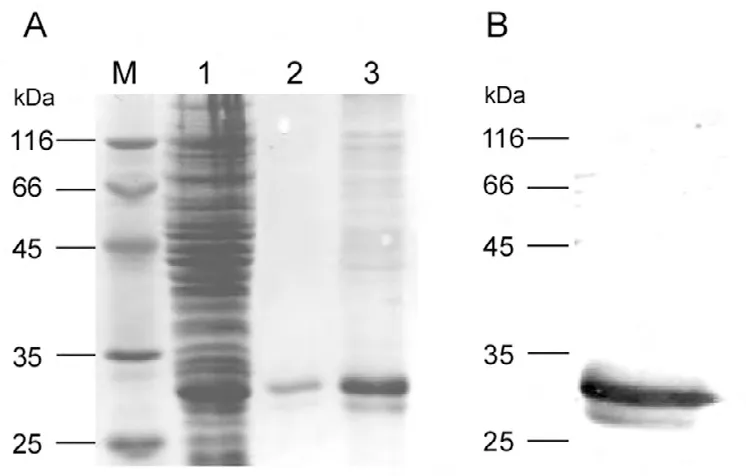
图4 人FGF8a纯化
2.3 重组人FGF8a活性检测
FGF在体外具有刺激细胞增殖的能力,据此特性,可对FGF的活性进行检测。传代培养24h后的NIH3T3成纤维细胞分别加入纯化后的重组FGF8a(800μg/ml)和PBS溶液,利用MTT法检测细胞的增殖情况,结果显示,与加PBS对照组相比,加入重组FGF8a后,NIH3T3细胞分裂增殖显著增加(图5)。
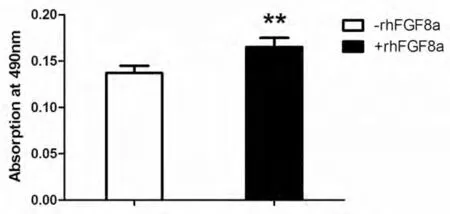
图5 重组人FGF8a活性检测
3 讨论
众多研究表明,不同的FGF8亚型在人类胚胎发育过程中,在多种不同组织中表达,对器官的发育与形成起着重要作用。为得到大量人FGF8a蛋白用于功能研究,我们尝试利用大肠杆菌系统表达人FGF8a。结果表明人FGF8a能在大肠杆菌中大量表达,但重组表达的FGF8a以包涵体形式存在。包涵体中的多肽不具高级构象,故无生理活性。为使大肠杆菌中表达的FGF8a有生理功能,可采用两种方式:第一对包涵体中的多肽进行体外复性;第二改变大肠杆菌的表达条件,增加胞质中可溶性FGF8a的含量[7]。第二种方法虽可避免包涵体复性过程的烦琐,但也产生了另外的问题,如表达量不高、增加纯化难度等。在本研究中,我们采用了柱上在位复性的方式,发现柱上复性后的FGF8a经洗脱后并不会出现沉淀现象,且整个复性过程操作简单。因此,柱上在位复性方式对于某些蛋白复性可能是一种不错的选择。
为方便纯化,我们在表达的人FGF8a蛋白N端增加了6×His标签,经Ni亲和柱和凝胶过滤两步色谱纯化后,重组蛋白纯度能达到电泳纯(图4)。纯化的重组人FGF8a处理NIH3T3细胞后,细胞增殖能力与对照相比明显增加,表明N端融合6×His标签的人FGF8a具有生理功能。
[1]Itoh N,Ornitz DM.Fibroblast growth factors:from molecular evolution to roles in development,metabolism and disease[J].JBiochem 2011,149(2):121-130.
[2]Ornitz DM,Itoh N.Fibroblast growth factors[Z].Genome Biol 2001,2(3):REVIEWS3005.
[]3Frank DU,Fotheringham LK,Brewer JA,Muglia LJ,Tristani-Firouzi M,Capecchi MR,Moon AM.An Fgf8 mouse mutant phenocopies human 22q11 deletion syndrome[J].Development 2002,129(19):4591-4603.
[4]Gemel J,Gorry M,Ehrlich GD,MacArthur CA.Structure and sequence of human FGF8[Z].Genomics 1996,35(1):253-257.
[5]Sunmonu NA,Li K,Li JY.Numerous isoforms of Fgf8 reflect its multiple roles in the developing brain[J].JCell Physiol 2011,226(7):1722-1726.
[6]Potula HH,Kathuria SR,Ghosh AK,Maiti TK,Dey S.Transient expression,purification and characterization of bioactive human fibroblast growth factor 8b in tobacco plants[J].Transgenic Res 2008,17(1):19-32.
[7]付灿.重组人成纤维细胞生长因子-8a在大肠杆菌中的可溶性表达[J].菏泽学院学报,2009,31(2):94-98.
