人重组内皮抑素联合化疗对人肝癌HepG2裸小鼠移植瘤作用观察
2015-12-22董海鹰王知非
董海鹰 王知非⋆
人重组内皮抑素联合化疗对人肝癌HepG2裸小鼠移植瘤作用观察
董海鹰 王知非⋆
目的 研究人重组内皮抑素(内皮抑素)对人肝癌单独及联合化疗的作用。方法 应用内皮抑素或者联合氟尿嘧啶(5-Fu)作用于Hepg-2肝癌裸小鼠移植瘤,在体外用cck-8检测及流式细胞技术研究内皮抑素对HepG-2作用,体内实验组移植瘤小鼠随机分成A、B、C、D四组,每组5只。A组为阴性对照组,B组为单独内皮抑素治疗组,C组为内皮抑素联合5-Fu化疗组,D组为单独5-Fu化疗组。测量肿瘤体积1次/3d,给药7d后比较各组抑瘤率,肿瘤病理HE染色,免疫组化检测微血管计数(MVD)及VEGF(血管内皮生长因子)表达情况。结果 cck-8检验结果显示药物作用24h,单独内皮抑素仅在100μg/ml的剂量时对HepG-2细胞在体外有轻度杀伤作用,细胞死亡率20.7%,其余浓度无明显杀伤作用;作用48h,内皮抑素在50μg/ml、100μg/ml、200μg/ml对HepG-2有一定杀伤作用,细胞死亡率分别为20.8%,46.3%,15.8%;在各时间段和浓度的内皮抑素对HepG-2杀伤作用显著小于相应内皮抑素+5-Fu组(P<0.05);流式细胞技术检验100μg/ml浓度内皮抑素诱导HepG-2凋亡的作用,结果显示内皮抑素100μg/ml作用于HepG-2细胞24h及48h,细胞凋亡率分别为26.4%、21.1%(对照组为5.1%);内皮抑素100μg/ml在48h对人脐静脉内皮细胞有诱导凋亡作用,凋亡率为19.5%(对照组为11.7%)。联合内皮抑素和5-Fu化疗,对于人肝癌HepG-2细胞裸鼠移植瘤抑瘤率高于单独内皮抑素和单独5-Fu化疗(P<0.05)。结论 内皮抑素对人肝癌HepG-2细胞有一定的杀伤作用,但并非在所有浓度和作用时段,对人肝癌HepG-2细胞及脐静脉内皮细胞有凋亡诱导作用,联合内皮抑素和5-Fu化疗对于人肝癌HepG-2细胞裸鼠移植瘤抑瘤率显著高于单独内皮抑素和单独5-Fu化疗,两种药物有协同作用。单独内皮抑素治疗对于人肝癌HepG-2细胞裸鼠移植瘤有一定抑瘤作用,内皮抑素可以减少HepG-2人肝癌裸鼠皮下移植瘤肿瘤微血管密度及VEGF表达。
内皮抑素 HepG-2 异位移植瘤模型 抗血管生成
肿瘤抗血管生成目前已经成为抗肿瘤研究的热点,包括较多新的理论出现,如肿瘤血管正常化窗口期等。人重组内皮抑素(恩度)是抗肿瘤血管生成的新药,已经推荐为 NCCN 肺癌临床实践指南中国版非小细胞肺癌一线治疗方案,对于其他肿瘤的治疗也正在临床和临床前尝试。但抗肿瘤血管治疗药物,在肿瘤血管正常化理论根据下,在临床如何与传统抗肿瘤药物联合应用,尚无特别的基于该理论的实践。肝细胞癌属于多血管实体瘤,其发生发展过程与肿瘤血管生成密切相关。本试验拟通过在小鼠肝癌移植瘤模型上联合应用内皮抑素及经典化疗药物,观察抗肿瘤效果,以揭示对于肝癌,抗血管内皮生成治疗如何和临床常规化疗药物联合或者协同作用。报道如下。
1 材料和方法
1.1 细胞系和实验动物 细胞株:HEPG2人肝癌细胞株,本实验室冻存。实验动物:4周龄的Balb/c- nu/nu裸鼠,雄性26只,体重16~18g,平均17g。购于浙江省中医院实验动物中心。饲养于浙江大学加州国际纳米技术研究院分子影像平台,SPF级净化冯氏独立送风隔离笼具笼盒内。所有操作均在饲养室的AIRTEH超净台无菌条件下完成。
1.2 试剂 (1)DMEM完全培养液培养,含 100IU /ml青霉素,100μg/ml链霉素。(2)胰酶消化液:购于华美生物工程公司,4℃储存。(3)G418购于Clontech公司。(4)人重组内皮抑素注射液(每支150mg/ml):于-4℃保存,使用时加入生理盐水稀释或加入完全培养基至所需浓度。(5)单克隆抗体CD31:丹麦DAKO公司;VEGF抗体 ,购于NeoMarkers公司,免疫组化检测试剂盒,购于DAKO公司。
1.3 体外实验 (1) 选取对数期生长的HepG-2细胞,制备细胞悬液浓度5×107/ml。在接种超净台内,裸鼠背部皮肤75%酒精消毒,接种肿瘤细胞0.2ml/只。接种后第7天,随机分组:空白对照组(A组),生理盐水0.5ml/d;内皮抑素单独治疗组(B组),内皮抑素1.5mg/(kg·d),加生理盐水稀释至0.25ml/只;内皮抑素和5-Fu联合治疗组(C组),内皮抑素1.5mg/(kg·d),加生理盐水稀释至0.25ml/只,同时给予5-Fu[(20mg/(kg·d)],加生理盐水稀释至0.25ml/只,每次注射前将两药抽于同一注射器混匀;单独5-Fu治疗组(D组)[20mg/(kg·d)],加生理盐水稀释至0.25ml/只。均为腹腔内注射,1次/d,连续7d。每日观察各组裸鼠的精神、饮食、活动、大小便等一般情况。用药前后称取体重。每日用游标卡尺测量肿瘤结节的最大长度(a)、宽度(b) 和高度(c),肿瘤大小(长×宽),肿瘤体积计算公式V=W2×L/2,式中W为宽度,L为长度。末次给药后24h将裸鼠最后一次活体成像后脱臼处死,解剖剥离尽量剥离其表面包膜,切除心脏、肝脏、脾脏、肺脏、肾脏组织,分别称重(脏器系数=脏器质量/裸小鼠质量) ,肉眼观察及病理组织学切片观察脏器及肿瘤病理学变化,并称瘤重,根据以下公式计算肿瘤抑制率: 肿瘤抑制率=(1-实验组平均瘤重/对照组平均瘤重) ×100%。剖开胸腔及腹腔在活体荧光成像仪下观察有无脏器转移。(2)将移植瘤组织及心脏、肝脏、脾脏、肺脏、肾脏组织常规迅速采用10%中性福尔马林液固定、脱水、石蜡包埋,制备连续切片,组织病理包括肿瘤组织HE染色,免疫组化检测微血管计数(MVD)、VEGF等表达情况。CD31标记肿瘤微血管内皮细胞,MVD的测量采用Weidner法:每张切片在100倍视野下寻找血管高密度区,再在高倍光镜下计数微血管数目,每一个染成棕黄色的可与周围血管、肿瘤细胞和其它结缔组织分开的内皮细胞或内皮细胞簇作为一个微血管,血管腔的有无不作为判断血管的标准,只要结构不相连,其分支结构亦作为一个血管计数,分别计数5个视野,取均数表示MVD。VEGF计分标准:按着色细胞染色强度计分为:细胞呈阴性染色,无阳性细胞为-;染色弱,阳性细胞呈淡黄色,阳性细胞<25%为+;染色中等,阳性细胞呈棕黄色,阳性细胞25%~50%为++;染色强,阳性细胞呈棕褐色,阳性细胞>50%为+++。
1.4 统计学方法 采用SPSS 10.0统计软件。计量资料以(x±s)表示,组间比较采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 各组裸鼠用药前体重无差异,用药后体重均有增加,治疗结束后各组裸鼠体重变化无差异(P>0.05)。给药期间,B组裸鼠一般情况(包括精神、活动、进食等)同A组,C组和D组活动不如A组及B组,但是精神尚可,无明显萎靡,对外界刺激反应活跃,四肢无消瘦,未见出现腹泻反应,且裸鼠全部存活至实验结束。
2.2 各组移植瘤移植瘤体积变化 见表1。

表1 各组不同时间肿瘤体积对比[cm3,(x±s)]
2.3 各组裸小鼠治疗前后小鼠质量、肿瘤质量及抑瘤率比较 见表2。
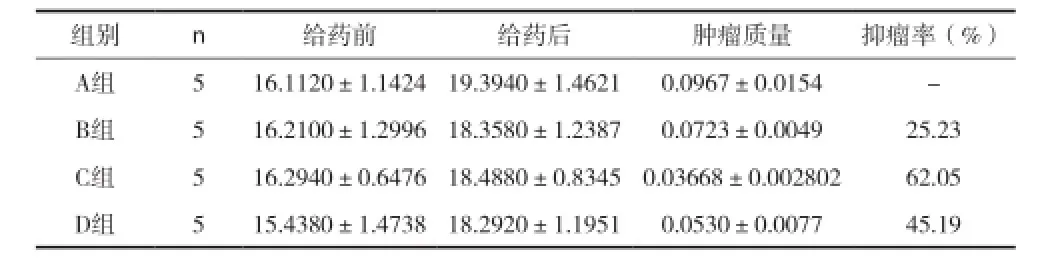
表2 各组裸小鼠治疗前后小鼠质量、肿瘤质量及抑瘤率比较[g,(x±s)]
2.4 移植瘤大体观察 肿瘤多为圆形或椭圆形,呈分叶状,表面有结节突起,肿瘤与周围肌肉及皮肤有粘连,呈淡红色,质脆,有的中心部分坏死。
2.5 病理切片HE染色光镜下观察 肿瘤细胞体积大,肿瘤细胞核深染,核大,常见有切迹、凹陷,核形不规则,核染色质比例较大。瘤细胞或散在分布,或形成癌巢,成团分布。肿瘤周边有较多淋巴细胞浸润。符合肿瘤组织形态。
2.6 主要脏器变化 治疗后各组裸小鼠的心脏、肝脏、脾脏、肺脏、肾脏的脏器系数差异无统计学意义(P>0.05)。肉眼观察,各组动物各脏器均无明显异常。病理组织学切片观察结果表明,各组均未出现明显病理学改变。
2.7 免疫组化检查结果 (1)MVD:A:(15.2±3.1)[高倍视野显微镜(HPF)]; B:(6.7±1.3)(HPF); C:(6.1±1.5)(HPF); D:(12±2.3)(HPF)。与A组比较,B、C、D组MVD均显著减少(P<0.05);C组和B组MVD均显著少于D组(P<0.05);C组和B组MVD无显著差别(P>0.05)。(2)VEGF 检测按着色细胞染色强度计分结果:A组:+++;B组: ++;C组:+-++;D组: ++。与A组比较,B、C、D组VEGF表达显著减少(P<0.05);B、C、D组VEGF表达结果无明显差异(P>0.05)。
3 讨论
文献报道靶向于VEGF的药物可直接作用于异常表达VEGFR并部分依赖于VEGF生存的肿瘤细胞[1],但内皮抑素对于肝癌裸鼠移植瘤的治疗选择报道较少,因而参照其他文献中[2,3]类似治疗的剂量选择1.5mg/(kg·d),另外结合动物实验手册,根据人和小鼠在用药剂量上的比例系数(约0.11)结合本实验给药途径得出该剂量。本实验选择5-Fu作为联合治疗用药,因内皮抑素联合5-Fu具有协同作用,可以抑制大肠癌的肝转移[4],本实验采取腹腔注射给药方式[5]。但通过腹腔内种植的渗透压力泵持续腹腔注入内皮抑素可以低于一次性注射5倍的剂量获得更好的效果,进一步用人胰腺癌模型证实,该方法和腹腔注射1次/d比较,明显提高肿瘤抑瘤率,可以小于后者8倍的剂量达到同样抑瘤率 ,并且在两个国家已经开始临床试验[6]。但本实验较大程度上是对实验模型的一个尝试性应用,所以未选用该给药方法。
本实验中,C组和B组MVD均显著少于D组;C组和B组MVD无显著差别。说明虽然内皮抑素联合5-Fu能显著提高抑瘤率,但是对于减少MVD未见明显协同作用;内皮抑素单独应用可明显减少肿瘤MVD,与联合5-Fu化疗组无明显差别,尽管单独化疗对减少MVD有一定作用。单独给予5-Fu亦引起一定的MVD减少,但是C组的MVD与B组比较无显著差异,而C组抑瘤率明显高于B组,提示在相同的微血管密度减少情况下,结合化疗会提高抑瘤率。另外相对于D组,C组MVD明显减少,而且抑瘤率明显提高,采用两药相互作用系数(CDI)评价两药相互作用性质,联合用药组统计结果显示,CDI=0.9261,说明内皮抑素和5-Fu两种药物有协同作用,这种协同作用机制可通过抗肿瘤血管生成中肿瘤血管正常化理论解释[7],在此期间,肿瘤组织血流量暂时增大、血流分布更加均匀、合理,可增加化疗药物和细胞毒性药物的传递效率,增进化学治疗的效果;而随之而来的血氧含量的增高可明显提高肿瘤组织细胞对放疗的敏感性。对于内皮抑素是否亦和Avastin一样可诱导肿瘤血管正常化,目前文献未见报道,理论上说,任何恢复促血管生成和抗血管生成分子平衡的治疗均可诱导血管正常化[8],实际上,包括减少对激素依赖的肿瘤的激素水平因可降低VEGF的表达亦会导致血管正常化。但内皮抑素和血管靶向药物是否有此效果目前还未见报道[9],因此本实验结果显示的协同作用可能与此有关。
治疗后各组裸小鼠的心脏、肝脏、脾脏、肺脏、肾脏的脏器系数无显著性差异( P> 0.05) 。肉眼观察,各组动物各脏器均无明显异常;病理组织学切片观察结果表明,各组均未出现明显病理学改变。说明内皮抑素及内皮抑素联合5-Fu治疗对裸鼠主要脏器无明显损害。在免疫组化方面,除检测MVD外,还检测了VEGF在治疗后的表达,内皮抑素可通过阻断VEGF受体KDR/FIK一1酪氨酸的自磷酸化和一些蛋白激酶的激活[有丝分裂原激活蛋白激酶(MAPK)、细胞外信号调节蛋白激酶(ERK)],阻断VEGF介导的信号传导途径 。内皮抑素亦能通过下调肿瘤细胞VEGF mRNA及蛋白质的表达而影响内皮细胞上一氧化氮合成酶的活性,减少VEGF诱导的一氧化氮的生成,从而抑制了VEGF介导的内皮细胞迁移和血管的形成 。VEGF在肝癌患者体内呈过高表达,与肝癌的生长、转移、复发及治疗密切相关。本实验结果显示与A组比较,B、C、D组VEGF表达显著减少(P<0.05);与内皮抑素下调内源性VEGF的表达有关。
1 Napoleone F,Robert S. Kerbel Angiogenesis as a therapeutic target.Nature 2005,438(7070):968~974.
2 Horsman MR, Siemann DW.Pathophysiologic Effects of Vascular-Targeting Agents and the Implications for Combination with Conventional Therapies.Cancer Res,2006,66(24):11520~11539.
3 Roy S. Herbst, Anh Tuyet Leel, Hai T. Tranl ,et al. Clinical studies of angiogenesis inhibitors: The university of texas md anderson center trial of human endostatin . Curr Oncol Rep, 2002,3(2):131~140.
4 周志伟,万德森,王国强,等.血管生成抑制剂YH-16联合氟尿嘧啶抑制结直肠癌肝转移的研究.中华胃肠外科杂志, 2006, 9(2):161~164.
5 Citrin Deborah,Scott Tamalee,Sproull Mary,et al. In vivo tumor imaging using a near-infrared-labeled endostatin molecule. Int J Radiat Oncol Biol Phys,2004,58(2):536~541.
6 Oliver Kisker,Christian M,Becker,et al.Pirie-Shepherd,and Judah Folkman Continuous Administration of Endostatin by Intraperitoneally Implanted Osmotic Pump Improves the Efficacy and Potency of Therapy in a Mouse Xenograft Tumor Model. Cancer Res,2001,61(20):7669-74
7 Rakesh K. Jain. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Scince,2005,307(5706):58.
8 Frank Winkler,Sergey V. Kozin,Ricky T. Tong,et al.Kinetics of vascular normalization by VEGFR2 blockade governs brain tumor response to radiation: Role of oxygenation, angiopoietin-1,and matrix metalloproteinases. Cancer Cell,2004,6(6):553~563.
9 Chen C,Liu Y,Xu J. C086, a novel analog of curcumin, induces growth inhibition and down-regulation of NFκB in colon cancer cells andxenograft tumors.Cancer Biol Ther,2011,12(9):797~807.
Objective To evaluate endostatine 's anti-tumor effects combined with chemothery using HCC HepG-2 tumor xenograft mouse model. Methods HepG-2 cells were transplanted subcutaneously to make a xenograft tumor model ,tumor's growth was observed in vivo. 20 mice of 4 weeks age was made into HepG-2 tumor model and were divided into 4 groups as group A,B,C,D ,A as control with normal sodium ,B with endostatine,C with endostatine combind with 5-Fu,D with 5-Fu,body weight and tumor size were measured every 3 days to observe the change of xenografted tumor. Results Endostatine had a cytoxic effect on HepG-2 cells at 24h(cell death rate 20.7%)with 100μg/ml concentration and 48h at 50μg/ml、100μg/ml、200μg/ml concentration(cell death rate 20.8%,46.3%,15.8%); at 100μg/ml ,endostatine induced apoptosis in HepG-2 after 24h and 48h,apoptosis rate was 19.5%(11.7% as control). Endostatine had the highest tumor inhabit rate (TIF) when combined with 5-Fu chemothery compared with either endostatine alone or 5-Fu alone (P>0.05),endostatine alone had a certain tumor inhibitoy effects when treating tumor alone . Microvessle density (MVD) and expression of VEGF were reduce after endostatine treatment either alone or combine with 5-Fu. Conclusions Endostatine has cytoxic effects on HepG-2 cells in vitro only at certain dose and time period ,it can induce apoptosis in both HepG-2 cells and human human umbilical vein cells . Combining with 5-Fu chemothery can have a synergistic effect on TIF compared with treating with any agent alone .Endostatine reduces tumor's MVD and expression of VEGF.
Endostatin HepG-2 Xenograft tumor model Antiangiogenesis
310014 浙江省人民医院
*通讯作者
