肥城桃果实多酚氧化酶酶学特性的研究
2015-12-20王娟
王娟
(菏泽学院园林工程系,山东菏泽274015)
肥城桃果实多酚氧化酶酶学特性的研究
王娟
(菏泽学院园林工程系,山东菏泽274015)
以肥城桃果实为试材,分离纯化了导致酶促褐变的多酚氧化酶(PPO),并对其性质进行了分析。结果表明,以叔丁基邻苯二酚和绿原酸为底物,加入十二烷基磺酸钠(SDS)后使PPO活性分别增大19倍和12倍,催化效率分别提高11.5倍和17倍,PPO最适pH为6.5,2-羟基-2,4,6-环庚三烯酚酮显著抑制PPO活性。部分变性SDS-PAGE显示PPO在表观分子量分别为49ku和50ku有两条活性条带,等电聚焦IEF显示可溶性PPO和膜结合PPO都含有两个酸性范围的条带,其pI为5.7和5.8,膜结合PPO还有一条pI为5.4的条带。结合western杂交在膜结合PPO的3种同工酶中,只有2种能被抗体识别;全变性SDS-PAGE和western blot发现存在一条分子量为60ku的多肽。
肥城桃,果实,多酚氧化酶,酶学特性
多酚氧化酶(PPO),也称为酪氨酸酶(EC1.14.18.1),是引起果实采后酶促褐变的关键酶[1]。多酚氧化酶是一种含铜酶,在氧的作用下可以催化两种不同的反应:使单酚发生羟基化作用形成O-二元酚(单酚氧化酶活性)和氧化O-二元酚形成O-醌(二元酚氧化酶活性)[2]。酚类物质和多酚氧化酶在正常生物体的细胞内是相互分开的,但是在提取液中或者细胞受到伤害时,酚类物质和多酚氧化酶相互接触,迅速氧化产生O-二元酚。氧化作用产生的O-醌性质活泼,能够迅速聚集形成相对难溶的褐色聚合物,如黑色素。O-醌还可以与氨基酸、肽、蛋白质反应,既改变了蛋白质的结构和功能,又改变了营养价值[3]。
肥城桃(Prunus persica L.cv Feicheng)是我国著名的传统名果,深受人们的喜爱,在国内外拥有很高的声誉。但肥城桃果实采后极易褐变和腐烂变质,软化快、耐贮性差,大大限制了肥城桃的发展。朱树华等研究了一氧化氮对采后肥城桃果实细胞壁代谢的影响和贮藏期间乙烯生物合成和脂氧合酶活性的抑制作用[4-5],李富军等研究了1-MCP和AVG对肥城桃果实采后衰老的影响[6],但对于肥城桃果实中PPO的性质了解较少。研究表明,导致鸭梨、苹果和桃的主要褐变物质是绿原酸[7],邻苯二酚也是导致褐变的重要褐变物质,且中华寿桃果肉的PPO最适作用底物是绿原酸和邻苯二酚[8]。因此,本实验以肥城桃果实为试材,分离纯化了果实中的PPO,以绿原酸和邻苯二酚作为PPO的作用底物,对其性质进行了研究。
1 材料与方法
1.1材料与仪器
实验用肥城桃果实采自山东省肥城市仪阳乡果园,运回实验室后,切碎用液氮速冻,-80℃保存备用;抗坏血酸、绿原酸、2-羟基-2,4,6-环庚三烯酚酮、叔丁基邻苯二酚(4-TBC)、硫酸铵、Triton X-114均购自Sigma公司,Triton X-114用100mmol·L-1磷酸钠缓冲溶液(pH7.3)稀释3倍[9];其他化学试剂均为分析纯,购自Fluka公司。
UV-1700型分光光度计日本岛津公司;5418型高速离心机德国Eppendorf有限公司;HH-2型数显电热恒温水浴锅上海悦丰仪器仪表有限公司;FSH-2A型可调高速匀浆机金坛市华伟仪器厂;Sartorius精密pH计北京泽祥恒达科技发展公司;Mini Trans-Blot电泳槽、电泳仪美国Bio-Rad公司。
1.2实验方法
1.2.1酶的提取参照Xu[10]的方法并加以改进。取50g果肉用剪刀剪碎,按1∶1比例加入100mmol·L-14℃预冷的pH7.3的PBS中,并加入1mmol·L-1苯甲基磺酰氟(PMSF),10mmol·L-1的抗坏血酸和1mmol·L-1盐酸苯甲脒,用高速匀浆机匀浆1min。匀浆液用8层纱布过滤,滤液于4℃下4000×g离心10min,取沉淀加入12.5mL 100mmol·L-1的磷酸钠缓冲溶液[pH7.3,含60g·L-1(w/v)Triton X-114],4℃悬浮培养30min后,于37℃水浴15min。水浴期间,含有疏水蛋白和酚类物质的去垢剂聚集成为混合型胶束,使溶液变浑浊。浑浊液在25℃10000×g离心15min,收集澄清透明的上清液即为含有PPO的酶液。加入pH7.0的硫酸铵使其达到250g·L-1,4℃搅拌过夜,再于4℃ 12000×g离心30min。取上清液并加入80%的饱和硫酸铵,4℃搅拌1h,再次离心,沉淀中加入5mL 10mmol·L-1pH7.3的PBS透析除盐,得到的溶液进行PPO活性的分析。
1.2.2酶活性的检测
1.2.2.1测定方法PPO活性的测定反应液含底物、缓冲液和80μg·mL-1PPO。以分光光度法检测25℃反应生成物在400nm的吸光度[11]。以25℃每分钟OD值变化0.001所需的酶量定义为PPO的一个酶活性单位(U)。
1.2.2.2底物、pH、SDS对PPO活性的影响底物对PPO活性的影响:以4-TBC为底物,检测25℃反应生成的4-(叔丁基)苯并-1,2-醌在400nm的吸光度[11]。反应液含6mmol·L-14-TBC、50mmol·L-1乙酸(pH3.5~5.0)和80μg·mL-1PPO。以绿原酸为底物,检测25℃绿原酸转化为O-醌时在400nm波长的吸光度变化。反应液为1.0mL的50mmol·L-1磷酸钠缓冲液(pH6.5,含有2mmol·L-1的绿原酸和80μg·mL-1PPO。
pH对PPO活性的影响:配制pH3.5~7.0的50mmol·L-1醋酸钠-磷酸钠缓冲溶液,按酶活测定体系加入酶液,测定PPO活性的变化。
SDS对PPO活性的影响:在反应体系中分别设加和不加2mmol·L-1SDS,室温下测定pH,反应前后各测一次pH。按酶活测定方法测定PPO活性的变化。以加SDS和不加SDS条件下PPO酶活性的比值来表示活化度。
抑制剂对PPO活性的影响:以2-羟基-2,4,6-环庚三烯酚酮作为PPO的抑制剂。每毫升反应液含有50mmol·L-1磷酸钠缓冲液(pH6.5)、0~3.6mmol·L-14-TBC、0~60μmol·L-12-羟基-2,4,6-环庚三烯酚酮和2mmol·L-1SDS,PPO浓度为87μg·mL-1。按酶活性测定方法测定PPO活性。
1.2.3变性SDS-PAGE和部分变性SDS-PAGE按照Laemmli[12]的方法进行PPO的变性SDS-PAGE;部分变性SDS-PAGE不加β-巯基乙醇且不加热以保护酶的活性。
1.2.4等电聚焦(IEF)电泳、凝胶染色及Western分析
参照O’Farrell[13]的方法检测PPO同工酶。等点聚焦电泳、凝胶染色及Western分析同过氧化物酶的分析方法[14]。
1.3数据处理
采用Microsoft Excel 2007和Origin 8.0进行数据分析和作图。根据Michaelis-Menten方程,得到米氏常数(Km)和最大反应速度(Vm);Dixon作图法进行PPO的动力学研究,确定抑制类型并求得抑制常数(KI);用凝胶成像系统对电泳结果进行观察,并采集图像。
2 结果与分析
2.1PPO的提取

图1 肥城桃果实不同组织的PPO活性Fig.1 PPO activity at different tissues of Feicheng peach fruit
用Triton X-114和硫酸铵从桃果实中提取PPO,Triton X-114可以起到增溶膜蛋白的作用。该方法可以得到澄清浓缩的酶液,有利于进一步的电泳分析。从图1可以看出,在膜和可溶性组分中均检测到PPO活性,膜上的PPO活性单位(90.5U)远高于可溶性组织中的PPO酶量(11.4U),表明PPO主要存在于膜组织中。
2.2PPO的酶学特性
2.2.1底物、pH和SDS对PPO活性的影响图2表示分别以4-TBC和绿原酸为底物,不同pH及有无2mmol·L-1SDS对膜结合PPO的影响。无SDS时,在酸性pH范围内PPO活性高,PPO的最适pH为4;加入2mmol·L-1SDS后PPO活性提高,PPO的最适pH变为6.5。底物4-TBC比绿原酸对PPO活性的影响大,以4-TBC为底物加入2mmol·L-1SDS可使PPO活性增大19倍,而以绿原酸为底物时加入2mmol·L-1SDS可使PPO活性增大12倍。有研究表明最适pH低的原因是PPO活性受酸的影响[15]。为了研究SDS的这种激活作用是否依赖于底物,对不同底物下的活化作用进行了实验。由图2可以看出,两种底物存在时,PPO活化度的变化趋势基本一致,但底物4-TBC存在时比绿原酸存在时的PPO活化度要高。
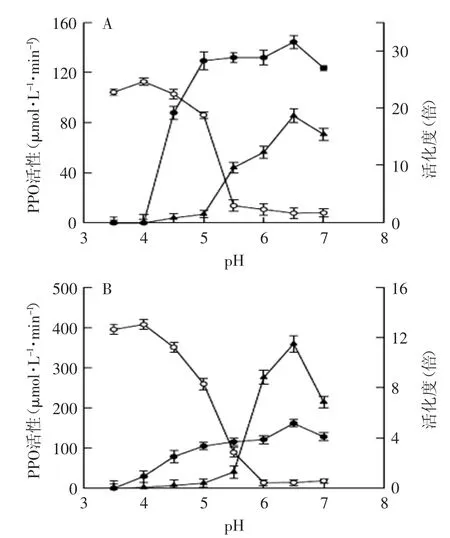
图2 不同pH下桃PPO活性Fig.2 Activity of peach PPO at different pH values
2.2.2PPO的动力学特征分别以4-TBC和绿原酸为底物研究桃果实中膜结合PPO的动力学特征。由表1可知,相同SDS条件下,两种底物得到的Km值相近。而SDS引起Vm明显增大,使得以绿原酸和4-TBC为底物时PPO的催化效率(Vm/Km)与不加SDS时相比分别增大了17倍和11.5倍。这种PPO催化效率的变化与前人[16]的报道相一致。

表1 桃PPO的动力学指标Table.1 Kinetic parameters of peach polyphenol oxidase
2.2.32-羟基-2,4,6-环庚三烯酚酮对PPO的抑制为进一步研究膜结合PPO的特性,选择2-羟基-2,4,6-环庚三烯酚酮(一种特异的PPO抑制剂),并研究其对PPO的抑制作用。为了分析抑制动力学,以4-TBC为底物,选择5个不同的底物浓度,以1/V对抑制剂浓度进行Dixon作图。图3表明,2-羟基-2,4,6-环庚三烯酚酮是一种典型的竞争性抑制剂,各直线延伸的交点所对应X轴的截距为-3μmol·L-1,因此得到抑制常数KI=3μmol·L-1。

图3 2-羟基-2,4,6-环庚三烯酚酮抑制PPO活性的Dixon图Fig.3 Dixon plots for the inhibitory effect of tropolone on PPO activity
2.3PPO的同工酶分析
2.3.1SDS-PAGE分析部分变性SDS-PAGE检测桃果实PPO同工酶结果如图4所示。由图4可知,膜结合PPO(2)和可溶性PPO(3)有两个分子量约49ku和50ku的活性条带,通过进一步的转膜可以得到更清晰的条带(4)。加入PPO特异抑制剂2-羟基-2,4,6-环庚三烯酚酮后进行染色,以确定这些条带是否和PPO相对应。结果发现,无论是膜结合PPO(5)还是可溶性PPO(6)均不存在活性物质条带,因此两个条带和PPO相对应。
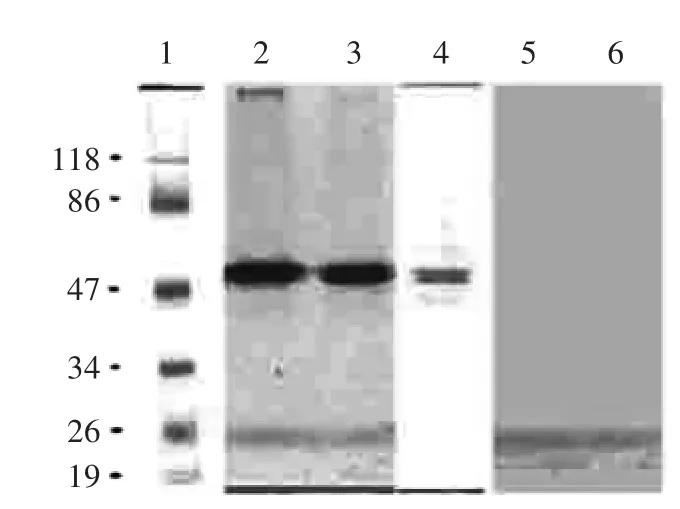
图4 SDS-PAGE分析Fig.4 SDS-PAGE analysis
2.3.2IEF分析用IEF(pH3.5~10)分析肥城桃的PPO结果见图5。可溶性PPO(1)和膜结合PPO(2)都含有两个酸性范围的条带,其pI为5.7和5.8。此外,膜结合PPO(2)还有一条pI为5.4的条带。当PPO活性抑制剂2-羟基-2,4,6-环庚三烯酚酮存在时染色不能检测到PPO条带(3、4),可以看出桃果实的PPO呈酸性同工酶形式。Hoyle采用IEF分析从蚕豆叶的叶绿体中纯化的PPO同工酶,发现其等电点在4.9~5.9,均含有分子量为65ku的蛋白质[17],在胡萝卜[18]和双孢蘑菇[19]中也得到了相同的结果。
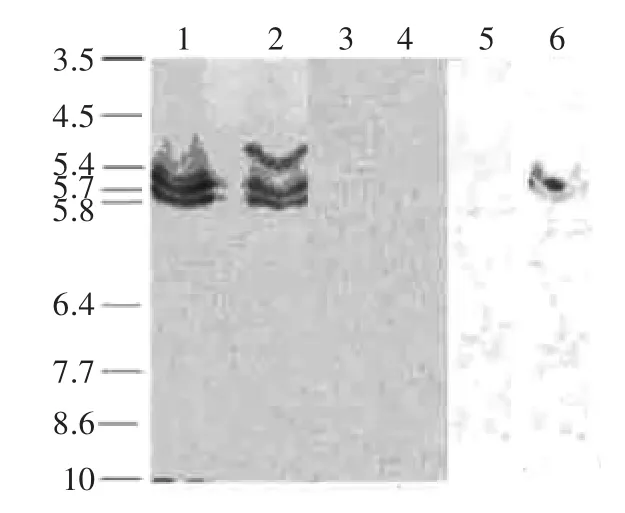
图5 PPO的IEF分析Fig.5 Isoenzymatic patterns of the different PPO
2.3.3Western杂交用蚕豆叶中PPO的多克隆抗体对IEF凝胶中的PPO进行western杂交。由图5可以看出,在可溶性PPO(5)中进行抗体免疫杂交未发现条带,而在IEF检测的膜结合PPO(6)的3种同工酶中,只有2种能被抗体识别。
变性SDS-PAGE,并在电泳后进行Western杂交,结果显示膜结合PPO(1)仅有一条分子量大约为60ku的条带。前人研究表明,胡萝卜PPO的36ku的条带表现PPO的活性,而在变性条件下条带的分子量为59ku[18]。甜菜根中也发现了36ku的PPO条带,在变性条件下条带的分子量为60ku[20]。
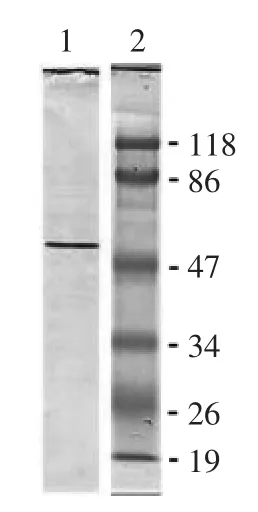
图6 桃PPO变性SDS-PAGE的Western杂交Fig.6 Western blotting of totally denaturing SDS-PAGE of peach PPO
3 结论
在膜和可溶性组分中均检测到PPO活性,其主要存在于膜组织中,具有很高的酚氧化酶活性。阴离子去污剂SDS大大提高了PPO活性及其催化效率,使PPO最适pH变为6.5。可溶性和束缚膜PPO在非变性IEF和SDS-PAGE中均有两条相似条带。而Western杂交后,IEF检测的膜结合PPO的3种同工酶中有2种能被抗体识别,但变性SDS-PAGE检测的膜结合PPO仅有一条分子量大约为60ku的条带。该研究为桃的褐变机理提供了一定的理论依据,以选用合适的调控因子,降低褐变率,延长货架期。
[1]Jiang Y,Duan X,Joyce D,et al.Advances in understanding of enzymatic browning in harvested litchi fruit[J].Food Chemistry,2004,88(3):443-446.
[2]Sánchez-Ferrer A,Rodríguez-López J N,García-Cánovas F,et al.Tyrosinase:a comprehensive review of its mechanism[J]. Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1995,1247(1):1-11.
[3]Matheis G,Whitaker J R.Modifications of proteins by polyphenol oxidase and peroxidase and their products[J].J Food Biochem,1984,8(3):137-162.
[4]Zhu S H,Liu M C,Zhou J.Inhibition by nitric oxide of ethylene biosynthesis and lipoxygenase activity in peach fruit during storage[J].Postharvest Biology and Technology,2006,42(1):41-48.
[5]朱树华,刘孟臣,周杰.一氧化氮熏蒸对采后肥城桃果实细胞壁代谢的影响[J].中国农业科学,2006,39(9):1878-1884.
[6]李富军,翟衡,杨洪强,等.1-MCP和AVG对肥城桃果实采后衰老的影响[J].果树学报,2004,21(3):272-274.
[7]蒋跃明,张东林,刘淑娴,等.椰子褐变底物的初步研究[J].植物生理学通讯,1992,28(5):347-349.
[8]段玉权,董维,张明晶,等.中华寿桃多酚氧化酶的特性研究[J].中国农业科学,2008,41(3):795-799.
[9]Bordier C Phase separation of integral membrane proteins in Triton X-114 solution[J].Journal of Biological Chemistry,1981,256(4):1604-1607.
[10]Xu J S,Zheng T L,Meguro S,et al.Purification and characterization of polyphenol oxidase from Henry chestnuts(Castanea henryi)[J].The Japan Wood Research Society,2004,50(3):260-265.
[11]Jimenez M,Garcia-Carmona F.The effect of sodium dodecyl sulphate on polyphenol oxidase[J].Phytochemistry,1996,42(6):1503-1509.
[12]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[13]O’FarrellPH.Highresolutiontwo-dimensional electrophoresis of proteins[J].Journal of Biological Chemistry,1975,250(10):4007-4021.
[14]王娟.肥城桃果实中过氧化物酶的特性研究[J].北方园艺,2012,15(15):28-30.
[15]Valero E,García-Carmona F.pH-induced kinetic cooperativityofathylakoid-boundpolyphenoloxidase[J]. Biochemical Journal,1992,286(2):623-626.
[16]Escribano J,Cabanes J,Chazarra S,et al.Characterization of monophenolaseactivityoftablebeetpolyphenoloxidase. Determination of kinetic parameters on the tyramine/dopamine pair[J].Journal of Agricultural and Food Chemistry,1997,45(11):4209-4214.
[17]Hoyle M C.High resolution of peroxidase-indoleacetic acid oxidase isoenzymes from horseradish by isoelectric focusing[J].Plant Physiology,1977,60(5):787-793.
[18]Soderhall I.Properties of carrot polyphenoloxidase[J]. Phytochemistry,1995,39(1):33-38.
[19]Wichers H J,Gerritsen Y A M,Chapelon C G J.Tyrosinase isoformsfromthefruitbodiesofAgaricusbisporus[J]. Phytochemistry,1996,43(2):333-337.
[20]Gandia-Herrero F,Garcia-Carmona F,Escribano J. Purification and characterization of a latent polyphenol oxidase from beet root(Beta vulgaris L.)[J].Journal of Agricultural and Food Chemistry,2004,52(3):609-615.
Study on enzymatic characteristics of polyphenol oxidase in Feicheng peach fruit
WANG Juan
(Department of Landscape Engineering,Heze University,Heze 274015,China)
Polyphenol oxidase involved in enzymatic browning was extracted from Feicheng peach fruit and its characteristics were analyzed.Results showed that the PPO activity increased 19 and 12 times respectively after adding sodium dodecyl sulfate with the substrates of 4-tert-butylcatechol and chlorogenic acid.The catalytic efficiency enhanced 11.5 and 17 times respectively.The optimum pH value increased to 6.5.And 2-hydroxy-2,4,6-tropolone was a typical competitive inhibitor.A partially denatured sodium dodecyl sulfatepolyacrylamide gel electrophoresis(SDS-PAGE)showed the presence of two active bands with apparent molecular weight of 49ku and 50ku.Under native isoelectric focusing(IEF),two bands existed in the acidic range with the pI of 5.7 and 5.8 both in soluble and membrane-bound tissues.A band with the isoelectric point(pI)of 5.4 was also found in membrane-bound tissues.No active band was obtained in soluble tissues of PPO.Only two kinds of antibodies were distinguished with western blotting in the three isoenzymes of membrane-bound PPO.A totally denatured SDS-PAGE and western blotting indicated the presence of a single polypeptide with a molecular weight of 60ku.
Feicheng peach;fruit;polyphenol oxidase;enzymtic characteristics
TS255.3
A
1002-0306(2015)04-0132-05
10.13386/j.issn1002-0306.2015.04.019
2014-06-09
王娟(1977-),女,博士,副教授,研究方向:园林园艺植物生物技术。
