丙氨酰-谷氨酰胺对断奶仔猪小肠黏膜固有层免疫球蛋白A浆细胞数量、分泌型免疫球蛋白A及黏膜中白细胞介素含量的影响
2015-12-20叶亚玲王自蕊游金明邓宸玺辛向荣
叶亚玲 王自蕊 游金明 邓宸玺 辛向荣
(江西农业大学江西省动物营养重点实验室,南昌 330045)
断奶时期是仔猪由被动免疫向主动免疫的过渡阶段,也是仔猪免疫功能的调节时期。3周龄左右断奶的仔猪,其免疫功能尚不完善,产生的主动免疫水平较低,抗病力较弱[1]。仔猪本身的免疫水平决定了机体的健康状况和药物使用情况,并间接影响着猪肉产品的质量与安全。因此,从源头上调节仔猪的免疫系统,提高仔猪的免疫力是解决上述问题的关键。研究表明,适量补充谷氨酰胺(glutamine,Gln)能有效提高仔猪的免疫力,缓解仔猪的断奶应激[2-5]。小肠是机体最大的免疫器官,小肠黏膜在仔猪局部免疫中发挥着重要的防御作用。Gln作为仔猪的一种条件性必需氨基酸[6],可为小肠黏膜的细胞分化提供能量和氮源,进而促进受损肠黏膜的修复以及维持正常的局部免疫功能[7-9]。但由于断奶中断了仔猪获得母源性Gln,加上自身合成谷氨酰胺的能力有限,仔猪往往容易缺乏Gln。因此,外源性地添加Gln对缓解仔猪断奶应激,增强断奶仔猪免疫功能具有十分重要的意义。小肠黏膜固有层免疫球蛋白A(IgA)浆细胞数量、分泌型免疫球蛋白A(SIgA)及黏膜中白细胞介素含量是反映仔猪免疫水平的重要指标。因此,本试验通过在断奶仔猪饲粮中添加不同水平的丙氨酰-谷氨酰胺(Ala-Gln),观察Ala-Gln对仔猪肠道黏膜固有层IgA浆细胞数量、SIgA及白细胞介素含量等黏膜免疫指标的影响,为指导Ala-Gln在仔猪饲粮中的科学利用提供理论依据。
1 材料与方法
1.1 试验材料
试验用Ala-Gln购自上海超强化工有限公司,分子式为C8H15N3O4,相对分子质量为217.22,纯度≥99.0%。
1.2 动物分组
根据遗传背景和体重相近原则,选用100头(6.7±0.9)kg、(21±2)日龄断奶的长白×大白仔猪,按完全随机区组设计分为4个组,每组5个重复,每个重复5头仔猪。
1.3 饲粮设计与饲养管理
对照组仔猪饲喂玉米-豆粕型基础饲粮,其他各组分别饲喂在基础饲粮中添加0.15%、0.30%、0.45%Ala-Gln的试验饲粮。基础饲粮参考NRC(2012)和我国猪饲养标准(2004)推荐的猪营养需要进行配制。基础饲粮组成及营养水平见表1。
试验在正邦集团某原种猪场进行。仔猪饲养于装有高床、漏缝地板、不锈钢可调式料槽、乳头式饮水器的保育舍。每日饲喂4次(07:30、11:30、15:30、19:30),自由采食和饮水。其他饲养管理、免疫措施按猪场的常规程序执行。试验期为21 d。
1.4 样品采集与制备
于试验第7、14、21天早晨,从每个重复中选取1头接近平均体重的仔猪进行屠宰,打开胸腔,分别在十二指肠、空肠、回肠中段剪取3 cm肠段,用生理盐水小心冲去食糜,置于10%中性甲醛溶液中固定。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
另剪取15 cm空肠,轻轻挤去食糜,用4℃去离子水冲洗。纵向剪开肠壁,在表面皿中展开,滤纸吸水后用载玻片轻轻刮取肠黏膜,装于无菌冻存管内,立即放入液氮中速冻,然后转入-80℃超低温冰箱中冻存。准确称取1 g左右的黏膜,按1∶9质量体积比加入生理盐水,使用电动匀浆器将黏膜冰浴匀浆,制成悬浮液,然后置冷冻离心机中3 000×g离心10 min(4℃)。分离上清液,即为10%的黏膜匀浆液。
1.5 测定指标及方法
1.5.1 小肠黏膜固有层IgA浆细胞数量
1.5.1.1 常规石蜡切片制作
将固定好的十二指肠、空肠、回肠组织块修整为适当大小,经常规脱水、透明、石蜡包埋、切片、展片、贴片后,置于37℃的恒温箱内烤干,以备染色。
1.5.1.2 小肠 IgA 浆细胞数量
小肠IgA浆细胞数量采用二步聚合物免疫组化法进行检测。步骤如下:
①将烘干后的切片经二甲苯脱蜡,从高浓度酒精到低浓度酒精逐级复水(100%2次、95%、90%、80%、70%、60%)。之后再用蒸馏水洗 5~10 min。
② 将切片置于已加热至沸腾的0.01 mol/L柠檬酸钠缓冲液(pH=6.0)中,保持沸水浴15 min以修复抗原。取出切片,冷却至室温,吸干。
③ 滴加3%H2O2去离子水,孵育10 min,以阻断内源性过氧化物酶活性。甩干切片,用磷酸盐(PBS)缓冲液冲洗3次,每次2 min。
④ 滴加一抗——羊抗猪SlgA抗体(bethyl laboratories)。使用时用抗体稀释液做适当的稀释,最终工作液浓度为1∶200),切片放入湿盒中,37℃孵育3 h。阴性对照组用PBS代替一抗。PBS缓冲液冲洗3次,每次3 min。
⑤ 滴加试剂1(polymer helper),室温孵育10~20 min,PBS缓冲液冲洗3次,每次3 min。
⑥ 滴加试剂2(poly-HRP anti-goat IgG),室温孵育 10~20 min,PBS缓冲液冲洗 3次,每次3 min。
⑦应用二氨基联苯胺(DAB)溶液避光显色10 min。
⑧自来水充分冲洗,终止显色。
⑨ 苏木紫复染1 min,自来水冲洗10 min。醇酸分色30 s,自来水洗净,PBS冲洗10 min。
⑩ 酒精梯度脱水,二甲苯透明8 min,封片。
采用江南BM2000光学显微镜观察,在相同放大倍数下随机选择10个视野拍照。Image Pro Plus 6.0软件计数浆细胞数量,计算平均值。
1.5.2 小肠黏膜SIgA 含量
取10%的黏膜匀浆液,利用SIgA酶联免疫试剂盒(上海博古生物科技有限公司)采用生物素双抗体夹心酶联免疫吸附测定(ELISA)法测定小肠黏膜中SIgA的含量。向预先包被了猪SIgA单克隆抗体的酶标孔中加入目的蛋白,温育。加入生物素标记的抗SIgA抗体,再与链霉亲和素-辣根过氧化物酶(HRP)结合,形成免疫复合体,再经过温育和洗涤,去除未结合的酶,然后加入底物工作液显色,最后加入终止液终止反应。用酶标仪在450 nm波长下测定样品孔和标准孔的吸光度(OD)值,通过标准曲线计算出对应样品中SIgA含量。
1.5.3 小肠黏膜白细胞介素含量
取10%的黏膜匀浆液,采用125I放射免疫试剂盒测定小肠黏膜中的白细胞介素2(interleukin-2,IL-2)、白细胞介素 5(interleukin-5,IL-5)、白细胞介素6(interleukin-6,IL-6)、白细胞介素10(interleukin-10,IL-10)含量。试剂盒均购自上海博古生物科技有限公司,严格按照试剂盒说明书进行操作。
1.6 数据处理与统计分析
所有试验数据采用SPSS 17.0统计软件进行单因素方差分析,F检验组间差异显著者再进行Duncan氏法多重比较,以分析不同水平的Ala-Gln对断奶仔猪小肠黏膜固有层IgA浆细胞数量、SIgA及黏膜中白细胞介素含量的影响。P<0.05为差异显著判断标准,P<0.01为差异极显著判断标准。
2 结果与分析
2.1 Ala-Gln对断奶仔猪小肠固有层IgA浆细胞数量的影响
表2数据显示,与对照组相比,饲粮添加0.15%~0.45%Ala-Gln 能够显著增加仔猪断奶后第7、14、21天十二指肠以及空肠中固有层IgA浆细胞数量(P<0.05),尤其是 0.30%Ala-Gln 组仔猪在断奶第14天空肠IgA浆细胞数量比对照组显著增加了 22.6%(P<0.05)。在回肠中,0.30%Ala-Gln组显著提高了仔猪断奶后第7、14天IgA浆细胞数量(P<0.05),而其他组与对照组相比差异不显著(P>0.05)。
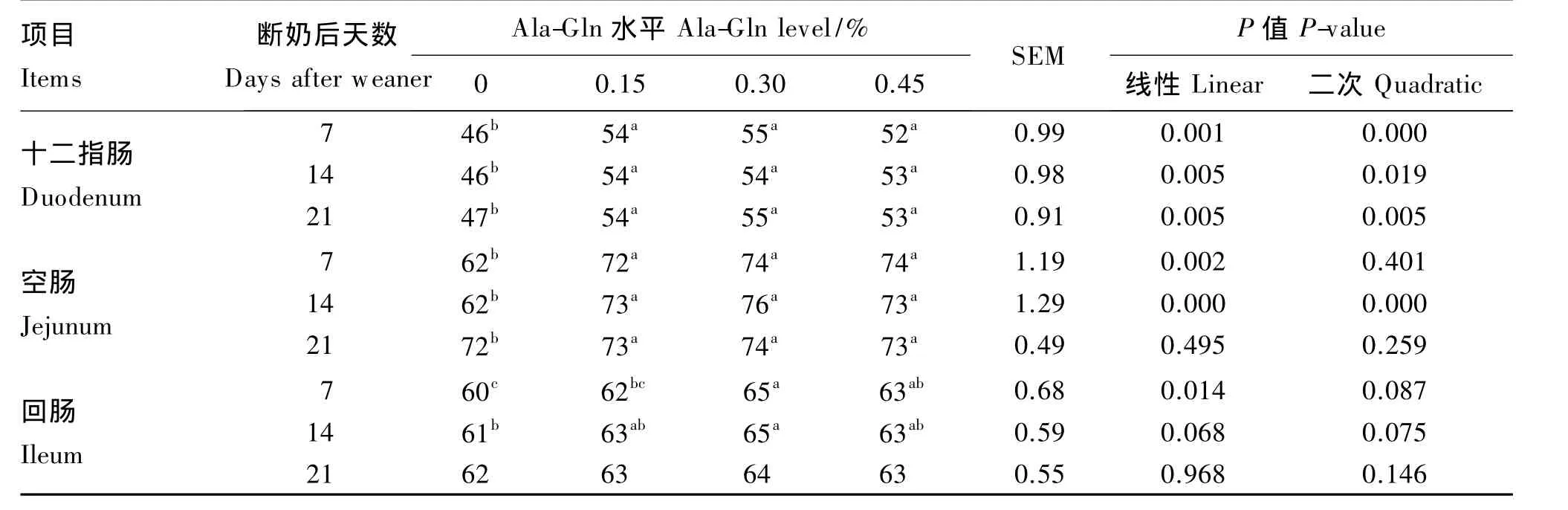
表2 Ala-Gln对断奶仔猪小肠固有层IgA浆细胞数量的影响Table 2 Effects of Ala-Gln on the numuber of SIgA plasma cells in gut lamina propria of weaner piglets
2.2 Ala-Gln对断奶仔猪空肠黏膜SIgA含量的影响
表3数据显示,仔猪断奶后第7天,空肠黏膜中SIgA的含量随Ala-Gln添加量的增加呈现明显的二次曲线变化规律(P=0.000,R2=0.962)。其中,0.30%Ala-Gln 组 SIgA 含量达 0.167 g/L,比对照组提高 70.4%(P<0.01),而 0.15%、0.45%Ala-Gln组与对照组之间差异不显著(P>0.05)。仔猪断奶后第14天,空肠黏膜SIgA含量变化规律也呈二次曲线变化规律(P=0.001,R2=0.913),其中 0.15%、0.30%Ala-Gln组与对照组相比分别提高了 34.9%、64.1%(P<0.05),但 0.45%Ala-Gln组SIgA含量与对照组差异不显著(P>0.05)。仔猪断奶后第21天,空肠黏膜SIgA含量变化与第14天相似。
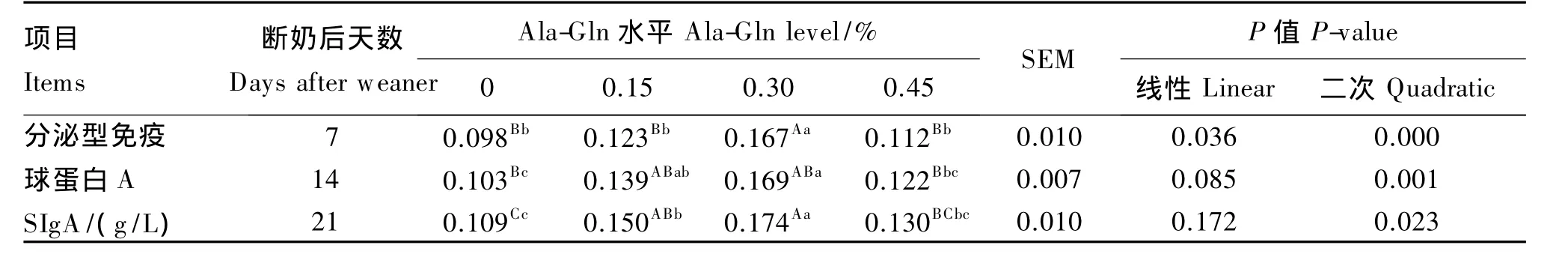
表3 Ala-Gln对断奶仔猪空肠黏膜SIgA含量的影响Table 3 Effects of Ala-Gln on concentration of SIgA in jejunum mucous of weaner piglets
2.3 Ala-Gln对断奶仔猪小肠黏膜白细胞介素含量的影响
表4数据显示,饲粮中添加Ala-Gln能够提高仔猪断奶后小肠黏膜白细胞介素的含量,有助于仔猪的肠道健康。与对照组相比,在断奶后第7天,0.15% ~0.30%Ala-Gln 组能够显著提高仔猪小肠黏膜中 IL-2、IL-5、IL-6、IL-10 含量(P<0.05);IL-2、IL-5含量随着 Ala-Gln的添加量呈现先升高后降低的二次曲线变化规律,而IL-6、IL-10含量则呈线性升高变化。与对照组相比,在断奶后第 14天,0.15%Ala-Gln组均使 IL-2、IL-5含量得到显著提高(P<0.05);各 Ala-Gln组均显著提高 IL-6、IL-10 含量(P<0.05)。与对照组相比,在断奶后第21天,各Ala-Gln组均显著提高IL-2、IL-6、IL-10含量,而对IL-5含量无显著影响(P>0.05)。
3 讨论
3.1 Ala-Gln对断奶仔猪小肠固有层 IgA浆细胞数量及SIgA含量的影响
给早期断奶仔猪补充适量的Ala-Gln能有效防止断奶应激并提高其生产性能。席鹏彬等[10]研究表明,饲粮中添加0.125%和0.250%Ala-Gln可显著降低“杜×大×长”断奶仔猪的料重比,并提高饲料利用率。黄冠庆等[11]在给21日龄断奶仔猪饲粮中添加 0.10%、0.30%Ala-Gln 后发现,仔猪的平均日增重和饲料转化率显著提高。本研究小组在前期的研究中也获得了相似的结果,即饲料中添加0.30%Ala-Gln后,21~35日龄仔猪日增重显著提高,当Ala-Gln添加量由0.15%提高到0.45%时,21~28日龄、29~35日龄、36~42日龄仔猪的腹泻率和腹泻指数呈线性降低趋势[12]。Ala-Gln对断奶仔猪的促生长作用源于其对仔猪小肠的保护作用。小肠被认为是动物体内最大的免疫器官,肠黏膜在小肠局部免疫中发挥着重要的防御功能。小肠黏膜固有层是机体肠道发挥免疫应答的主要场所,而SIgA是免疫应答的重要效应分子。当机体感受来自抗原的刺激时,将分泌大量的IgA。SIgA通过特殊的空间构象或与黏液混合阻断病原体粘附在黏膜表层,从而发挥其免疫防御作用[13]。
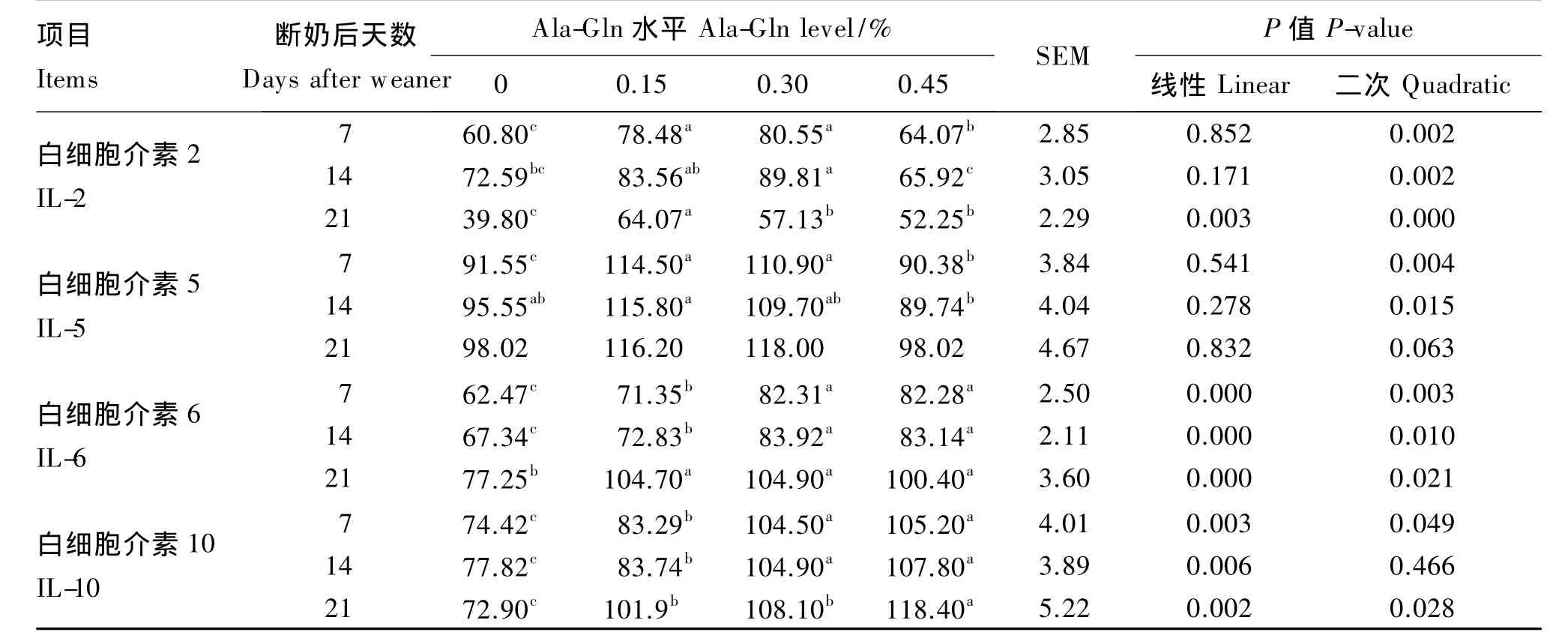
表4 Ala-Gln对断奶仔猪小肠黏膜白细胞介素含量的影响Table 4 Effects of Ala-Gln on the content of interleukin in gut lamina propria of weaner pigs pg/mL
Gln是小肠代谢的主要供能物质[7]。早期断奶仔猪通过饲粮摄入的Gln很少,加之自身合成不足,肠黏膜结构损伤,免疫细胞的增殖下降,这在很多研究中都得到了证实[14-16]。本试验研究发现,Ala-Gln能够缓解因断奶应激造成的小肠SlgA浆细胞分布的减少。添加0.15%~0.45%Ala-Gln均显著提高仔猪断奶后第7、14、21天十二指肠以及空肠黏膜固有层IgA浆细胞数量。同时,仔猪空肠黏膜SIgA含量随着Ala-Gln添加量的增加呈二次曲线增长规律。
Ala-Gln可能是因向肠黏膜固有层免疫细胞提供能量来源和代谢前体,进而影响浆细胞的数量分布及SIgA的分泌量。研究表明,适量的Ala-Gln在全胃肠外营养(TPN)中可增加大鼠小肠黏膜上皮细胞的DNA含量,促进肠上皮细胞的复制和分裂[17-18]。对于断奶仔猪,则可以提高肠上皮细胞和肠系淋巴细胞的增殖[19]。由于SIgA是由浆细胞合成分泌,浆细胞数量的变化必然会影响SIgA的分泌量,进而影响机体对外来抗原的抵抗力。
本试验同时表明,仔猪肠黏膜SIgA含量随Ala-Gln添加量的增加呈先升后降二次曲线变化规律。当Ala-Gln添加量达到0.45%时,SIgA含量恢复到与对照组一样的水平。出现这一结果,可能是由于过高剂量的Ala-Gln进入机体后大量水解成氨基酸单体的缘故。周玉香等[20]研究发现,颈静脉灌注中等水平Ala-Gln(每千克体重0.68 g/d),连续灌注7 d,可有效提高早期断奶犊牛骨骼肌蛋白质的水平、空肠黏膜DNA含量及骨骼肌和空肠黏膜RNA含量。但对Gln需要量有一定的限度,过量补充只能造成Gln的分解代谢。当然,本研究结果也可能与仔猪获得了免疫耐受有关。
3.2 Ala-Gln对断奶仔猪小肠黏膜中白细胞介素含量的影响
白细胞介素作为免疫系统中的重要信息分子,在免疫调节中扮演着十分关键的角色。抗原特异性B细胞迁移成熟分化为IgA浆细胞,产生SIgA,这一过程需要白细胞介素的参与。IL-2是活化T淋巴细胞产生的一种多肽类免疫调节因子,可促进T、B淋巴细胞的增殖分化和特异性抗体的产生,并最终促进IgA介导的有效免疫应答及 SIgA 的有效增加[21]。IL-5、IL-6及 IL-10 可以增强IgA的分泌,促进IgA定向性B细胞的分裂,对浆细胞在黏膜效应位点的定位、终末分化、增生及增强IgA的反应起关键作用[22-24]。大量研究表明,早期断奶应激易引起仔猪体液免疫和细胞免疫水平下降,并导致肠道炎症反应。肠上皮细胞产生的多种白细胞介素(如 IL-1、IL-2、IL-6、IL-10)参与了肠道的炎症反应[25]。而且肠黏膜固有层T淋巴细胞及其合成分泌的IL-2、IL-5、IL-6等构成了固有层IgA阳性及细胞微环境[26]。应激使得仔猪肠上皮细胞促炎因子IL-1含量增加,而抗炎因子 IL-10 快速下降[27]。Fukatsu 等[28]和Yassad-Wozniak等[29]在 TPN中给予谷氨酰胺后发现,肠道相关淋巴组织细胞因子维持正常水平,因传统TPN减少的小肠IgA及小肠匀浆上清液中辅助性T细胞Th2、IL-10含量显著提高。俞开敏[30]在IL-5及嗜酸性粒细胞对人肠黏膜损伤的研究也发现,IL-5可延长嗜酸性粒细胞存活时间,促进对牙囊原虫的免疫应答,当原虫刺激人体时,IL-5会迅速合成并作出应答。刘涛[31]研究表明,仔猪断奶后第5天,小肠黏膜IL-6基因表达量显著下降,断奶后第11天恢复到断奶前水平。本试验结果显示,饲粮中添加 0.15%、0.30%Ala-Gln后,仔猪断奶第7、14天 IL-2、IL-5的含量获得显著提高。Ala-Gln同时还显著提高了各组仔猪IL-6、IL-10的含量。这一结果表明,Gln可通过影响炎症因子和白细胞介素,调节机体免疫功能。
4 结论
饲粮中添加Ala-Gln可提高断奶仔猪断奶后小肠黏膜固有层IgA浆细胞数量和SIgA的分泌量,在一定程度上提高肠黏膜白细胞介素的含量,增强机体免疫应答,提高断奶仔猪肠道黏膜免疫。
[1] MILLER B G,JAMESPS,SMITH M W,et al.Effect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients[J].The Journal of Agricultural Science,1986,107(3):579-590.
[2] 张军民,王连递,高振川,等.日粮添加谷氨酰胺对早期断奶仔猪抗氧化能力的影响[J].畜牧兽医学报,2002,33(2):105-109.
[3] 刘涛,彭健,周诗其,等.外源性谷氨酰胺和谷氨酸对早期断奶仔猪肠粘膜形态、结构和小肠吸收功能及骨骼肌中DNA、RNA浓度的影响[J].中国兽医学报,2003,23(1):62-65.
[4] 陈静,刘显军,边连全,等.谷氨酰胺对早期断奶仔猪生长性能和免疫性能的影响[J].西北农业学报,2006,15(4):58-62.
[5] WU G Y,MEIER S A,KNABE D A.Dietary glutamine supplementation prevents jejunal atrophy in weaner pigs[J].The Journal of Nutrition,1996,126(10):2578-2584.
[6] FLÄRING U B,ROOYACKERS O E,WERNERMAN J,et al.Glutamine attenuates post-traumatic glutathione depletion in human muscle[J].Clinical Science,2003,104(3):275-282.
[7] NEWSHOLME E A,CRABTREE B,ARDAWI M S M.The role of high rates of glycolysis and glutamine utilization in rapidly dividing cells[J].Bioscience Reports,1985,5(5):393-400.
[8] TREMEL H,KIENLE B,WEILEMANN S L.Glutamine dipeptide-supplemented parenteral nutrition maintains intestinal function in the critically Ⅲ[J].Gastroenterology,1994,107(6):1595-1601.
[9] 席鹏彬,林映才,蒋宗勇,等.谷氨酰胺二肽对断奶仔猪生长、免疫、抗氧化力和小肠粘膜形态的影响[J].动物营养学报,2007,19(2):135-141.
[10] 席鹏彬,林映才,朱选,等.谷氨酰胺二肽对断奶仔猪生长性能、细胞免疫及血液生化指标的影响[J].畜牧兽医学报,2005,36(9):900-905.
[11] 黄冠庆,林红英.丙氨酰谷氨酰胺对断奶仔猪生长性能及血清生化指标的影响[J].中国农学通报,2009,25(2):9-12.
[12] 邓宸玺.Ala-Gln对断奶仔猪小肠黏膜屏障功能和吸收功能的调控作用[D].硕士学位论文.南昌:江西农业大学,2013.
[13] GEBERT A,GÖKE M,ROTHKÖTTER H J,et al.The Mechanisms of antigen uptake in the small and large intestines:the roll of the M cells for the initiation of immune responses[J].Zeitschrift Für Gastroenterologie,2000,38(10):855-872.
[14] HAMPSON D J.Alterations in piglet small intestinal structure at weaning[J].Research in Veterinary Science,1986,40(1):32-40.
[15] REEDS P J,BURRI D G,STOLL B,et al.Intestinal glutamate metabolism[J].The Journal of Nutrition,2000,130(4):978S-982S.
[16] TANG M,LAARVELD B,VAN KESSEL A G,et al.Effect of segregated early weaning on postweaning small intestinal development in pigs[J].Journal of Animal Science,1999,77(12):3191-3200.
[17] 陈恒灿,马黎,陈克嶙,等.丙氨酰谷氨酰胺二肽对早期断奶仔猪抗氧化能力及肠道保护的研究[J].畜牧兽医学报,2011,42(2):251-259.
[18] 赵元珍,高春芳.谷氨酰胺二肽胃肠外营养对短肠大鼠小肠上皮细胞的增殖作用[J].实用医学杂志,2003,20(7):520-522.
[19] 周荣艳,彭健.谷氨酰胺和丙氨酰谷氨酰胺对早期断奶仔猪肠上皮细胞增殖和肠道免疫的影响[C]//中国畜牧兽医学会动物营养学分会——第九届学术研讨会论文集.北京:中国畜牧兽医学会,2004:20.
[20] 周玉香,张培松,卢德勋,等.谷氨酰胺对犊牛骨骼肌和小肠黏膜蛋白质及其DNA和RNA含量的影响[J].畜牧与兽医,2010,42(1):17-20.
[21] 张源淑,邓艳,宋晓丹,等.酪啡肽及其酪蛋白水解肽对早期断奶仔猪分泌型免疫球蛋白A和细胞因子水平的影响[J].动物营养学报,2008,20(2):196-199.
[22] 李伟,陈庆森.肠道黏膜免疫屏障及其菌群与机体健康关系的研究进展[J].食品科学,2008,29(10):649-655.
[23] 马玉龙,许梓荣.肠道黏膜免疫研究进展[J].中国畜牧兽医,2004,31(2):27-29.
[24] JONES S A,HORIUCHI S,TOPLEY N,et al.The soluble interleukin 6 receptor:mechanisms of production and implications in disease[J].The FASEB Journal,2001,15(1):43-58.
[25] JIANG Y,MCGEE D W.Regulation of human lymphocyte IL-4 secretion by intestinal epithelial cell-derived interleukin-7 and transforming growth factor-β[J].Clinical Immunology and Immunopathology,1998,88(3):287-296.
[26] 陈静,刘显军,边连全,等.仔猪免疫系统的建立及早期断奶对仔猪免疫功能的影响研究[J].吉林农业科学,2011,36(1):35-40.
[27] 杨家军.早期断奶仔猪肠上皮细胞氧化与损伤及二氢杨梅素对其调控作用[D].博士学位论文.北京:中国农业科学院,2012.
[28] FUKATSU K,KUDSK K A,ZARZAUR B L.TPN decreases IL-4 and IL-10 mRNA expression in lipopolysaccharide stimulated intestinal lamina propria cells but glutamine supplementation preserves the expression[J].Shock,2001,15(4):318-322.
[29] YASSAD-WOZNIAK A,HUSSON A,LAVOINNE A.Glutamine-induced cell swelling is not involved in the stimulatory effect of glutamine on cytokine production in rat peritoneal macrophages[J].Cytokine,2000,12(11):1720-1722.
[30] 俞开敏.IL-5及嗜酸粒细胞与人芽囊原虫病患者肠黏膜损伤关系的探讨[J].中国病原生物学杂志,2011,6(5):351-360.
[31] 刘涛.谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].博士学位论文.武汉:华中农业大学,2002.
