制取甲烷的最佳反应温度探究
2015-12-19阙荣辉李嵌吴凤兮熊言林
阙荣辉+李嵌+吴凤兮+熊言林

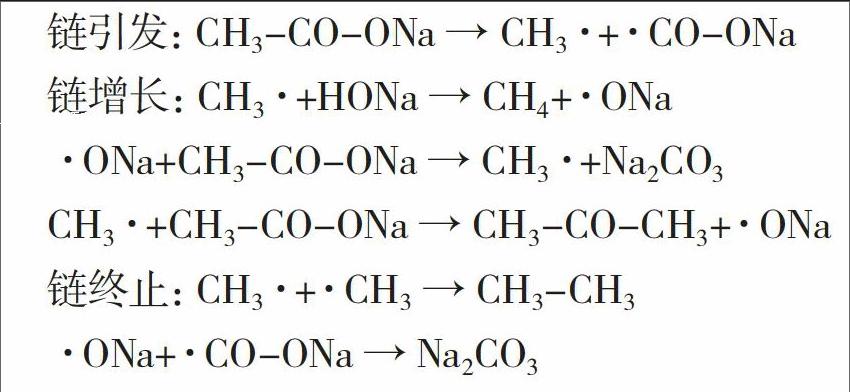
摘要:针对制取甲烷的传统实验方法存在的不足进行了实验探究。2.5g的反应混合物,用高温热电偶传感器直接探测实时反应温度,通过记录反应的温度变化曲线和反应的产气速率确定反应的最佳温度。实验结果表明,采用反应物配比为无水醋酸钠:碱石灰:氢氧化钠=2:1:1时,反应产生气体的最佳温度在500℃上下,整个气体制备过程约5min左右。本实验温度探测、数据记录直接,用时短,实验结果可靠性强。能指导并帮助教师和学生方便有效地制备甲烷气体并进行甲烷的性质实验。
关键词:甲烷;制取;反应温度;热电偶;传感器
文章编号:1005-6629(2015)11-0059-04 中图分类号:G633.8 文献标识码:B
甲烷作为最简单的有机化合物,是中学生认识有机化合物的起点,因而,其制备和性质教学在中学化学教学中具有重要意义。传统实验方法采用无水醋酸钠与碱石灰以1:3混合,反应速度慢,产气率低,副产物多且容易失败。国内研究者对于反应物配比、实验装置的优化、催化剂的选择、副反应的影响等进行了多次探究,但都未对甲烷制备反应的最佳温度进行深入探讨。在有机化学反应中,温度是非常重要的条件,也是实验过程中不易控制的。而且,固体反应物温度实时探测和气体产生速率确定的困难也是鲜有人探究的重要原因之一。鉴于此,本文将使用高温热电偶传感器直接探测反应的实时温度,有效消除了反应时加热强度不易控制带来的影响;通过收集反应产生的甲烷气体速率与反应温度的变化曲线确定甲烷制备的最佳反应温度。为甲烷制备与性质实验提供指导与帮助,以期获得理想的实验教学效果。
1 反应物准备与实验仪器选择
1.1反应物的准备
总结国内一些研究者的研究结果可以归纳出以下影响实验成功的因素:
(1)市售碱石灰的成分氢氧化钠的含量较低不适合本实验;
(2)适量的反应物比例才能促进反应进行;
(3)实验的副反应生成了丙酮,影响甲烷的性质实验;
(4)实验的碱石灰和无水醋酸钠不干燥,影响了甲烷的制备;
(5)加热方式、副产物的冷凝、碱在强热下腐蚀玻璃易导致试管的炸裂;
(6)使用铝箔小舟装载反应物可以防止碱与试管直接接触导致试管损坏。
根据以上因素分析,本实验结合优秀的研究成果给出最佳的反应物配比,无水醋酸钠:碱石灰:氢氧化钠=2:1:1,碱石灰使用前在蒸发皿内由浅红色灼烧至灰白色,再先后与无水醋酸钠、氢氧化钠一起混合,研磨后备用。
1.2实验条件及热源的选择
甲烷制备反应原理为:
碱石灰中的生石灰CaO起到了干燥剂和使反应物疏松甲烷易于逸出的作用。关于甲烷制备的反应机理有两种理解,一种认为反应为离子型反应,甲基碳负离子夺取水中的氢生成甲烷;另一种认为反应为游离基反应。
无论哪种机理都需要将反应物加热至熔融状态,且反应体系中须尽可能要保持无水状态才能使反应顺利进行。
1.2.1最佳反应温度推测
无水醋酸钠的熔点为324℃,氢氧化钠的熔点为327.6℃,基于以上分析估计反应在温度达到二者熔点之后才开始进行。该反应是吸热反应,当反应物达到熔融状态之后仍需要加热。随着温度的上升,反应速度加快,产生的气体增多,直到反应结束。
由上面推测可知,反应开始的温度应该在330℃以上,反应温度较高,通过沙浴、油浴加热已不能满足实验需要;若改用控温效果好的马沸炉却不能收集反应产生的气体,反应体系的实时温度也不易探测;改用酒精喷灯则温度过高,试管不能承受。最后选择酒精灯作为加热源,这更接近教师实验教学时的反应环境,希望所得的实验结果能帮助教师在教学过程中更好地完成实验。
1.2.2高温热电偶传感器校验
在室温为15.8℃时,使用高温热电偶温度传感器测试沸腾的水的温度,两次分别显示稳定在99.0℃和99.1℃。说明传感器测试正常。
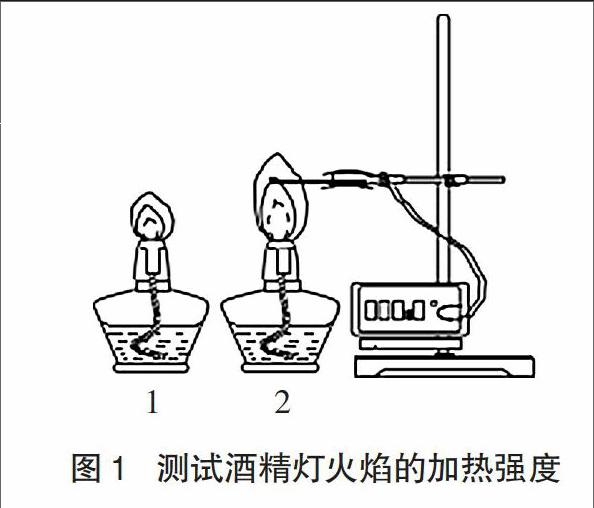
1.2.3酒精灯加热强度讨论
实验中用到以下两个酒精灯,1号酒精灯灯芯比较细短,火焰比较小;2号酒精灯灯芯比较粗长,火焰比较大。分别用高温热电偶传感器探测两个酒精灯的外焰温度,见图1。发现两个酒精灯的外焰加热温度都能达到850℃左右,1号酒精灯由室温加热到850℃平均用时约11秒左右,而2号酒精灯需要约7秒。2号酒精灯的加热强度略高于1号酒精灯。实验中将讨论加热强度不同时对甲烷制备实验产生的影响。
1.3实验仪器与装置
反应装置中使用铝箔槽防止试管破裂。将高温热电偶埋人平铺在铝箔槽(小舟)上的反应混合物中,另一端连接数据采集器以探测实时反应的温度,气体的收集用排水集气法收集于倒扣在水槽中的500mL大量筒中,实验装置见图2。
2 实验步骤和现象
2.1排除实验中可能出现的铝箔与氢氧化钠反应
铝在氢氧化钠溶液中能发生剧烈的反应:2AI+2NaOH+2H2O=2NaAlO2+3H2↑。为了排除该反应的影响进行如下表1实验。
实验用的碱石灰全部都由浅红色块状研磨成粉末后灼烧至灰白色,反应物按照无水醋酸钠:碱石灰:氢氧化钠=2:1:1的比例混合,经由同一个酒精灯加热。
比较反应后实验1和实验4的铝箔小舟发现两者基本保持原有的金属光泽,没有受到腐蚀。实验1的反应物结块成一体,实验4的反应物基本保持在反应前的粉末状,仅有少量结块。在实验4加热后的小舟和反应物中滴加少量水,立即发生剧烈反应,铝箔小舟被腐蚀放出大量气泡和热量,反应最后铝箔小舟被严重腐蚀,表面也失去金属光泽呈灰黑色。
由实验1、2、3、4可知:
(1)在反应体系无水情况下即使加热到400℃,氢氧化钠与铝箔也不发生反应,可以排除铝箔小舟与混合物中氢氧化钠发生反应的可能。
(2)甲烷的制备反应在350℃左右开始有气体生成,是否与反应物的质量和加热源的强弱有关还需要进一步的实验验证。
2.2甲烷制备反应温度随时间变化的探究
针对上一组实验中存在的问题,进行了第二组对比实验,见表2。反应物配比等同上。
实验5、6、7分别用不同质量的反应物和不同加热强度的酒精灯来进行实验,并记录反应温度在200℃之后到反应结束不再产生气体这段时间内变化,然后绘制温度随时间变化的曲线,见图3。
根据以上实验结果可知:
(1)实验选择酒精灯加热强度不同,会影响反应的总时间和反应速度的快慢,其中热源加热强度越大,反应体系温度上升越快,气体生成速率越快,反应结束越早;
(2)反应物质质量的多少会影响反应的总时间,反应物质质量越多需要的反应时间越长,反应的总时间受到热源和反应物质质量多少的共同影响;
(3)反应的热源加热强度不会影响反应发生开始产生气体的温度与结束温度,反应物质质量的多少也不会改变反应的开始与结束温度。通过数据采集器的记录可知开始产生气体的温度在350℃左右,反应结束的温度在510℃左右。
2.3
甲烷制备反应气体生成速率随温度变化的探究
根据以上结果设计了第三组实验,探究不同温度区间气体生成的速率,见表3。
用500mL大量筒收集产生的气体,记录不同温度区间内产生的气体体积和温度区间内经过的时间,其中从开始产生气体到不再产生气体的这段时间记录为反应总时间。计算不同温度区间内反应的气体生成速率并绘制条形统计表见图4。
由实验结果可以看出,在热源加热强度不同和反应物质量不同的条件下,实验开始产生气体温度和实验结束的温度符合前两组实验的结果:即在350℃左右开始产生气体,在510℃左右反应结束。由图4可以看出在不同的温度区间内反应的气体生成速率表现出以下几点规律:
(1)随着温度的上升气体的生成速率逐渐增大,且在440℃之后增大的幅度明显加快,在500℃附近气体生成速率出现了峰值,在出现峰值之后气体生成速率开始下降至反应结束。
(2)实验表明甲烷的气体生成速率与加热强度有关,由图4可见,加热强度大的实验9气体产生速率明显高于实验8的气体产生速率,但两个实验的速率增长趋势相同。
(3)实验8、9同时表现出均匀产气的时间约为120s左右,且在到达500℃气体生成速率峰值之后实验也趋于结束。整个实验的加热时间约在五分钟左右,时间较短适合在课堂进行演示实验。
3 实验结果与讨论
3.1实验结果
从上述系列实验的结果可知:
(1)反应开始产生气体的温度(350℃)和反应结束的温度(510℃)不受热源加热强度和反应物质量多少的影响;
(2)甲烷气体的生成速率与热源的加热强度呈正相关;
(3)甲烷制备过程中均匀产气时间约为120s左右,整个加热制备过程约5min左右。
3.2甲烷制备实验副反应产物的影响
影响实验的副产物主要是乙烷和丙酮。研究表明反应的主要副产物为丙酮(乙烷的量很少),采用排水集气法收集后可以除去。所以实验的副反应产物对甲烷产气速率的影响可以基本排除。
3.3实验结论
甲烷制备实验的最佳条件是:当反应物配比为无水醋酸钠:灼烧除水的碱石灰:氢氧化钠=2:1:1时,试管内使用铝箔小舟装载混合反应物2.5g左右,反应产生气体的最佳温度在500℃左右。
本系列实验利用高温热电偶传感器直接探测反应物的实时温度,突破了固体反应物温度探测的难点。更重要的是,本实验通过反应温度随加热时间的变化曲线和反应产气速率的统计来确定反应最佳温度,有效地保障了实验结果的科学性。该实验结论对于课堂演示或探究甲烷的制备和性质实验过程有很好的指导作用,能够帮助教师和学生更好地完成整个实验,对于甲烷及相关知识的学习起到了有效的促进作用。
