三个牦牛品种(类群)尿苷一磷酸合成酶缺乏症的检测
2015-12-17金素钰蒋忠荣郑玉才
于 淼,金素钰,黄 林,蒋忠荣,刘 曦,郑玉才
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.四川省甘孜州畜牧科学研究所,四川 康定 626000)
三个牦牛品种(类群)尿苷一磷酸合成酶缺乏症的检测
于 淼1,金素钰1,黄 林1,蒋忠荣2,刘 曦2,郑玉才1
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.四川省甘孜州畜牧科学研究所,四川 康定 626000)
检测牦牛中是否存在尿苷一磷酸合成酶缺乏症(DUMPS).实验选取分布于四川省的昌台牦牛、九龙牦牛、麦洼牦牛三个品种(类群)共100头,从血液中提取基因组DNA,采用常规PCR-RFLP技术进行DUMPS的遗传缺陷检测.首先扩增牦牛尿苷一磷酸合成酶基因部分片段,再用限制性内切酶AvaⅠ酶切扩增产物,通过酶切条带数确定牦牛群体中是否存在DUMPS携带者.结果显示,所检测的100头牦牛PCR产物的酶切条带均为3条,为正常纯合子,未发现DUMPS携带者.
牦牛;尿苷一磷酸合成酶缺乏症;PCR-RFLP
尿苷一磷酸合成酶缺乏症(Deficiency of uridine monophosphate synthase,DUMPS)是牛中的一种常染色体遗传缺陷病,为单基因隐性遗传疾病.Schwenger等发现该遗传病杂合子C-末端编码405处氨基酸的密码子存在1个C→T点突变,原编码精氨酸的密码子CGA转变为终止密码子TGA[1].该病携带者因基因突变不能将乳清酸转化为鸟苷酸,瓜氨酸积累引起高氨血症,使致病纯合子犊牛在出生一周内死亡,或者母牛妊娠40 d左右流产[2-3].
由于隐性遗传病的携带者表现正常,因此难以发现.DUMPS发现于荷斯坦牛中,携带该病基因的优质种公牛的精液,因人工授精技术的广泛应用,有可能导致DUMPS病在较大范围内传播.国内已有检测出荷斯坦牛携带DUMPS的报道,而关于牦牛中是否存在DUMPS尚未见报道.牦牛是青藏高原及毗邻高寒地带特有的牛种,是当地牧民重要的生活资料和创造财富的生产资料.研究牦牛种群中是否存在DUMPS,对牦牛的育种和改良等工作具有实际意义.利用PCR -RFLP方法检测DUMPS杂合子,已在美国、欧洲等地广泛使用.该方法对牛的基因型进行分型,简单快速,不受奶牛的年龄、性别等因素影响[4-6].
1 材料与方法
1.1 试验牦牛和样品的采集
选取分布于四川省三个地区的成年健康牦牛(Bos grunniens)100头,其中九龙牦牛40头,昌台牦牛30头,麦洼牦牛30头,分别饲养于九龙县、红原县和白玉县.通过颈静脉采血,用肝素抗凝,冰瓶带回实验室,-80℃保存至分析.
1.2 基因组DNA的提取
TaKaRa DNA提取试剂盒购自宝生物(大连)有限公司,按试剂盒操作指南从全血中提取牦牛基因组DNA.
1.3 尿苷一磷酸合成酶(UMPS)基因的PCR扩增
PCR引物由上海生工生物技术服务有限公司合成,采用Schwenger等设计的引物[7],预期扩增片段长度为108 bp,序列为:UMPS-F:5′-GCAAATGGCTGAAGAACATTCTG-3′,UMPS-R:5′-GCTTCTAACTGAACTCCTCGAGT-3′.用Eppendorf AG 22331 Hamburg PCR仪扩增,PCR扩增体系为25 μL: 2×Taq PCR MasterMix酶12.5 μL,超纯水9.5 μL,上、下游引物各0.8 μL,DNA模板1.4 μL.扩增条件: 94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸5 min.用3%琼脂糖凝胶检测,60 V电泳40 min.
PCR产物通过基因克隆方法测序.用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司生产)对目的条带进行回收,用紫外分光光度计测定回收片段的DNA浓度.pMD©19-T Vector(TaKaRa公司生产)连接目的基因后,转入感受态细胞,在培养基上37℃培养过夜,挑出单一菌落于液体培养基内摇菌培养.菌液送予上海生工公司进行测序.
1.4 酶切分型
酶切反应体系:PCR产物10 μL,Ava I 1 μL,超纯水9 μL,10×buffer 1 μL.混匀后于37℃酶切过夜.酶切产物用4%琼脂糖凝胶检测,50 V电泳50 min.
AvaI酶识别序列位点为5′-CYCGRG-3′,因此荷斯坦牛的PCR扩增序列酶切后分为三种情况:正常纯合子基因型为CC,酶切后得到53 bp、36 bp、19bp共3条带;患病杂合子基因型为CT,酶切后得到89bp、53 bp、36 bp、19 bp共4条带;患病纯合子基因型为TT,酶切后得到89 bp、19 bp两条条带[8].
2 结果与分析
2.1 尿苷一磷酸合成酶基因PCR扩增结果
100头牦牛的基因组DNA经PCR扩增,产物经3%琼脂糖凝胶电泳分离,获得了同预期分子量大小相近的特异性扩增产物(图1).
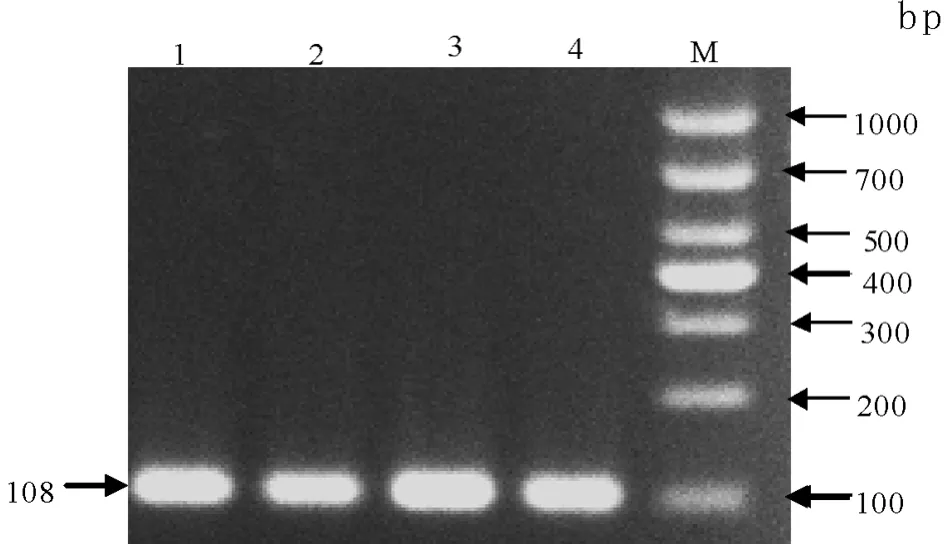
图1 牦牛UMPS基因的PCR扩增产物琼脂糖凝胶电泳泳道1~4为牦牛样品,M为DNA markerFig.1 Agarose gel electrophoresis of PCR products amplifying UMPS gene of yak Lanes 1 to 4:yak samples,M:DNA marker
裁掉克隆测序结果中载体的固有序列,再与上、下游引物进行比对,得到牦牛UMPS基因的部分编码区序列,长度为108 bp,用DNAMAN软件将PCR产物测序结果与荷斯坦牛UMPS基因对比(图2),显示二者相似性为99.07%.其中的1个碱基不同,是在设计引物时将G改为C,从而引入一个酶切位点(CYCGRG),因此,实验所获得的牦牛和荷斯坦牛UMPS基因片段序列是相同的.牦牛与荷斯坦牛的酶切位点是一致的,因此酶切后非患病纯合子为3条带,杂合子为4条带.
2.2 检测分型结果
对三个品种(类群)的100头牦牛的尿苷一磷酸合成酶基因PCR扩增产物进行酶切,凝胶电泳上均显示为3条区带,为正常基因纯合子,未发现DUMPS携带者(图3).
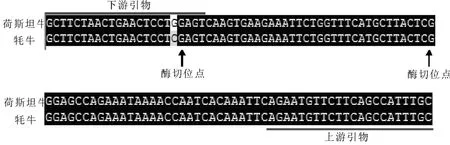
图2 牦牛与荷斯坦牛UMPS基因片段的序列比对Fig.2 Alignment of partial sequence of UMPS gene of yak and Holstein cattle
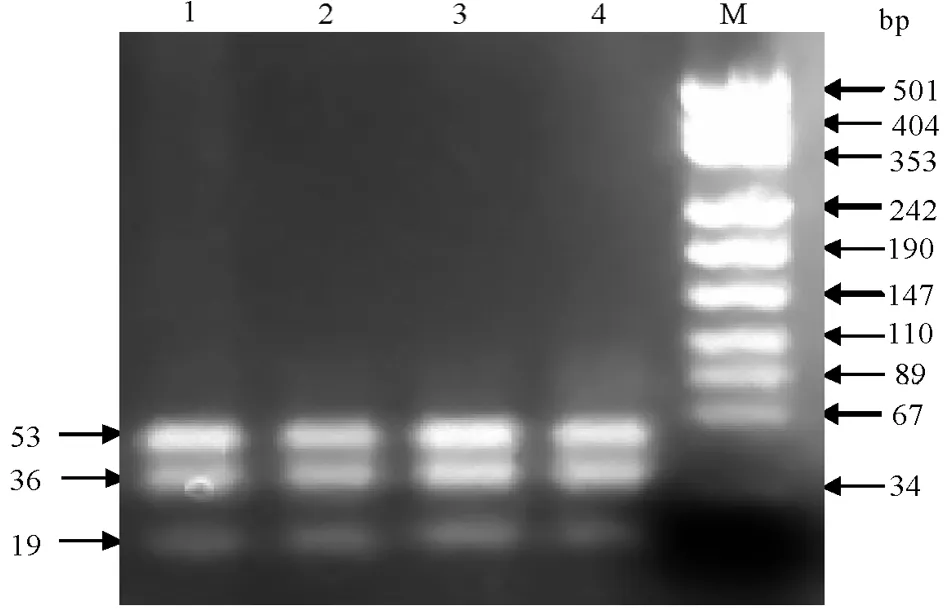
图3 牦牛UMPS基因PCR产物酶切的琼脂糖凝胶电泳图泳道1~4是正常牦牛的条带型,M为DNA markerFig.3 Agrose gelelectrophoresis of enzyme digested PCRproduct amplifying UMPS gene of yak Lanes 1 to 4:band types of normal yaks,M:DNA marker
3 讨论
本研究采用PCR-RFLP方法检测,用PCR扩增出可能出现突变的基因片段,再用特异的内切酶切割,由于存在特定位点的碱基突变产生不同长度,直接用凝胶电泳分型[9].本实验结果表明,用此方法检测牦牛中是否存在DUMPS携带者,方法简便,分型时间短.虽然在3个牦牛品种(类群)中未发现DUMPS携带者,这是值得庆幸的,但也应对该遗传病予以重视.公牛携带者不会表现出症状,若未检测到而用于配种,其隐性有害基因则会在牛群中快速传播,给畜牧业造成很大经济损失.1987年美国公牛Happy-Herd Beautician因为其生产能力排行全美第五,其冻精被广泛用于与各国当地牛的人工授精改良,导致北美洲和欧洲出现很多隐性基因携带者(美国438头、欧洲314头)[10].Jon-Red是上世纪80年代末期美国著名的公牛,其西门塔尔牛后代均携带DUMPS突变基因,在美国和欧洲分别检测到101头和84头[11].国内荷斯坦牛中检测到DUMPS携带者也时常见报道.在台湾1468头荷斯坦牛中检测到2头隐性突变基因携带者[12].谢岩等人检测了全国14个省共计519头荷斯坦公牛冻精样品,发现DUMPS携带者比例为0.17%,且是美国公牛Skokie sensation Ned的后代[13].梁若冰等检测了来自全国27个牛场的691头荷斯坦公牛的血样,共发现1头杂合子母牛[14].
国内外报道的DUMPS发生频率大约在0.2%~2.5%范围内[15],尽管目前没有在牦牛群体中发现该遗传病携带者,但鉴于牦牛的杂交改良在青藏高原牧区的应用,也须注意DUMPS突变基因的检测.牦牛若与荷斯坦牛进行杂交改良,更应注意检测DUMPS携带者.同时,对牦牛DUMPS的检测,应扩大牦牛的品种、数量和分布区范围,尤其是经过种间杂交改良的群体,以确保该遗传病不在牦牛中发生.
[1]SCHWENGER B,SCHOBER S,SIMON D.DUMPS cattle carry a point mutation in the uridine monophosphate synthase gene[J].Genomics,1993,16:241-244.
[2]LEE YK,CHANG KM,NAM IS,et al.Studies on the detections of congenital genetic disorder in Holstein proven and candidate bulls[J]. Anim Sci Tech,2002,44:279-288.
[3]ROBINSON JL,DOMBROWSKI DB,SHANKS RD,et al.Detection and prevalence of UMP synthase deficiency among dariy cattle[J].J Hered,1984,75:227-280.
[4]SHANKS RD,GRENINER MM,DOMBROWSKI DB,et al.Relationshipbetween genetic of Holstein bulls and deficiency of uridine-5`-monophosphate synthase[J].J Dairy Sci,1992,75:2023-2029.
[5]ROBINSON JL,DRABIK MR,DOMBROWSKI DB,et al.Consequences of UMP synthase deficiency in cattle[J].Proc Natl Acad Sci USA,1983,80:321-323.
[6]REZAEE AR,NASSIRY MR,SADEGHI B,et al.Implication of complex vertebral malformation and deficiency of uridine monophosphate synthase on molecular-based testing in the Iranian Holstein bulls population[J].Afr J Biotechnol,2009,8(22):6077-6081.
[7]梁若冰,谢岩,范学华,等.天津地区荷斯坦公牛CVM、DUMPS和CN遗传缺陷检测[J].中国奶牛,2014,1:11-15.
[8]MEYDAN H,YILDIZ MA,AGERHOLM JS.Screening for bovine leukocyte adhesion deficiency,deficiency of uridine monophosphate synthase,complex vertebral malformation,bovine citrullinaemia,and factoe XI deficiency in Holstein cows reared in Turkey[J].Acta Vet Scand,2010,52(1):56-63.
[9]王洪梅,李建斌,侯明海,等.牛瓜氨酸血症、尿苷酸核酶缺乏症PCR-RFLP检测方法的建立及应用[J].中国兽医学报,2009,29 (5):661-664.
[10]ROBINSON JK,POPP RG,SHANKS RD,et al.Testing for deficiency of uridine monophosphate synthase among holstein-friesian cattle of North America and Europe[J].Livest Prod Sci,1993,36:287-298.
[11]KAMINSKI S,GRZYBOWSKI G,PRUSAK B,et al.No incidence of DUMPS carriers in Polish dairy cattle[J].J Appl Genet,2005,46(4): 395-397.
[12]LIN DY,HUANG YC,CHANG HL,et al.DNA typing of inherited deficiency of uridine monophosphate synthase in dairy cattle and beef cattle[J].Chin Soc Anim Sci,2001,30:15-22.
[13]谢岩,范学华,吴晓平,等.中国荷斯坦牛CN和DUMPS遗传缺陷检测及系谱分析[J].畜牧兽医学报,2012,43(3):376-381.
[14]梁若冰,谢岩,范学华,等.中国荷斯坦牛脊椎畸形综合征和尿苷酸合酶缺乏症遗传缺陷检测[J].中国奶牛,2014,7:22-26.
[15]张松,孙东晓,俞英,等.中国荷斯坦牛DUMPS的PCR-RFLP检测[C].第七届全国养牛学分会学术研讨会论文集,2009:40.
(责任编辑:李建忠,付强,张阳,罗敏;英文编辑:周序林,郑玉才)
Detection of deficiency of uridine monophosphate synthase in three yak breeds or population
YU Miao1,JIN Su-yu1,HUANG Lin1,JIANG Zhong-rong2,LIU Xi2,ZHENG Yu-cai1
(1.School of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,P.R.C.;2.Institute of Animal Science and Veterinary Medicine of Ganzi Prefecture,Kangding 626000,P.R.C.)
The aim of the study is to detect the occurence of yaks carrying deficiency of uridine monophosphate synthase (DUMPS).A total of 100 yaks belonging to three breeds or population in Sichuan Province(Changtai yak,Jiulong yak and Maiwa yak)were used,Genomic DNA was extracted from the blood,and PCR-RFLP was employed to screen the possible occurrence of DUMPS.Ava I was used to digest PCR product generated by amplification of genomic DNA using DUMPS specific primers,and the genotypes were visualized according to the sizes of the fragments.The results showed that no carrier of DUMPS was found among the 100 yaks examined,normal homozygous DUMPS allele exhibited three fragments.
yak;deficiency of uridine monophosphate synthase;PCR-RFLP
S823;S852.23
A
2095-4271(2015)04-0403-04
10.11920/xnmdzk.2015.04.002
2015-05-04
郑玉才(1965-),男,内蒙古人,教授,博士,研究方向:高原动物生化与分子遗传;E-mail:yucaizheng@hotmail.com.
国家公益性行业(农业)科研专项(编号:201203010)
