microRNA-449b对高迁移率族蛋白B1介导树突状细胞功能的影响
2015-12-14王勇涛柴艳芬齐安龙姚咏明
王勇涛 董 宁 柴艳芬 于 燕 齐安龙 姚咏明
(1.天津医科大学总医院急诊医学科,天津 300052;2. 解放军总医院第一附属医院全军创伤修复与组织再生重点实验室暨皮肤损伤修复与组织再生北京市重点实验室, 北京 100048)
microRNA-449b对高迁移率族蛋白B1介导树突状细胞功能的影响
王勇涛1董 宁2柴艳芬1于 燕2齐安龙1姚咏明2
(1.天津医科大学总医院急诊医学科,天津 300052;2. 解放军总医院第一附属医院全军创伤修复与组织再生重点实验室暨皮肤损伤修复与组织再生北京市重点实验室, 北京 100048)
目的:探讨miR-449b在高迁移率族蛋白B1(HMGB1)刺激树突状细胞(DC)中的变化及其对DC免疫功能的影响。方法:分别以10、100、1 000 ng/ml剂量的HMGB1刺激小鼠脾脏来源的CD11c+DC,于48 后检测DC表面分子CD80、CD86、MHC-II及细胞内miR-449b改变;流式细胞仪分析不同剂量HMGB1刺激对DC凋亡的影响。DC转染miR-449b模拟物(miR-449b)、抑制物(In-miR-449b)及相应对照(miR-NC、In-miRNC)后,HMGB1(100 ng/ml)刺激48 h收取细胞,检测DC表面分子、凋亡改变以及与T细胞混合培养后T细胞增殖、分化功能的变化。结果:HMGB1刺激DC后,其表面分子随着剂量的增加表达上调,其中以100 ng/ml组上调最为明显,而大剂量(1 000 ng/ml)时表达有所下调;miR-449b 在48 h 100及1 000 ng/ml HMBG1组表达明显上调(P<0.05);随着HMGB1剂量的增加,DC在48 h凋亡逐渐增加(P<0.05)。转染miR-449b可上调其在细胞内表达,而抑制物可抑制其表达;上调miR-449b后HMGB1(100 ng/ml)刺激48 h DC表面分子CD86表达显著上调(P<0.05)、凋亡增加(P<0.01)、对T细胞的共刺激增殖效应减弱、混合性淋巴细胞反应中IL-4水平增多(P<0.01)、IFN-ɣ水平下降(P<0.05)。结论:miR-449b可负性调控HMGB1介导DC免疫功能及促进其凋亡,进而在机体免疫反应障碍过程中发挥调控作用。
miR-449b树突状细胞高迁移率族蛋白B1免疫功能
脓毒症(sepsis)是由感染引起的失控性全身炎症反应及器官功能障碍,并伴有免疫功能紊乱[1-3]。我们新近研究证实,高迁移率族蛋白B1(HMGB1)作为脓毒症重要晚期炎症介质,参与了机体免疫功能紊乱过程,它可导致树突状细胞(DC)表型异常,进而使T细胞的增殖能力减弱、向Th2漂移,并可直接抑制T细胞增殖及促进凋亡[4-5]。微小RNA(microRNA, miRNA)是指长约20~25个核苷酸序列的非编码RNA,其通过形成RNA诱导的静默复合体(miRNA-induced silencing complex, RISC),以碱基互补配对的方式使靶向mRNA降解或翻译抑制来发挥作用[6]。许多资料提示,miRNA在DC的分化、成熟、抗原提呈、细胞因子释放及凋亡方面具有重要调控作用[7]。有学者通过对比未成熟DC(iDC)、成熟DC(mDC)及耐受性DC(tDC)的miRNA表达谱发现,与iDC相比,miR-449b在mDC及tDC中均表达上调[8]。采用钙离子激动剂使Jurkat T细胞内钙离子增多后发现,miR-449b水平明显升高[9]。因此,本实验拟进一步探讨HMGB1刺激DC中miRNA-449b的变化规律及其对DC免疫功能、凋亡的可能影响。
1 材料与方法
1.1实验动物及主要试剂BALB/c雄性小鼠(清洁级),6~8周龄,体重20~22 g,购自中国医学科学院医学实验动物研究所。小鼠脾脏组织淋巴细胞分离液购自天津市灏洋科技有限责任公司,MiniMACS 磁性分离仪、MS柱、抗小鼠DC(CD11c)免疫磁珠、异硫氰酸荧光素(FITC)标记抗小鼠MHCⅡ、别藻青蛋白(APC)标记的小鼠CD80、藻红蛋白(PE)标记CD86均购自德国Miltenyi Biotec公司;PE-cy7标记的抗小鼠CD11c、重组人HMGB1购自美国Sigma公司;PE Annexin V 凋亡试剂盒I 购自美国BD公司;总RNA提取TRIzol 试剂盒及LipofectamineTM2000购自美国Invitrogen公司;Opti-MEM购自美国Gibco公司;miRNA第一链cDNA合成(加尾法)试剂盒购自生工生物工程(上海)股份有限公司;SYBR Green荧光定量试剂盒购自美国AB公司;CCK8检测试剂盒购自美国Sigma公司;小鼠IFN-ɣ、IL-4 ELISA试剂盒购自依科赛生物科技(太仓)有限公司。
1.2HMGB1对DC表面分子表达、DC凋亡及miRNA-449b表达的影响
1.2.1小鼠脾脏来源CD11c+DC的提取颈椎脱臼法处死小鼠后无菌取脾,将脾脏置于预冷的PBS中,按淋巴细胞分离液说明书要求研磨脾脏分离单个核细胞,计数,加入相应体积的CD11c磁珠孵育20 min后,在磁场中过两遍MS柱分选DC,计数,流式分析仪检测其纯度,台盼蓝染色计算细胞活性,采用相应培养基重悬细胞并调整密度为1×106/ml种板进行后续实验。
1.2.2HMGB1对DC表面分子表达及DC凋亡影响的检测提取DC后用10% FCS-RPMI 1640完全培养基以1×106/ml重悬,以每孔400 μl接种于24孔板中,适应性培养8 h后,分别加入含不同浓度HMGB1(10、100、1 000 ng/ml)的100 μl培养基,于48 h收取细胞,按流式抗体说明书要求检测CD80、CD86及MHC-II时效及量效表达情况。检测不同浓度HMGB1刺激DC 48 h后其凋亡情况,收取细胞后冷PBS清洗两次,加入100 μl 结合缓冲液后加入Annexin V和7-AAD各5 μl,常温黑暗孵育15 min,加入400 μl结合缓冲液,1 h内流式细胞仪检测凋亡率。
1.2.3miR-449b在HMGB1刺激DC中的表达变化将3×106个DC加入T25培养瓶中,加入含10%FBS的1640培养基共5 ml置于5%CO2、37 ℃培养箱中培养,然后分别加入不同浓度的HMGB1(10、100、1 000 ng/ml),作用48 h后收取细胞。每3×106个细胞加入1 ml TRIzol,按要求提取总RNA。检测提取的总RNA浓度及纯度,取2 μg用于加尾反转获得microRNA的cDNA。将cDNA稀释50倍,取6 μl进行qPCR检测。miR-449b特异性上游引物由生工生物工程(上海)股份有限公司设计合成,miR-449b上游引物采用ULTRAPAGE纯化,序列为5’-GGCAGGCAGTGTTGTTAGCTGG-3’;miR-449b、U6通用下游引物及U6特异性上游引物由miRNA第一链cDNA合成(加尾法)试剂盒提供。采用荧光染料法(SYBR Green)检测miR-449b量的变化,体系为20 μl分别为mix 10 μl、上下游引物各2 μl(5 μm)及6 μl的cDNA,反应条件为95 ℃ 5 s,40个循环;60 ℃ 60 s,95 ℃ 20 s,保证60~90 ℃溶解曲线为单峰。采用相对定量法以目的基因与内参U6的CT值进行比较。以2-ΔΔCT值(ΔCt=Ctgene-Ctcontrol)计算相对定量表达(RQ)值。
1.3miR-449b对DC表面分子表达、DC凋亡及促使T细胞增殖和极化的检测
1.3.1miR-499b转染及转染效果检测miR-449b模拟物、抑制物以及阴性对照均由吉玛公司设计合成;miR-449b抑制物序列为5’-GCCAGCU AACAACACUGCCU-3’,miR-449b 抑制物阴性对照序列为5’-CAGUACUUUUGUGUAGUA CAA-3’; miR-449b模拟物正义链为5’-AGG CAGUGUUGUUGUUAGCUGGC-3’,反义链为5’-CAGCUAACAACACUGCCUUU-3’;miR-449b阴性对照正义链为5’-UUCUCCGAA CGUGUCACGUTT-3’,反义链为5’-ACGUGA CACGUUCGGAGAATT-3’。用Opti-MEM无血清溶液重悬分离的DC并调整细胞浓度为1×106/ml,以每孔400 μl体积重悬细胞种于24孔板中,置于37 ℃、5%CO2恒温培养箱中适应性培养8 h。取50 μl Opti-MEM无血清培养基加入无酶EP管中,并加入相应浓度的FAM-miRNA混匀静止5 min。同时,取另一个无酶EP管加入50 μl Opti-MEM无血清培养基,再加入相应浓度Lipofectamine 2000 [合成的miR(20 μm)与lip比例为1 ∶ 1]。将两种物质在一个EP管中混匀并室温静止20 min后加入到相应孔板中。培养12 h后收取细胞,冷PBS清洗两次,流式分析仪及荧光显微镜检测转染率,调整Lipofectamine 2000与相应miR量取得最佳转染效率。转染非荧光标记miR-NC、miR-449b、In-miR-NC、In-miR-449b后,收取细胞,qPCR进一步验证转染后miR-449b在DC中的变化。
1.3.2miR-449b对DC表面分子表达及DC凋亡的影响按上述方法取最佳混合比例的Lipofectamine 2000与相应非荧光修饰miRNA加入到24孔板中,培养12 h后取上清300 μl,并加入含15%FBS的培养基,调整最终培养基中HMGB1浓度为100 ng/ml,培养48 h后收取DC,检测表面分子水平及凋亡改变。
1.3.3小鼠CD4+T细胞的分选及纯度、活性检测分离小鼠单个核细胞后,采用CD4+T细胞分选试剂盒分选CD4+T细胞,流式分析仪检测CD4+T细胞纯度,用台盼蓝染色检测细胞活性。
1.3.4混合型淋巴细胞反应取不同转染组HMGB1刺激培养48 h的DC与ConA活化12 h后的CD4+T细胞以1∶50、1∶100及1∶200比例混合,以每孔2×105个细胞、200 μl含 10%FBS的1640培养基接种于96孔板中,每组设5个复孔。培养68 h后每孔吸取100 μl上清,加入10 μl CCK8试剂,继续培养4 h,采用酶标仪于450 nm波长下检测各组吸光度值(A值)。收取细胞上清液,按照ELISA说明书检测IFN-ɣ和IL-4水平。
1.4统计学处理采用SPSS16.0软件进行统计,数据以±s表示,行单因素方差分析,两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结 果
2.1HMGB1对DC表面分子表达及DC凋亡的影响HMGB1对DC表面分子表达的量效研究中以100 ng/ml HMGB1的上调作用最为明显,而1 000 ng/ml组DC表面分子表达有所下降。与未加HMGB1刺激组比较,HMGB1刺激48 h后CD80、CD86及MHC-II表达明显增加(P<0.05),以100 ng/ml HMGB1组表面共刺激分子上调最为明显(P<0.05)。以不同浓度HMGB1刺激DC 48 h,随着HMGB1剂量的增加,DC凋亡率逐渐升高(P<0.05)。见图1。
2.2HMGB1刺激DC 48 h后miR-449b的变化HMGB1刺激DC 48 h后,miR-449b表达量与未刺激组相比明显增多,且随着剂量的加大miR-449b表达明显上调(P<0.01)。流式细胞分析及细胞状态学观察证实,miRNA 80 nmol/ml时转染率高及细胞状态良好,并确定In-miR-449b浓度为120 nmol/ml,浓度更高时细胞死亡明显增多。Lipofectamine 2000转染12 h后流式分析检测转染率为63.6%,转染组荧光显微镜可见明显的荧光信号,qPCR验证转染miR-449b mimics组与对照组的相对比值为245.00±99.24,而转染In-miR-NC组miR-449b与对照组的比值为0.53±0.17。见图2。

图1不同剂量HMGB1刺激DC 48 h后表面分子表达及DC凋亡的改变
2.3miR-449b促进DC表面分子CD86表达及DC凋亡 转染miR-449b并HMGB1刺激48 h后,miR-449b组与miR-NC组相比DC表面分子CD86表达明显上调(22.57±0.82 比15.66±1.32,P<0.01),In-miR-449b组与In-miR-NC组相比有所降低(14.97±1.34 比17.55±0.71,P<0.05),miR-449b组与In-miR -449b相比显著上调(P<0.01),而In-miR-449b与各组相比CD80及MHC-II表达的变化均无统计学意义。转染miR-449b 组与miR-NC相比,DC凋亡率明显增高[(55.63±2.72)%比(67.01± 3.31)%,P<0.05)],In-miR-449b组与In-miRNC组相比凋亡明显减少[(52.47±3.71)% 比(43.91±1.86)%,P<0.05)],miR-449b 组与In-miR-449b组相比凋亡增多(P<0.01)。见图3。
2.4miR-449b抑制DC对T细胞的增殖作用转染miR-449b与In-miR-449b的DC分别与T细胞按1∶50、1∶100及1∶200的比例共培养72 h,其中1∶100比例对T细胞的增殖作用最强。1∶100时 miR-449b组(0.553±0.014)与 miR-NC(0.624±0.016)相比增殖活性明显减弱(P<0.01);In-miR-449b组(0.739±0.010)与 In-miRNC组(0.626±0.017)相比增殖活性显著增强(P<0.01);In-miR-449b组(0.739±0.010)与miR-449b组(0.553±0.014)相比增殖活性明显增强(P<0.01)。见图4。
2.5miR-449b对共培养上清中IFN-ɣ及IL-4水平的影响miR-449b组与miR-449b-NC组相比,IL-4水平明显升高[(359.83±22.79)pg/ml比 (308.16±17.87)pg/ml,P<0.01)]、IFN-ɣ水平明显下降[(9.92±2.78)pg/ml比(19.10±1.95)pg/ml,P<0.05)];In-miR-449b组 与In-miRNC组相比,IL-4水平显著下降[(275.66±18.28)pg/ml 比 (318.88±5.83)pg/ml,P<0.01)]、IFN-ɣ水平则明显升高[(30.57±4.40 )pg/ml比(19.58±1.40)pg/ml,P<0.01)]。见图4。
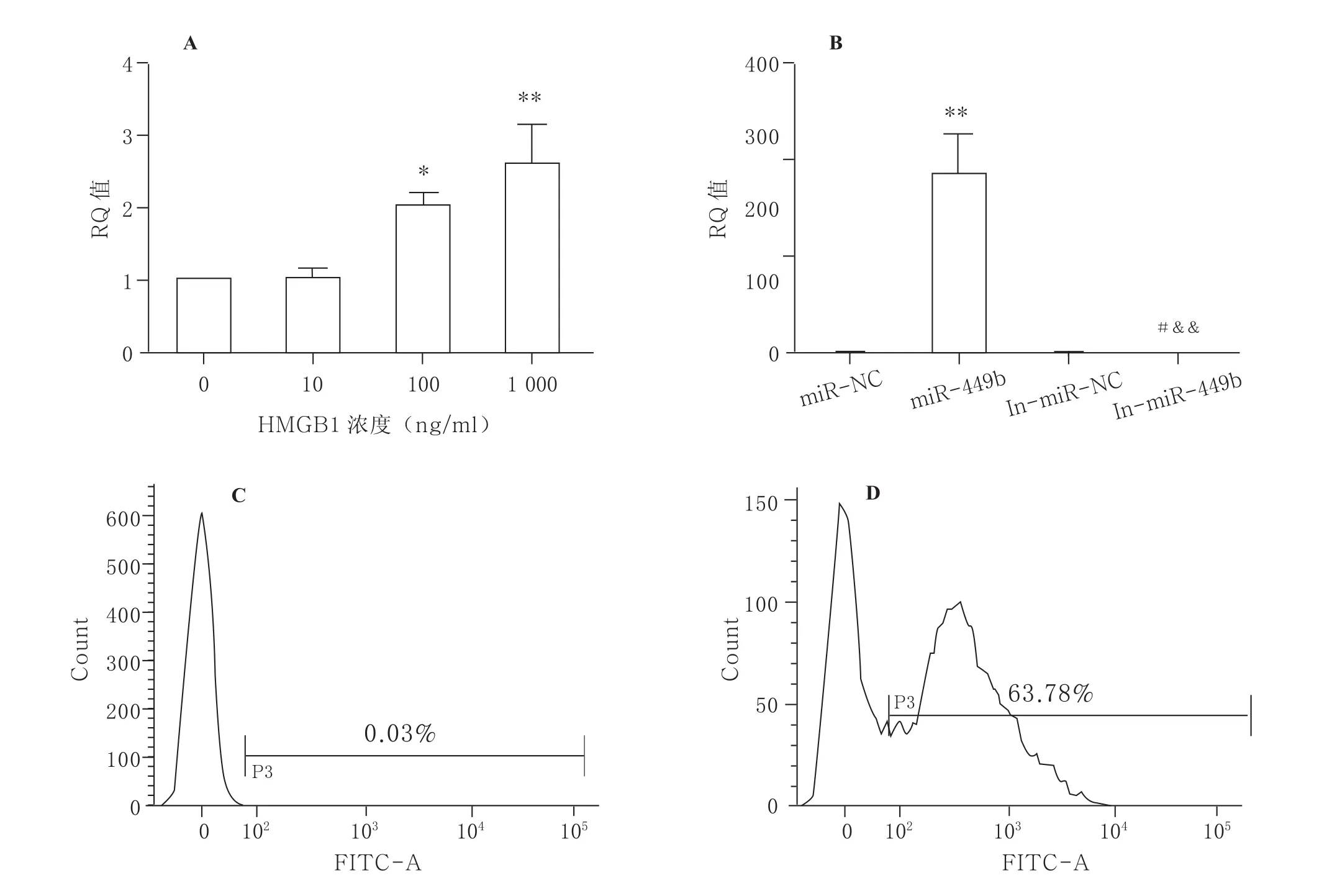
图2 不同剂量HMGB1作用于DC 48 h后miR-449b表达及qPCR验证转染率情况

图3 miR-449b对DC表面分子表达(A)及DC凋亡(B)的影响
3 讨 论
近年来资料提示,以T细胞、DC凋亡增多及继发性免疫功能受损为特点的免疫功能紊乱在脓毒症发生机制中具有重要作用[10]。我们既往研究发现,晚期炎症介质HMGB1可导致T细胞及DC免疫功能抑制,这可能是感染后机体免疫功能紊乱的重要调控机制[4]。DC作为连接固有免疫及适应性免疫的桥梁,其功能及数量改变在脓毒症免疫障碍及炎症反应过程中发挥关键作用[11]。据报道,脓毒症患者外周血及淋巴器官或组织中均出现DC减少,且健存的DC表现为免疫功能受损[12-14];而抑制脓毒症小鼠DC凋亡或者体内输注正常的DC能明显改善脓毒症动物预后[15-16]。HMGB1可促进DC的成熟及活化,随着剂量的增加则导致DC成熟障碍及诱导T细胞向Th2分化,但其确切调控机制仍未澄清[4]。业已明确,miRNA在DC的成熟、分化及凋亡中具有重要作用[7]。有资料证实,与iDC相比,miR-449b在mDC及tDC中表达上调,且钙离子内流可促进其在T细胞中表达[8-9]。此外,HMGB1对DC免疫功能具有诱导活化及耐受的双向性,本研究中我们进一步探讨DC在HMGB1刺激下miR-449b的变化规律及其对DC免疫功能与凋亡的潜在影响。

图4 转染miR-449b后DC对T细胞增殖(A)及细胞因子IL-4(B)和IFN-γ(C)的影响
miR-449b在HMGB1刺激DC 48 h后表达上调,以100及1 000 ng/ml HMGB1组最为明显,这可能与DC在HMGB1刺激下成熟、免疫功能受损及逐渐凋亡有关。Stumpfova等[8]观察到,人外周血来源的DC在诱导成熟及耐受后miR-449b均表现为上调,与HMGB1刺激DC后miR-449b的变化具有一致性。我们以前关于HMGB1对DC免疫功能的时效研究发现,不同剂量组HMGB1在48 h时对DC的免疫功能改变最明显[17]。本组资料提示HMGB1对DC免疫功能的影响在48 h时以100 ng/ml最为明显,因此我们重点分析转染miR-449b后DC在HMGB1刺激48 h后免疫功能的改变。
转染miR-449b、In-miR-449及相应对照(miR-NC、In-miR-NC)发现,上调miR-449b后DC表面分子CD86明显上调,而CD80及MHC-II变化不明显。CD80及CD86作为DC重要的表面共刺激分子,其表达水平对T细胞向Th1或Th2分化具有重要作用。有研究发现,阻断DC CD80后,在混合性淋巴细胞反应中呈现Th1细胞低反应性或无能,而Th2相关细胞因子IL-4增多;但阻断DC的CD86后,Th1相关细胞因子IFN-ɣ明显升高[18]。另据报道,衰竭的DC与活化的DC相比,CD86与CD80的比值更高,说明CD86具有促进T细胞向Th2分化的作用[19]。新近有人发现,miR-449b可靶向作用于HDAC的mRNA,从而间接促进IFN-β的生成[20],而IFN-β能促进DC表面分子CD86的表达[21]。有鉴于此,我们推测DC中miR-449b的上调可能通过影响IFN-β的生成进而影响CD86的表达,促进T细胞向Th2分化及免疫活性降低。
本组资料证实,过表达miR-449b可导致DC凋亡明显增多,而抑制miR-449b表达可减少DC的凋亡率。miR-449b对DC凋亡影响的具体机制还未完全了解。据报道,miR-449b过表达能促进视网膜母细胞瘤的凋亡,抑制结肠癌干细胞及甲状腺癌细胞的增殖分化,其分子机制与负性调控E2F及促进P53的活化有关[22-24]。在脓毒症病理过程中,DC发生明显快速的凋亡,这可能与抗原相关分子模式(PAMP)和损伤相关分子模式(DAMP)对DC的作用有关。人外周血单核细胞诱导分化来的DC在诱导成熟及耐受后均表现为miR-449b表达上调[8]。我们的结果显示,DC在高剂量HMGB1刺激下miR-449b明显上调,且过表达miR-449b明显促进DC的凋亡,因此HMGB1刺激下miR-449b的上调可能参与了脓毒症中DC的凋亡过程。
进一步分析可见,转染miR-449b 的DC经HMGB1活化后与转染In-miR-449b组相比,能明显抑制T细胞的增殖,在混合淋巴细胞反应中IL-4水平增高、IFN-ɣ降低。该效应可能与miR-449b上调DC共刺激分子CD86及促进DC凋亡有关,CD86与CD80比值的增大及凋亡DC均可诱导T细胞向Th2分化。但是否与DC产生IL-12、IL-10等炎症因子有关,尚需要深入研究。由此可见,DC中miR-449b增加可诱导T细胞的免疫功能受抑。
DC免疫功能及凋亡改变是脓毒症免疫功能紊乱发生发展的重要环节,因此深入了解脓毒症中影响DC功能及凋亡的因素对改善患者预后可能具有重要意义。业已明确,HMGB1可诱导DC的成熟及表型功能的异常,但其确切分子机制仍未清楚。本研究发现,DC在HMGB1刺激48 h后miR-449b明显上调,可促进DC凋亡及诱导T细胞向Th2分化,从而负性调节DC的免疫功能。同时,抑制miR-449b后经HMGB1刺激的DC凋亡明显减少,刺激T细胞增殖效应显著增强。因此,调节miR-449b可调控DC的免疫功能,进而有助于深入了解HMGB1对DC影响的分子机制及其潜在干预途径。
[1]Vincent JL, Opal SM, Marshall JC, Tracey KJ. Sepsis definitions∶time for change[J]. Lancet, 2013, 381(9868)∶ 774-775.
[2]姚咏明, 盛志勇. 重视对脓毒症本质的探讨[J]. 中华急诊医学杂志,2005, 14(3)∶ 185-186.
[3]Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression∶ from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12)∶ 862-874.
[4]姚咏明,主编. 急危重症病理生理学[M]. 北京:科学出版社,2013∶ 266-269.
[5]姚咏明, 刘辉. 重视高迁移率族蛋白B1免疫效应的探索[J]. 感染、炎症、修复, 2009, 10(1)∶ 3-5.
[6]Carthew RW, Sontheimer EJ. Origins and Mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4)∶ 642-655.
[7]Smyth LA, Boardman DA, Tung SL, Lechler R, Lombardi G. MicroRNAs affect dendritic cell function and phenotype[J]. Immunology,2015, 144(2)∶ 197-205.
[8]Stumpfova Z, Hezova R, Meli AC, Slaby O, Michalek J. MicroRNA profiling of activated and tolerogenic human dendritic cells[J]. Mediat Inflamm,2014, 2014∶ 259689.
[9]Lu MC, Yu CL, Chen HC, Yu HC, Huang HB, Lai NS. Aberrant T cell expression of Ca2+ influx-regulated miRNAs in patients with systemic lupus erythematosus promotes lupus pathogenesis[J]. Rheumatology, 2015, 54(2)∶ 343-348.
[10]姚咏明, 祝筱梅. 细胞凋亡在脓毒症免疫紊乱中作用及其调控途径的思考[J]. 中华创伤杂志, 2012, 28(10)∶ 867-870.
[11]刘庆阳, 姚咏明. 树突状细胞体内回输对烫伤小鼠过度炎症反应的调控作用[J]. 感染、炎症、修复, 2011, 12(1)∶ 11-15.
[12]Boomer JS, To K, Chang KC, Takasu O, Osborne DF, Walton AH. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA, 2011, 306(23)∶ 2594-2605.
[13]Hotchkiss RS, Tinsley KW, Swanson PE, Grayson MH, Osborne DF, Wagner TH. Depletion of dendritic cells, but not macrophages, in patients with sepsis[J]. J Immunol, 2002, 168(5)∶ 2493-2500.
[14]Raffray L, Douchet I, Augusto JF, Youssef J, Contin-Bordes C, Richez C, Duffau P, Truchetet ME, Moreau JF, Cazanave C, Leroux L, Mourrissoux G, Camou F, Clouzeau B, Jeannin P, Delneste Y, Gabinski C, Guisset O, Lazaro E, Blanco P. Septic shock sera containing circulating histones induce dendritic cellregulated necrosis in fatal septic shock patients[J]. Crit Care Med, 2015, 43(4)∶ e107-116.
[15]Gautier EL, Huby T, Saint-Charles F, Ouzilleau B, Chapman MJ, Lesnik P. Enhanced dendritic cell survival attenuates lipopolysaccharide-induced immunosuppression and increases resistance to lethal endotoxic shock[J]. J Immunol, 2008, 180(10)∶ 6941-6946.
[16]Wang HW, Yang W, Gao L, Kang JR, Qin JJ, Liu YP, Lu JY. Adoptive transfer of bone marrow-derived dendritic cells decreases inhibitory and regulatory T-cell differentiation and improves survival in murine polymicrobial sepsis[J]. Immunology, 2015, 145(1)∶ 50-59.
[17]Zhu XM, Yao YM, Liang HP, Xu S, Dong N, Yu Y, Sheng ZY. The effect of high mobility group box-1 protein on splenic dendritic cell maturation in rats[J]. J Interferon Cytokine Res, 2009,29(10)∶677-86..
[18]Kuchroo VK, Das MP, Brown JA, Ranger AM, Zamvil SS,Sobel RA, Weiner HL, Nabavi N, Glimcher LH. B7-1 and B7-2 costimulatory molecules activate differentially the Th1/Th2 developmental pathways∶ application to autoimmune disease therapy[J]. Cell, 1995, 80(5)∶ 707-718.
[19]Langenkamp A, Messi M, Lanzavecchia A, Sallusto F. Kinetics of dendritic cell activation∶ impact on priming of TH1, TH2 and nonpolarized T cells[J]. Nat Immunol, 2000, 1(4)∶ 311-316.
[20]Buggele WA, Krause KE, Horvath CM. Small RNA profiling of influenza A virus-infected cells identifies miR-449b as a regulator of histone deacetylase 1 and interferon beta[J]. PloS One, 2013, 8(9)∶ e76560.
[21]Zang YC, Skinner SM, Robinson RR, Li S, Rivera VM, Hutton GJ , Zhang JZ. Regulation of differentiation and functional properties of monocytes and monocyte-derived dendritic cells by interferon beta in multiple sclerosis[J]. Mult Scler 2004, 10(5)∶ 499-506.
[22]Fang Y, Gu X, Li Z, Xiang J, Chen Z. miR-449b inhibits the proliferation of SW1116 colon cancer stem cells through downregulation of CCND1 and E2F3 expression[J]. Oncol Rep, 2013, 30(1)∶ 399-406.
[23]Lize M, Pilarski S, Dobbelstein M. E2F1-inducible microRNA 449a/b suppresses cell proliferation and promotes apoptosis[J]. Cell Death Diffe, 2010, 17(3)∶ 452-458.
[24]Chen L, Xu L, Wang G. Regulation of MET-mediated proliferation of thyroid carcinoma cells by miR-449b[J]. Tumour Biol,2015, DOI∶ 10.1007/s13277-0153619-4.
Regulatory effect of microRNA-449b on high mobility group box-1 -mediated immune function of dendritic cells
Wang Yongtao*, Dong Ning, Chai Yanfen, Yu Yan, Qi Anlong, Yao Yongming. *
Department of Emergency, General Hospital of Tianjin Medical University, Tianjin 300052, China Corresponding author∶ Yao Yongming( E-mail∶ c_ff@sina.com)
Objective: To investigate the changes in miR-449b in dendritic cells (DCs) stimulated by high mobility group box-1 protein (HMGB1) and its potential effect on DC-mediated immunity. Methods: CD11c+DCs isolated from mouse spleens were treated with different doses of HMGB1 (10, 100, and 1000 ng/ml) for 48 hours, and then, the expressions of costimulatory molecules, including CD80, CD86, and MHC-II, and miR-449b in DCs were determined, and apoptosis of DCs stimulated by different doses ofHMGB1 were analyzed with flow cytometry. After DCs were transfected with miR-449b mimics (miR-449b), negative control mimics (miR-NC), miR-449b inhibition (In-miR-449b), and negative control inhibition (In-miR-NC), DCs were challenged by HMGB1 (100 ng/ml) for 48 hours. The expressions of co-stimulatory molecules on DC surface and cell apoptosis were analyzed. Moreover, the activated DCs were assessed for their capacity to stimulate the proliferation and differentiation of T cells. Results: The co-stimulatory molecule expressions were markedly up-regulated after DCs were treated with HMGB1 for 48 hours, especially in 100 ng/ml HMGB1 stimulation group, on the other hand, they decreased after DCs were treated with 1000 ng/ml HMGB1. The expression of miR-449b in DCs was enhanced after being stimulated by 100 and 1000 ng/ml HMGB1 for 48 hours (P<0.05). The percentage of apoptosis was elevated with the increase in the dose of HMGB1 at 48 hours (P<0.05). The expression of miR-449b in DCs was up-regulated after miR-449b transfection and inhibited by In-miR-449b tranfection. Meanwhile, miR-449b transfection and 100 ng/ml HMGB1 stimulation (48 hours) could significantly up-regulate the expression levels of CD86 (P<0.05) , while apoptosis of DC was promoted, proliferative effect weakened (P<0.01), showing an increased level of IL-4 and the decreased level of IFN-γ .Conclusions: MiR-449b might negatively regulate the immune function of DC stimulated by HMGB1 and promote the apoptosis of DC. Thus, miR-449b might play a potential role in down-regulation of host immune response.
miR-449b Dendritic cellHigh mobility group box-1 protein Immune function
10. 3969/j. issn. 1672-8521. 2015. 04. 003
国家自然科学基金资助项目(81130035, 81372054, 81501664);国家重点基础研究发展计划项目(2012CB518102)
姚咏明,研究员,教授(E-mail∶ c_ff@sina.com)
2015-11-16)
