一遗传性心脏传导阻滞疾病家系的基因突变筛查*
2015-12-14蒋云山黄河黄向红李辉范双喜李辉莹卢永娟谭小军
蒋云山,黄河,黄向红,李辉,范双喜,李辉莹,卢永娟,谭小军
(湖南省湘潭市中心医院,湖南 湘潭 411100)
一遗传性心脏传导阻滞疾病家系的基因突变筛查*
蒋云山,黄河,黄向红,李辉,范双喜,李辉莹,卢永娟,谭小军
(湖南省湘潭市中心医院,湖南 湘潭 411100)
目的对一个常染色体显性遗传性心脏传导阻滞疾病(CCD)家系进行已知致病基因的筛查。方法以该家系为研究对象,获取相关临床资料,提取外周血基因组DNA。选择3个已知与遗传性CCD相关的候选基因:心脏特异性同源盒基因(NKX2.5)、心脏钠离子通道α亚单位基因(SCN5A)和核纤层蛋白基因(LMNA),对5例患者进行基因直接测序筛查。针对发现有突变的外显子,对其余成员的DNA样本同样进行聚合酶链反应(PCR)扩增和序列分析。结果遗传性CCD家系的遗传方式为常染色体显性遗传,临床表现符合遗传性CCD。对家系中患者及其他成员进行相关致病基因的所有外显子及其剪切位点区域的直接测序分析,未发现能引起编码氨基酸改变的碱基突变。结论遗传性CCD家系诊断为Lenègre-Lev病。初步的分子遗传学筛查未检测到该家系中存在NKX2.5、SCN5A和LMNA基因的有意义突变,提示可能存在其他致病基因参与CCD的发生,有待进一步研究。
常染色体显性遗传;进行性心脏传导阻滞;Lenègre-Lev病;基因突变;家系
心脏传导阻滞(cardiac conduction defect,CCD)是一类严重的潜在威胁生命的疾病[1]。其中最常见的是特发性双边束支纤维化病(又称Lenègre-Lev病)。目前研究证实,基因突变是遗传性CCD的常见病因,其中心脏特异性同源盒基因(cardiac-specific homeobo,NKX2.5)、心脏钠离子通道α亚单位基因(voltage-gated sodium channeltypeⅤ,SCN5A)和核纤层蛋白基因(lamin A/C,LMNA)突变与遗传性CCD的相关性得到多篇文献的论证。
本课题组收集到1个5代共68例的常染色体显性遗传性CCD家系成员,前期研究结果发表在2009年第6期的《中国心脏起搏与心电生理杂志》。该家系诊断为Lenègre-Lev病,但心电图特征提示Lenègre-Lev病可能存在第3型,即最初发病部位在心房内传导系统,以后病变逐步沿心脏特殊传导系统向His束发展,并演变为Ⅲ度房室传导阻滞(atrial ventricular block,AVB)。该家系特殊的起病方式是否与上述已知基因突变或其他基因相关尚不清楚。本课题组通过直接测序方法对已知的CCD相关候选基因进行突变筛查,以期找到致病基因,有利于研究发病机制,筛选出家系中的潜在患者,提醒其采取防范措施,避免猝死发生,现报道如下。
1 资料与方法
1.1研究对象
笔者收集到湘潭市的1个CCD家系,该家系有5代共68例家系成员。其中7例为CCD患者(现存4代60例,5例患者)。先证者(Ⅲ19)为57岁男性,37岁时因心悸短暂晕厥就诊,心电图(electrocardiogram,ECG)检查为Ⅰ度AVB,超声心动图(ultrasound cardiogram,UCG)检查提示心脏4个腔室大小正常;41岁时进展为Ⅲ度AVB和房颤,UCG检查提示心脏扩大,47岁时行右心室按需型起搏器植入术。对该家系中患者及其亲属共22例成员进行病史询问、心肺检查、ECG检查,并抽取外周静脉血5~10ml用于基因组DNA的提取。本实验由湘潭市中心医院生殖中心及心内科共同完成,对该家系的分子遗传学研究通过医院伦理委员会的论证。
应用Cyrillic 3.0软件绘制图谱。通过系谱图分析得知,该CCD家系表现为4代连续遗传(其中Ⅰ1突然猝死,原因不详,疑为CCD患者,第5代因年龄小,未见发病);男女发病几率相同,而且患者后代有50%左右的发病率;家系中已经明确诊断的患者有7例,其中男性5例,女性2例。Ⅰ1、Ⅰ2、Ⅱ1、Ⅱ3、Ⅱ7在50~75岁猝死,死因不详。见图1。
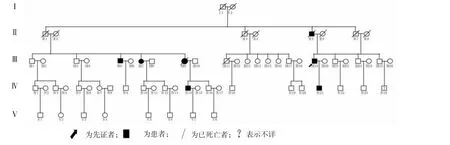
图1 Lenègre-Lev病系谱图
1.2临床心电图检查
根据《新编临床医学数据手册》对家系内成员进行心肺检查,检查内容包括体表心电图。完全性右束支阻滞(right bundle branch block,RBBB)3例(其中1例演变为Ⅰ度AVB),Ⅰ度AVB 2例(其中1例演变为Ⅲ度AVB),Ⅱ度AVB 2例,Ⅲ度AVB 2例,Ⅱ度窦房传导阻滞(sinoatrial block,SAB)2例,均表现为CCD。其中,先证者Ⅲ19的心电图检查由完全性RBBB演变为Ⅲ度AVB伴有RBBB和Ⅱ度SAB。接受检查的家系成员心电图检查结果见表1。
先证者(Ⅲ19)ECG检查提示Ⅲ度AVB、窦性心动过缓、交界性逸搏心率(见图2A)。先证者堂兄(Ⅲ5)2001年ECG提示完全性RBBB、窦性心动过缓、Ⅰ度AVB,UCG及核素心肌扫描正常,临床诊断为原发性传导束退化症;2007年ECG提示Ⅲ度AVB、完全性RBBB、Ⅱ度SAB,冠状动脉造影正常,UCG检查双心房扩大(见图2B)。先证者堂姐妹(Ⅲ31)ECG提示窦性心动过缓和完全性RBBB。先证者侄子(Ⅳ14)ECG提示窦性心动过缓、Ⅱ度AVB、ST-T改变、房性早搏未下传。先证者之子(Ⅳ21)ECG提示Ⅱ度Ⅰ型房室传导阻滞。
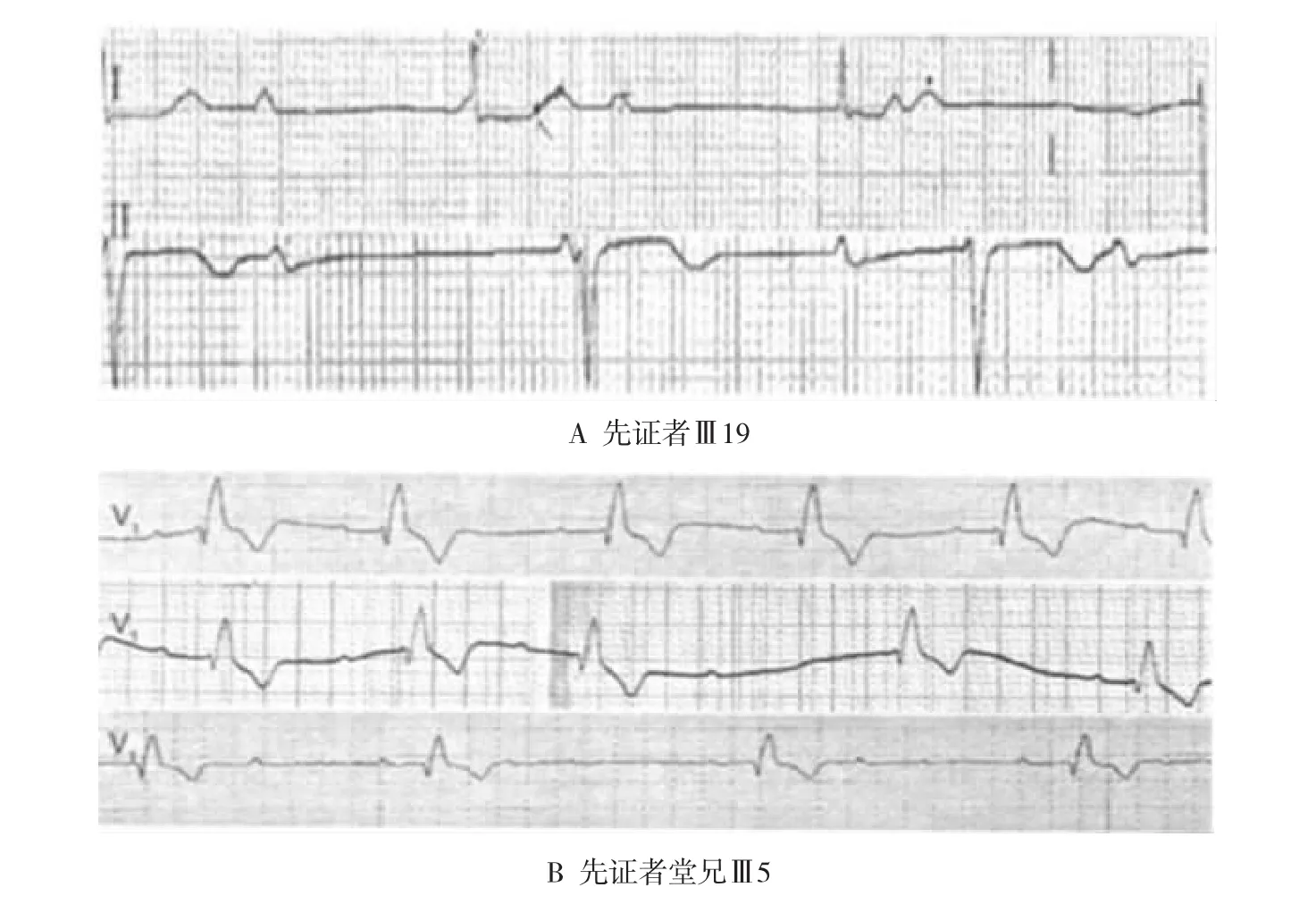
图2 ECG检查
1.3研究方法
1.3.1样本采集及DNA的提取按照血液基因组DNA提取试剂盒(Qiagen)说明书抽提外周血白细胞的基因组DNA。取适量DNA经紫外分光光度计进行定量和纯度检测,于-80℃冰箱保存备用。
1.3.2候选基因的选择和引物设计参考美国国立生物技术信息中心基因数据库的基因组和mRNA序列信息,结合已发表的文献,设计覆盖已知的CCD发生相关基因SCN5A、NKX2.5和LMNA的全部外显子及其剪切位点区域的引物,其中SCN5A有2个外显子,NKX2.5有28个外显子,LMNA有12个外显子,引物序列见表2。所有引物由上海生物工程股份有限公司合成。
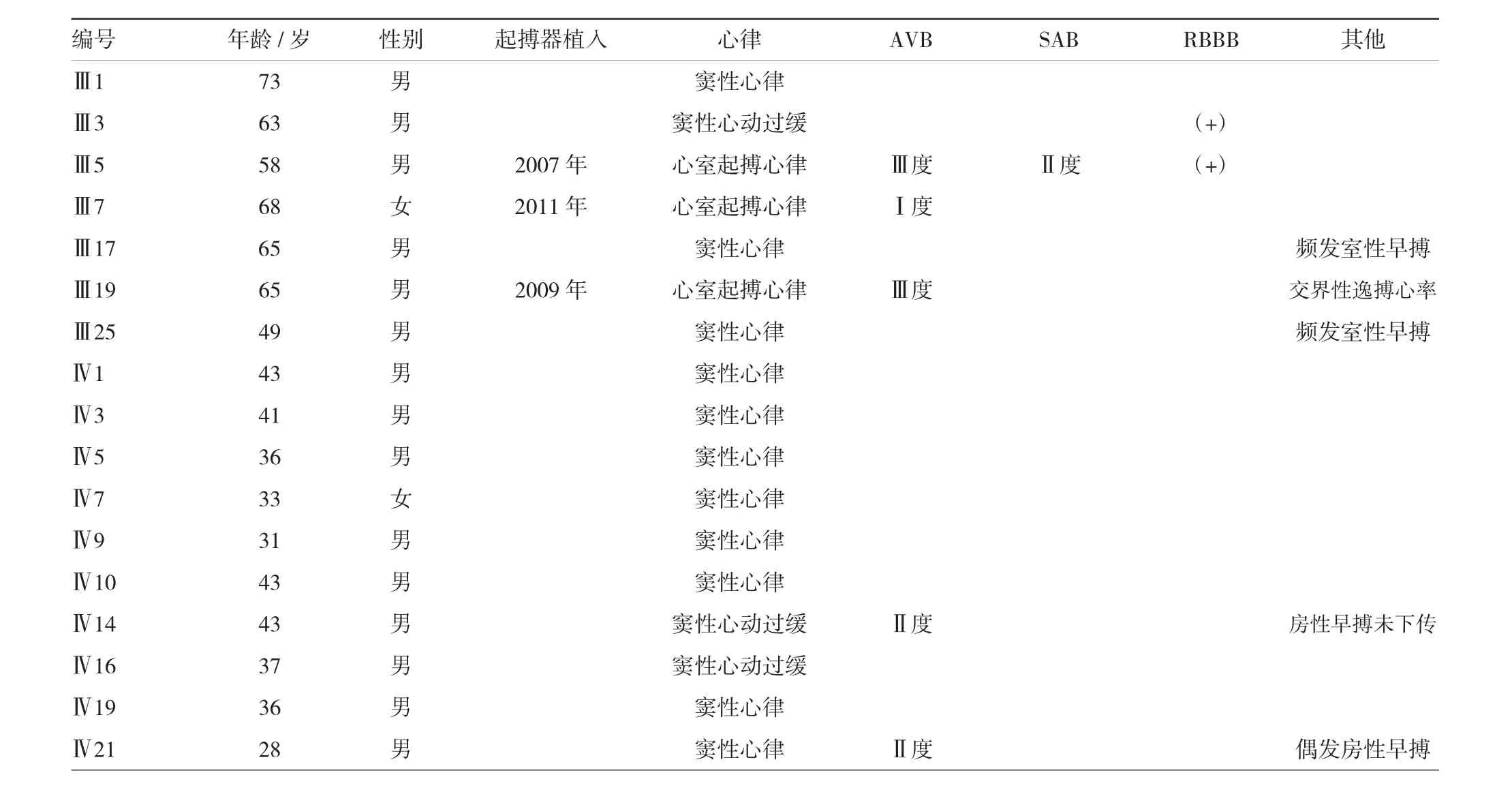
表1 Lenègre-Lev病家系成员的临床检查结果
1.3.3聚合酶链反应以基因组DNA为模板,采用
聚合酶链式反应(polymerase chain reaction,PCR)方法扩增目的DNA片段。本研究采用的PCR反应体系为50μl,其中包括100μg基因组DNA,10 mol/L引物,200 mmol/L dNTP和Tag酶。PCR反应在DNA热循环仪(美国Bio-rad公司)上进行,反应条件如下:95℃预变性2 min,94℃变性10 s,65℃退火30 s,68℃延伸2 min,共35个循环。取5μl PCR产物在1%琼脂糖凝胶上电泳,100 bp DNA Marker鉴定扩增片段。

续表1

表23 个候选基因的PCR和测序引物
续表2
1.3.4测序分析PCR产物送深圳华大生物技术有限公司纯化后直接测序(ABI377自动DNA测序仪)。测序引物与PCR引物相同。参考已报道的致病基因突变位点和美国国立生物技术信息中心提供的候选基因SCN5A、NKX2.5和LMNA的标准基因序列,应用DNAman软件对测序结果进行序列分析比对,判断是否存在突变位点及氨基酸序列的变化。若发现可疑突变,重新稀释DNA模板,对基因外显子进行重复实验和反向测序予以验证。
2 结果
选取Ⅲ5、Ⅲ7、Ⅲ19、Ⅳ14及Ⅳ21共5例患者进行LMNA和SCN5A、NKX2.5基因全部外显子和部分剪切位点区域DNA片段的PCR扩增,凝胶电泳分析可见特异性条带,与预期结果相符。PCR扩增片段产物纯化后经直接测序分析,未发现与已报道的候选基因一致的突变位点。
3 讨论
本课题组黄河等[2]证实遗传性CCD家系疾病被诊断为Lenègre-Lev病。Lenègre-Lev病是以心房和心室内传导系统异常为特征的一种疾病;主要特点为希浦系的心脏内传导系统出现进行性传导异常,导致房室或室内传导阻滞;病因不明,该病具有一定的异质性,病情严重时可导致晕厥或猝死[1,3]。因此,筛查致病基因对该家系疾病的分子机制研究及预防猝死极为重要。
CCD是一种多重病因的遗传异质性疾病,其中遗传学因素在CCD发病中的作用日益受到重视。该病一般以常染色体显性的方式遗传[4]。该家系患者双亲之一为CCD患者或疑似患者,男女均可发病,有连续传代的特点,符合常染色体显性遗传病的特征,与文献报道一致。
近年来,国内外研究发现多种基因异常与CCD有关,其中较多的是3个主要候选基因SCN5A、NKX2.5和LMNA突变能够引发进行性CCD的证据。
3.1SCN5A基因
SCN5A基因位于染色体3p21,编码心肌细胞膜上的钠离子电压门控通道Nav1.5。其突变后可引起Navl.5结构异常,造成快钠通道功能障碍,快反应细胞动作电位0期钠离子内流减少,去极化速率以及幅值减小,从而降低传导速度,引起传导阻滞。SCN5A基因突变后可引起病态窦房结综合征(sick sinus syndrome,SSS)[5]、进行性以及非进行性CCD[6-9]等多种心脏传导疾病。周熙惠等[10]发现1个CCD家系SCN5A基因新突变L1001Q。功能研究显示,该突变主要通过改变钠通道门控特性,引起钠通道功能减弱,导致CCD。邓尧等[11]通过全外显子测序发现一心脏传导疾病家系的SCN5A新的杂合突变P. Y1495X。此外,国外多位学者发现,SCN5A多个位点的错义突变、无义突变、移码突变等可导致CCD。
3.2NKX2.5基因
人类CSX/NKX2.5基因定位于染色体5q34和5q35,有972 bp的开放阅读框,编码含324个氨基酸的蛋白质。人类CSX/NKX2.5蛋白同源结构域HD含有高度保守的60个氨基酸残基,是与DNA结合的必需结构。NKX2.5基因是心脏发育过程中重要的转录因子,是所有脊椎动物心脏发生中最早表达的转录因子之一,参与心脏前体细胞的分化、心脏环化、房室分隔、房室流出道和传导系统的形成[12]。多篇文章报道NKX2.5基因的突变可导致CCD[13-16]。
3.3LMNA基因
LMNA基因位于染色体1q21.2~q21.3,基因组序列全长56.7 kb其中编码区域约24 kb,包含l2个外显子[17]。LMNA基因编码蛋白产物为Lamin A和C,是组成细胞核纤层的重要成分,在心脏传导系统形态学的发生、发育和功能维持方面发挥重要的调控作用,突变可导致多种遗传性疾病,包括CCD[18-21]。
本课题组通过直接测序法对家系患者的SCN5A、NKX2.5和LMNA基因的全部外显子和部分剪接区域进行突变筛查。结果既未发现已知的致病突变,也未检测到新的致病位点,提示本家系CCD发病机制可能与其他基因突变有关。本课题组下一步将针对家系中的关键患者及正常人开展全外显子组扫描分析,判断是否与已知基因存在连锁,结合外显子组测序和生物信息学分析继续对该家系的致病性突变位点定位和验证,并对新的致病基因功能进行观察和分析,为遗传学检查、产前诊断、新生儿筛查及疾病治疗等提供依据,为阐明CCD的分子遗传学机制提供新的线索。
[1]MICHAELSSON M,JONZON A,RIESENFELD T.Isolated congenital complete atrioventricular block in adult life:a prospective study[J].Circulation,1995,92(3):442-449.
[2]黄河,江洪,谭小军,等.遗传性心脏传导阻滞一家系[J].中国心脏起搏与心电生理杂志,2009,23(6):513-516.
[3]BALMER C,FASNACHT M,RAHN M,et al.Long-term follow up of children with congenital complete atrioventricular block and the impact of pacemaker therapy[J].Europace,2002,4(4):345-349.
[4]贺鹏康,程冠良,吴林.进行性心脏传导疾病[J].心血管病学进展, 2014,35(6):645-647.
[5]BENSON DW,WANG DW,DYMENT M,et al.Congenital sick sinus syndrome caused by recessive mutations in the cardiac sodium channel gene(SCN5A)[J].J Clin Invest,2003,112(7): 1019-1028.
[6]SCHOTT JJ,ALSHINAWI C,KYNDT F,et al.Cardiac conduction defects associate with mutations in SCN5A[J].Nat Genet,1999, 23(1):20-21.
[7]PROBST V,KYNDT F,POTET F,et al.Haploinsufficiency in combination with aging causes SCN5A-linked hereditary Lenègre disease[J].J Am Coll Cardiol,2003,41(4):643-652.
[8]TAN HL,BINK-BOELKENS MT,BEZZINA CR,et al.A sodium-channel mutation causes isolated cardiac conduction disease[J]. Nature,2001,409(6823):1043-1047.
[9]FERNANDEZ P,MOOLMAN-SMOOK J,BRINK P,et al.A gene locus for progressive familial heart block typeⅡ(PFHBⅡ)maps to Chromosome 1q322-q323[J].Hum Genet,2005,118(1): 133-137.
[10]周熙惠,惠智艳,史瑞明,等.心脏传导阻滞基因突变体构建和功能研究[J].西安交通大学学报(医学版),2012,33(5):593-597.
[11]邓尧.全外显子测序发现遗传性心脏传导疾病致病基因SCN5A新突变[D].长沙:中南大学,2014.
[12]BOUVERET R,WAARDENBERG AJ,SCHONROCK N,et al. NKX2-5 mutations causative for congenital heart disease retain functionality and are directed to hundreds of targets[J].Elife, 2015,Doi:10.7554/eLife.06942.
[13]SCHOTT JJ,BENSON DW,BASSON CT,et al.Congenitalheart disease caused by mutations in the transcription factor NKX2-5[J].Science,1998,281(5373):108-111.
[14]WATANABE Y,BENSON DW,YANO S,et al.Two novel frameshift mutations in NKX25 result in novel features including visceral inversus and sinus venosus type ASD[J].J Med Genet,2002,39(11):807-811.
[15]HIRAYAMA-YAMADA K,KAMISAGO M,AKIMOTO K,et al. Phenotypes with GATA4 or NKX25 mutations in familial atrial septal defect[J].Am J Med Genet A,2005,135(1):47-52.
[16]GUTIERREZ-ROELENS I,DE ROY L,OVAERT C,et al.A novelCSXNKX2-5mutationcausesautosomaldominantAV block:are atrial fibrillation and syncopes part of the phenotype[J]. Eur J Hum Genet,2006,14(12):1313-1316.
[17]WYDNER KL,MCNEIL JA,LIN F,et al.Chromosomal assignment of human nuclear envelope protein genes LMNA,LMNB l, and LBR by fluorescence in situ hybridization[J].Genomics, 1996,32(3):474-478.
[18]FATKIN D,MACRAE C,SASAKI T,et al.Missense mutations in the rod domain of the lamin AC gene as causes of dilated cardiomyopathy and conduction system disease[J].N Engl J Med, 1999,341(23):1715-1724.
[19]VAN BERLO JH,DE VOOGT WG,VAN DER KOOI AJ,et al.Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations:do lamin AC mutations portend a high risk of sudden death[J].J Mol Med,2005,83(1):79-83.
[20]GRUENBAUM Y,GOLDMAN RD,MEYUHAS R,et al.The nuclear lamina and its functions in the nucleus[J].Int Rev Cytol,2003,226:1-62.
[21]MEUNE C,VAN BERLO J,ANSELME F,et al.Primary prevention of sudden death in patients with lamin AC gene mutation[J].N Engl J Med,2006,354(2):209-210.
(童颖丹 编辑)
Gene mutation screening in a Chinese pedigree with genetic cardiac conduction block*
Yun-shan JIANG,He HUANG,Xiang-hong HUANG,Hui LI,Shuang-xi FAN, Hui-ying LI,Yong-juan LYU,Xiao-jun Tan
(Xiangtan Central Hospital,Xiangtan,Hunan 411100,P.R.China)
【Objective】To screen the known causative gene mutations in a Chinese pedigree suffered from autosomal dominant cardiac conduction block disease.【Methods】A Chinese pedigree with genetic cardiac conduction block was collected as the research subjects.ECGs of the family members were analyzed, their peripheral venous blood was collected and genomic DNA was extracted.Three known candidate genes [cardiac-specific homeobox 1(NKX2.5),voltage-gated sodium channel typeⅤ(SCN5A)and lamin A/C(LMNA)]associated with genetic cardiac conduction block were screened in 5 patients by direct gene sequencing. The mutant exons discovered were then screened in the remaining members using PCR and gene sequencing.【Results】The inheritance mode of the family was autosomal dominant.Clinical manifestations of the patients conformed to genetic heart block.Direct gene sequencing analysis of the 3 genes in the patients of this pedigree did not reveal the causative gene mutations.【Conclusions】This pedigree has been diagnosed as Lenègre-Lev disease.The causative gene mutations have not been found in screening of NKX2.5,SCN5A and LMNA gene mutations,suggesting the presence of other causative genes in this genetic cardiac conduction disease,which needs further study.
autosomal dominant inheritance;progressive cardiac conduction block;Lenègre-Lev disease; gene mutation;pedigree
R541.76;R394
B
1005-8982(2015)32-0063-07
2015-04-27
湘潭市科技计划重点项目(No:ZD20121017)
谭小军,E-mail:changdaot@163.com;Tel:18607321777
