重组人RNA聚合酶Ⅱ转录调节物12-Fc融合蛋白载体的构建和表达*
2015-12-14傅行礼鞠爱萍马小兰叶军
傅行礼,鞠爱萍,马小兰,叶军
(1.江苏大学医学部,江苏 镇江 212001;2.山东省邹城市人民医院,山东 邹城 273500;3.江苏省泰州市中医院,江苏 泰州 225300;4.江苏省泰州市人民医院,江苏 泰州 225300)
·论著·
重组人RNA聚合酶Ⅱ转录调节物12-Fc融合蛋白载体的构建和表达*
傅行礼1,鞠爱萍2,马小兰3,叶军4
(1.江苏大学医学部,江苏 镇江 212001;2.山东省邹城市人民医院,山东 邹城 273500;3.江苏省泰州市中医院,江苏 泰州 225300;4.江苏省泰州市人民医院,江苏 泰州 225300)
目的用pIRES2-EGFP-Fc载体构建重组人RNA聚合酶Ⅱ转录调节物12(MED12)-Fc真核表达质粒,转染中国仓鼠卵巢(CHO)细胞表达MED12-Fc融合蛋白,纯化和鉴定MED12-Fc。方法根据GenBank中的序列信息,从基因组上扩增出人MED12基因第2、3和4外显子,并通过Overlap聚合酶链反应(PCR)拼接获得目的基因片段,以pIRES2-EGFP-Fc真核表达质粒为载体,构建重组人MED12-Fc真核表达质粒。使用脂质体瞬时转染293T细胞,48 h收集上清液,用酶联免疫吸附法(ELISA)鉴定质粒的表达能力。表达质粒电转CHO细胞,通过G418抗性筛选及流式细胞仪荧光筛选,获得高表达的稳定细胞株。使用稳定细胞株培养表达人MED12-Fc融合蛋白,收集上清液,用Proein A亲和纯化柱纯化蛋白。十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)检测蛋白质分子量。结果通过DNA测序和瞬时转染表达鉴定,证实MED12第2、3和4外显子基因序列正确,成功获得重组人MED12-Fc真核表达质粒。通过电转化、G418及流式细胞仪荧光筛选,获得高表达重组人MED12-Fc的稳定表达细胞株。通过细胞培养,亲和层析纯化,获得高纯度的重组人MED12-Fc融合蛋白。结论成功构建MED12-Fc融合蛋白的表达载体,获得高纯度的重组人MED12-Fc融合蛋白,为进一步研究MED12蛋白功能奠定基础。
RNA聚合酶Ⅱ转录调节物12;融合蛋白;表达载体
RNA聚合酶Ⅱ转录调节物12(mediator of RNA polymeraseⅡtranscription 12,MED12)是中介体复合物(mediator complex)的一个亚基,在真核细胞中调节转录,并参与受体酪氨酸激酶(receptor tyrosine kinase,RTK)、核受体(nuclear receptor,NR)和Wnt信号通路[1-2]。MED12分子的进化保守区域具有重要的转录调控功能,但是MED12基因序列上也存在突变热点,该位点的突变会对MED12蛋白的功能产生影响,最终导致某些疾病的发生。本实验将MED12第2、3和4外显子通过Overlap聚合酶链反应(polymerase chain reaction,PCR)拼接获得目的基因片段,以pIRES2-EGFP-Fc真核表达质粒为载体,构建重组人MED12-Fc真核表达质粒,将其转染中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞进行稳定表达,获得MED12-Fc融合蛋白,为进一步开展MED12蛋白功能的研究奠定基础。
1 材料与方法
1.1材料
1.1.1载体与细胞pIRES2-EGFP-Fc真核表达载体由本实验室构建和保存,该载体含有hCMV启动子、高效信号肽序列,以及人IgG1从铰链区到CH3的Fc片段,可引导外源蛋白融合分泌表达。同时,该载体中含有Neo筛选基因、内核糖体进入序列(internal ribosome entry site,IRES)双表达元件、增强型绿色荧光蛋白(enhanced green fluorescent pro tein,EGFP),可进行G418筛选及荧光检测和筛选,人肾上皮293T细胞、CHO细胞由本实验室保存。
1.1.2仪器与试剂台式离心机购自德国Ependorf公司,凝胶成像系统购自美国Bio-Rad公司,PCR仪购自美国Application Binary Interface公司,24孔细胞培养板、酶标版购自美国康宁公司,酶标仪购自美国Molecular Devices公司,电穿孔仪、电击杯购自美国Bio-Rad公司,PCR产物回收试剂盒、质粒小提试剂盒、凝胶回收试剂盒、组织基因组抽提试剂盒购自美国Axygen公司,HindⅢ、BamHⅠ、T4 DNA连接酶等分子生物学产品购自美国Fermentas公司,DH5a感受态细胞、溶菌肉汤(luria-bertani,LB)培养基、LB培养平板等均由本实验室制作,所用基础试剂包括蛋白胨、酵母粉、琼脂粉、NaCl、卡那霉素、G418、西班牙琼脂糖等购自上海生工生物工程股份有限公司,高效转染试剂LipofectamineTM2000 CD、无动物来源组分的培养液Optipro无血清培养基(serum free medium,SFM)、Hybridoma-SFM、胰蛋白酶等细胞培养试剂购自美国Invitrogen公司,无热源内毒素抽提试剂盒、内毒素检测试剂盒(美洲鲎试剂)、邻苯二胺购自美国Sigma公司,MED12单抗购自美国Novacell公司,人IgG1酶联免疫吸附测定(enzyme-linkedimmunosorbentassay,ELISA)Kit(Cat#ab100548)购自美国Abcam公司。
1.1.3基因序列与引物设计GenBank中查询MED12基因信息,设计扩增第2、3和4外显子的Overlap PCR引物。使用Primer Premier 5软件,设计Overlap PCR引物,并添加克隆位点。引物由南京金思瑞生物科技有限公司合成。MED12-正向引物1:CTCTAAAGCTTCGATGAACTGACGGCCTTGAA,MED12-反向引物1:AGTTGGAACTGATCTTGGCAG GATTGAAGCTGA;MED12-正向引物2:ATCCTGCC AAGATCAGTTCCAACTTCAGCAG,MED12-反向引物2:TGAAAATGGGGACCTTTTTGGCTAGTTGCGTGA;MED12-正向引物3:TAGCCAAAAAGGTCCCCA TTTTCAGTAAGAAG,MED12-反向引物3:CTCTGG GATCCATGAAAGGGTCAACATGTCT。
1.2方法
1.2.1MED12基因第2、3和4外显子PCR扩增采集健康人抗凝血1 ml,使用美国Axygen公司的血液基因组抽提试剂盒,按照说明书操作步骤对样本进行基因组抽提。在50μl的PCR反应体系中,分别加基因组模板5μl、双蒸水37μl、10×pfu Buffer 5μl、2.5 mmol dNTP 1μl、正向引物(50 pmol)0.5μl、反向引物(50 pmol)0.5μl、pfu高保真DNA聚合酶1μl。PCR反应条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共25个循环,72℃继续延伸5 min。以从基因组上扩增获得的第2、3和4外显子PCR产物为模板(混合),Overlap PCR扩增MED12第2、3和4外显子全长。
1.2.2MED12-Fc真核表达载体的构建①载体与PCR产物的酶切:根据美国Fermentas公司提供的双酶切条件,分别对pIRES2-EGFP-Fc载体、MED12-PCR产物进行HindⅢ和BamHⅠ双酶切,37℃水浴反应2 h。使用美国Axygen公司的DNA回收试剂盒,对酶切载体和PCR产物做纯化回收。②载体与基因的连接、转化DH5a:根据美国Fermentas公司T4 DNA连接酶说明书配置如下:10×T4 DNA连接酶Buffer 2μl、载体2μl、片段5μl、T4 DNA连接酶2μl,用双蒸水补足至20μl。将反应液混匀后22℃连接30 min,取10μl连接反应液转入DH5a感受态细胞中,冰浴10 min。42℃热激90 s,再冰浴2 min,加入700μl已灭菌的LB培养基。37℃震荡培养30 min后,均匀涂布含有卡那霉素的LB培养平板上,37℃培养过夜。③MED12-Fc阳性克隆的筛选和鉴定:挑取单菌落,用引物MED12-F1/MED12-R3进行菌落PCR扩增。然后进行琼脂糖凝胶电泳检测,筛选出阳性克隆。将阳性克隆菌液扩大培养,质粒小量抽提试剂盒提取质粒。抽提好的阳性克隆质粒送南京金斯瑞生物科技公司测序,进行序列比对。
1.2.3瞬时转染验证MED12-Fc真核表达载体的表达①待转染细胞预处理:用Hybridoma-SFM培养和传代293T细胞,将处于对数生长期的293T细胞用胰酶消化后稀释至4×105个/ml,铺于24孔细胞培养板,每孔500μl。37℃培养约1 d,当细胞贴壁面汇合至90%时进行转染。②DNA预处理:使用Sigma公司的无热源内毒素抽提试剂盒抽提MED12-Fc表达质粒,取1μg质粒加入50μl Optipro SFM混匀,将2μl LipofectamineTM2000 CD转染试剂混匀后室温孵育20min。③细胞转染:将DNA-转染试剂复合物50μl滴加至24孔板中,混匀后37℃培养箱培养48 h。④ELISA检测培养上清液:取瞬转培养上清液,用Abcam双抗夹心法ELISA检测试剂盒做检测,邻苯二胺显色后酶标仪读数。
1.2.4MED12-Fc稳定高表达细胞株的建立①CHO细胞预处理:用含10%血清的杜氏改良Eagle培养基(Dulbecco's modified eagle medium:nutrient mixture F-12,DMEM/F12)培养和传代CHO细胞。将处于对数生长期的CHO细胞用胰蛋白酶消化后稀释至2×106个/ml。②MED12-Fc表达质粒的酶切处理:取5μg MED12-Fc表达质粒,加3μlBstBⅠ限制性内切酶过夜。取100 ng酶切后的质粒琼脂糖凝胶电泳,检测酶切是否完全。③电转化CHO细胞,G418结合流式细胞仪荧光筛选稳定高表达细胞株:取2μg酶切线性的质粒与50μl CHO细胞悬液混匀,加入2 mm电击杯中,设定电穿孔仪电压800 V,电容25μF,电击时间10 ms,电穿2次。电穿后电击杯在冰上静置10 min,移液管转移细胞至含10%血清的DMEM/F12培养液的10 cm培养皿。2 d后待细胞生长状态恢复,用600μg/ml G418对阴性细胞进行杀灭。观察细胞状态,4 d换培养液1次,2周后用流式细胞仪分选出特别高荧光强度的细胞,并用极限稀释法种入96孔培养板。最终通过ELISA检测,筛选得到稳定的高表达细胞株。
1.2.5MED12-Fc融合蛋白的表达与纯化①MED12-Fc融合蛋白稳定细胞株的培养:选用1L的滚瓶连续培养,24 h后开始收集培养上清液,更换培养液。②MED12-Fc融合蛋白的纯化:将培养上清液用0.22μm滤膜过滤,滤液以1 ml/min的流速通过Protein A层析柱(购自美国通用电气公司),1×磷酸盐缓冲溶液(phosphate buffer saline,PBS)(pH=7.4)洗涤层析柱,甘氨酸(pH=2.5)洗脱融合蛋白,PBS(pH=7.4)透析得到纯品融合蛋白。③MED12-Fc融合蛋白的检测:取纯品融合蛋白做十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)检测。④蛋白质印迹实验鉴定MED12-Fc融合蛋白:MED12-Fc融合蛋白聚丙烯酰胺凝胶电泳后,电转凝胶上的蛋白至硝酸纤维膜上,牛血清白蛋白封闭膜,用碱性磷酸酶标记的特异性抗人IgG-Fc的单克隆抗体(美国Jackson公司)进行蛋白质印迹实验。蛋白质印迹实验的标准分子量蛋白购自南京金思瑞生物公司(货号:M00124)。
2 结果
2.1MED12基因第2、3和4外显子的PCR扩增
以健康人外周血基因组为模板,PCR扩增MED12基因第2、3和4外显子分别为105、192和156 bp(见图1)。以扩增的3个片段为模板,MED12-正向引物1、MED12-反向引物3为首尾引物,Overlap PCR扩增MED12第2、3、4外显子全长453 bp(见图2)。
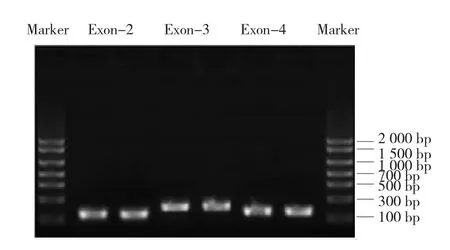
图1 MED12基因第2、3和4外显子的PCR扩增
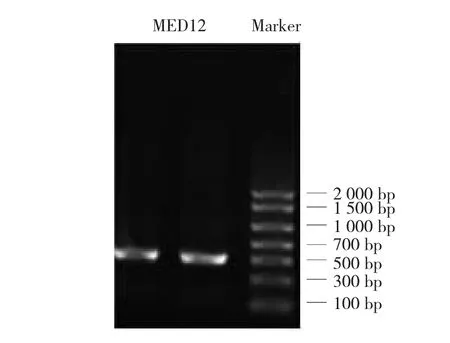
图2 Overlap PCR扩增MED12基因第2、3和4外显子全长
2.2阳性克隆的筛选和鉴定
挑取单菌落,用引物MED12-正向引物1/ MED12-反向引物3进行菌落PCR扩增,琼脂糖凝胶电泳(见图3)。抽提好的阳性克隆质粒送南京金斯瑞生物科技公司测序,经序列比对,序列完全正确,测序峰图见图4。最终,成功构建pIRES2-EGFP-Fc真核表达质粒为载体,得到重组人MED12-Fc真核表达质粒(见图5)。
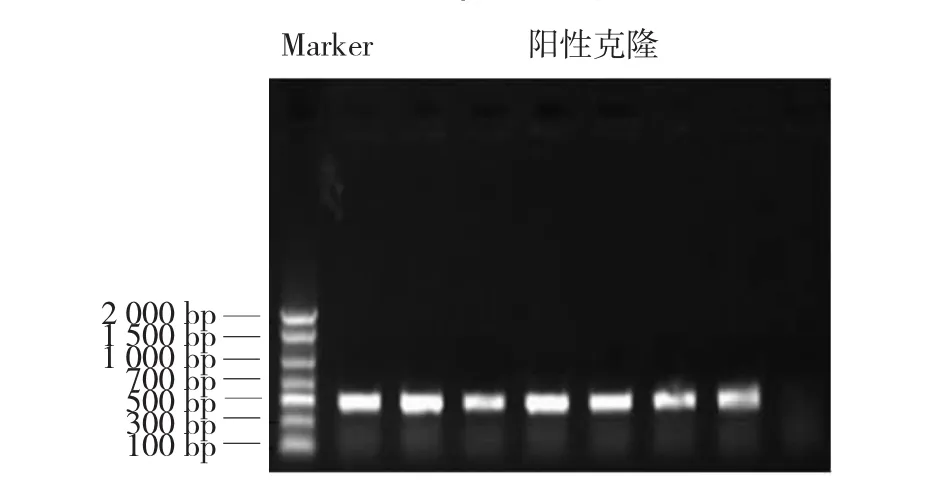
图3 阳性克隆的筛选

图4 MED12-Fc真核表达载体测序峰图
2.3流式细胞仪荧光筛选稳定高表达细胞株
2周后用流式细胞仪分选出其中高荧光强度的细胞,进行培养。见图6。
2.4瞬时转染验证MED12-Fc真核表达载体的表达
取瞬转培养上清,按照Abcam ELISA双抗夹心法检测试剂盒说明书进行操作,经邻苯二胺显色后酶标仪读数测定,构建的MED12-Fc真核表达载体具有很高的表达能力,表达量为7.5 mg/L。

图5 pIRES2-EGFP-Fc载体重组人MED12-Fc真核表达质粒示意图
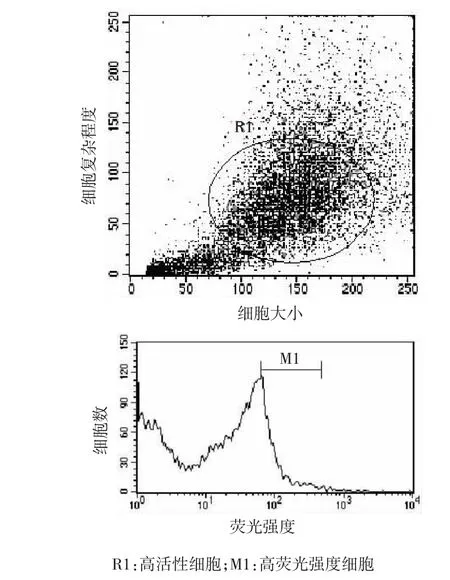
图6 流式细胞仪筛选稳定高表达细胞
2.5MED12-Fc融合蛋白的检测
取纯品融合蛋白做聚丙烯酰胺凝胶电泳检测,结果显示,未还原的融合蛋白分子量为60~70 kD,经过二硫苏糖醇(Dithiothreitol,DTT)还原后,分子量约为30~40 kD。综合糖基化因素,与预测值相符。见图7。

图7 MED12-Fc融合蛋白聚丙烯酰胺凝胶电泳
2.6蛋白质印迹实验鉴定MED12-Fc融合蛋白
蛋白质印迹实验结果显示,还原和未还原的融合蛋白都出现条带,且分子量与预期相符。见图8。

图8 MED12-Fc融合蛋白的蛋白印迹实验
3 讨论
MED12在所有真核生物细胞中表达,哺乳动物中,MED12基因定位于X染色体上[3]。人的MED12基因由45个外显子构成,跨度为25 kb并含有丰富的GC重复序列。MED12的转录活性与发育过程和组织分布相关。MED12由2 212个氨基酸组成,分为4个区域:①C-末端亮氨酸丰富的区域;②亮氨酸、丝氨酸丰富的区域(5’-LS);③脯氨酸、谷氨酰胺、亮氨酸丰富的区域(PQL);④Opa区域。研究认为MED12基因的5’-LS和PQL区域序列高度一致,而Opa区域序列相似性较差。目前对5’-LS和PQL区域功能的研究尚不明确,该区可能参与介导MED12与中介体复合物的联系;Opa区域则可能与Wnt信号通路的转录调控有关[1]。MED12在Wnt家族基因编码的糖蛋白细胞周期、细胞极性和迁移中发挥重要作用[2]。
MED12可以与不同的因子相互作用,调节生物活性。转录因子Nanog对胚胎干细胞多能性的维持起关键作用,MED12通过对Nanog基因的表达调控,激活或抑制转录依赖于启动子与细胞分化的状态[4]。MED12还参与Wnt信号通路。MED12可以与Wnt通路中的中心分子β-catenin相互作用,实现对靶基因的转录调控。通路激活后,β-catenin从细胞质易位到细胞核,MED12与中介体复合作用,激活下游基因的表达。MED12的功能不仅限于细胞核,细胞质中MED12与转化生长因子-β(transforming growth factor-β,TGF-β)R2抑制糖基化的不成熟相关,降低细胞质中TGF-βR2的水平[5]。最近较多的临床研究显示,子宫平滑肌瘤、子宫间质肿瘤、前列腺癌中存在MED12基因突变[6-11]。PÉROT等[12]报道,所有典型的平滑肌瘤中都有MED12基因蛋白表达,而40%非典型平滑肌瘤、50%恶性潜能未定的子宫平滑肌肿瘤和80%平滑肌肉瘤无MED12蛋白表达,推测MED12的存在与突变可能会抑制恶性肿瘤的发生。
本实验将克隆的MED12基因第2、3、4外显子片段与IgG的Fc片段连接起来。耦联的IgG Fc片段不仅可以发挥生物学效应,如抗体依赖细胞介导的细胞毒性作用、激活补体产生的细胞毒性作用,而且可以显著延长蛋白的半衰期。其可方便地通过protein A或protein G纯化,用抗人Fc片段抗体标记物可识别融合蛋白的Fc片段,从而鉴定融合蛋白识别的组织和细胞。目前有大量商品化的抗人IgG Fc二抗,融合蛋白中的Fc片段可使目的蛋白易于进行同位素标记和酶标记,从而进行检测。
本实验成功构建pIRES2-EGFP-Fc真核表达质粒为载体,构建重组人MED12-Fc真核表达质粒,转染CHO细胞进行筛选,建立稳定表达细胞株。夹心法ELISA结果证实该融合蛋白在细胞培养上清中呈分泌性表达。SDS-PAGE检测表明,融合蛋白的相对分子质量同预期结果一致。pIRES2-EGFP-Fc重组载体的构建及MED12-Fc融合蛋白的成功表达为下一步检测MED12-Fc融合蛋白的功能奠定基础。
[1]PHILIBERT RA,MADAN A.Role of MED12 in transcription and human behavior[J].Pharmacogenomics,2007,8(8):909-916.
[2]MILLER JR,HOCKING AM,BROWN JD,et al.Mechanism and function of signal transduction by the Wnt/beta-catenin and Wnt/Ca2+pathways[J].Oncogene,1999,18(55):7860-7872.
[3]KITANO T,SCHWARZ C,NICKEL B,et al.Gene diversity patterns at 10 X-chromosomal loci in humans and chimpanzees [J].Mol Biol Evol,2003,20(8):1281-1289.
[4]TUTTER AV,KOWALSKI MP,BALTUS GA,et al.Role for Med12 in regulation of Nanog and Nanog target genes[J].The Journal of Biological Chemistry,2009,284:3709-3718.
[5]HUANG S,HÖLZEL M,KNIJNENBIRG T,et al.MED12 controls the response to multiple cancer drugs through regulation of TGF-β receptor signaling[J].Cell,2012,151(5):937-950.
[6]WANG H,YE J,QIAN H,et al.High resolution melting analysis of MED12 mutations in uterine leiomyomas in Chinese patients[J].Genetic Testing and Molecular Biomarkers,2015,19(3): 162-166.
[7]YE J,WANG H,CHEN YB,et al.An investigation for mutation in MED12 of patients with hysteromyoma in Chinese han population[J].Oncology Letters,2015,9:2771-2774.
[8]MÄKINEN N,MEHINE M,TOLVANEN J,et al.MED12,the mediator complex subunit 12 gene,is mutated at high frequency in uterine leiomyomas[J].Science,2011,334:252-255.
[9]MÄKINEN N,HEINONEN HR,MOORE S,et al.MED12 exon 2mutationsarecommoninuterineleiomyomasfromsouth african patients[J].Oncotarget,2011,2(12):966-969.
[10]MCGUIRE MM,YATSENKO A,HOFFNER L,et al.Whole exome sequencing in a random sample of north American women with leiomyomas identifies MED12 mutations in majority of uterine leiomyomas[J].PLoS One,2012,7(3):33249-33251.
[11]BARBIERI CE.Exome sequencing identifies recurrent SPOP, FOXA1 and MED12 mutations in prostate cancer[J].Nat Genet, 2012,44(6):685-689.
[12]PÉROT G,CROCE S,RIBEIRO A,et al.MED12 alterations in both human benign and malignant uterine soft tissue tumors[J]. PLoS ONE,2012,7(6):40012-40015.
(申海菊 编辑)
Construction and expression of a recombinant fusion protein plasmid containing extracellular domain of human mediator of RNA polymeraseⅡtranscription 12 and Fc fragment*
Xing-li FU1,Ai-ping JU2,Xiao-lan MA3,Jun YE4
(1.Medical College,Jiangsu University,Zhenjiang,Jiangsu 212001,P.R.China;2.The People's Hospital of Zoucheng,Zoucheng,Shandong 273500,P.R.China;3.Hospital of Traditional Chinese Medicine of Taizhou City,Taizhou,Jiangsu 225300,P.R.China;4.The People's Hospital of Taizhou,Taizhou,Jiangsu 225300,P.R.China)
【Objective】To construct eukaryotic expression plasmid of recombinant human mediator of RNA polymeraseⅡtranscription 12(MED12)-Fc using the pIRES2-EGFP-Fc vector and express the fusion protein of MED12-Fc in CHO cells,finally to purify and characterize it.【Methods】According to the information in GenBank,the sequence of exons 2~4 of human MED12 gene was amplified from the genome.The target fragment was obtained by Overlap PCR and splicing and then inserted into the pIRES2-EGFP-Fc vector.Recombinant expression vector MED12-Fc was constructed and evaluated by DNA sequencing.The plas-mid of MED12-Fc was transiently transfected into 293T cells using lipofectin reagent for 48 h.Then,the supernatant was collected and detected with enzyme linked immunosorbent assay(ELISA)kit.The expression plasmid was transfected into CHO cells by electroporation,and the positive clone with high expression of fusion protein was selected through G418 resistant selection and flow cytometric fluorescence screening.The fusion protein secreted from positive clone was purified by protein-A affinity chromatography.The purified product was analyzed by SDS-PAGE.【Results】DNA sequencing and expression of transient transfection indicated the sequence of exons 2~4 of MED12 gene was correct and MED12-Fc was successfully constructed. The positive clone with high-expression fusion protein was obtained by electroporation,G418 resistant selection and flow cytometric fluorescence screening.The high-purity fusion protein was obtained by cell culture and protein A affinity chromatography.【Conclusions】The eukaryotic expression vector MED12-Fc has been successfully constructed and the high-purity MED12-Fc fusion protein has been obtained,which lay a foundation for further exploration of biological activity of MED12 protein.
mediator of RNA polymeraseⅡtranscription(MED)12;fusion protein;eukaryotic expression vector
Q782
A
1005-8982(2015)32-0014-06
2015-07-13
江苏省卫生厅面上项目(No:H201456);泰州市社会发展项目(No:TS2013009)
叶军,E-mail:yejun@gotofcm.com;Tel:13625171902
