探究氧化还原反应的学习与高考
2015-12-08余金华
余金华

氧化还原反应是中学化学中最重要的基本概念和基本理论之一,是中学化学学习的重点和难点之一,也是高考必考的内容,而且每年在高考中占的比重较大。本文试图通过今年的高考试题分析,归纳出氧化还原反应的考点,拟对今后的高考复习提出一些意见和建议,能对学生以后的高考复习有一些指导作用。
一、中学有关氧化还原反应的学习安排
首先氧化还原反应是学生所“熟悉”的化学知识,因为氧化还原反应是生产、生活中经常接触的,也是应用很多的或是很多要避免的反应。比如
硫酸工业、氯碱工业等,生活中的植物的光合作用、铅蓄电池、手机电池等等的使用;要避免的氧化还原反应有防止金属的生锈、将“84”消毒液与洁厕剂混用等等。熟悉了氧化还原反应原理,可以使生产、生活得更好。
但是氧化还原反应又是抽象的。考试并不是简单地说出生活中的氧化还原反应,而是从反应原理的角度来进行考查,因而氧化还原反应对中学生来说又是“陌生”的和“抽象”的。
由于以上的这些特点,中学教材中的氧化还原反应知识是比较难的重要的基本概念和基本理论知识。所以在中学教材中将氧化还原反应的知识分为了几个阶段进行学习,以便学生能层层推进,慢慢提高,让学生能更容易掌握氧化还原反应的相关知识,通过慢慢提高难度,让学生遵循“最近发展区”原理来进行氧化还原反应的学习。中学化学教材中将氧化还原反应分为三个阶段学习:一是在物质分类及物质的相互转化中,学习了氧化还原反应的概念,主要是从化合价的角度定义了氧化还原反应;二是在学习氯气的获取和性质之后,学习了氧化还原反应的其他相关概念,特别是学习了氧化还原反应中氧化剂、还原剂的判断,氧化性、还原性的判断和比较,氧化还原反应的分析方法——双线桥法,氧化还原反应的配平方法等;三是在必修2和化学反应原理两本教材中都学习了原电池和电解池的原理,它是氧化还原反应知识的应用。
二、氧化还原反应在高考中的考查
氧化还原反应是高考中的必考考点。不管是哪一个版本的教材,哪一个模式的高考试卷,都会有相当多的有关氧化还原反应的知识考查。比如,2015年江苏高考化学试题中关于氧化还原反应的考查(见表1)。
表1
题号知识点分值
3氧化还原反应中得、失电子数目的关系2分
4比较氧化还原反应中的氧化性、还原性2分
10氧化还原反应中的电子转移数目;
原电池反应的电极反应式2分
11氧化还原反应中的电子转移数目,
原电池、电解池反应原理4分
18.(1)、(4)氧化还原反应中电子得失守恒的应用,
计算氧化剂与还原剂的关系8分
19.(1)氧化还原反应方程式的书写3分
20.(2)(4)氧化还原反应中反应规律、方程式的书写9分由以上对2015年江苏高考化学试题分析,可以看出在化学试题中氧化还原反应的考查分值达到了30分之多。考查的覆盖面也很广,既考查了氧化还原反应的概念,也就是判断氧化剂、还原剂,并对氧化还原反应中氧化性和还原性进行了比较,又考查了氧化还原反应中的电子得失数目的守恒,并进行相应的计算,还考查了氧化还原反应方程式的书写,也即重点考查了氧化还原反应的配平;另外还考查了关于原电池、电解池的知识,也即考查了氧化还原反应知识的应用。
三、氧化还原反应知识的复习
氧化还原反应在高考题中的考查覆盖面很广,不仅考查概念,同时还要考查对概念的应用;不仅考查氧化还原反应中电子得失数目守恒,同时考查氧化还原反应方程式的书写,也即考查氧化还原反应的配平。那么在复习中就要不仅重视概念的复习,还要注意学会对氧化还原反应知识的应用。
1.氧化还原反应的基本概念
氧化还原反应表现出的特征是在反应中元素的化合价发生了升降,其实质是由于元素原子在反应过程中得到电子或是失去电子。把反应中失去电子的物质称之为还原剂,而失去电子的过程称为氧化反应(或被氧化),在反应中得到电子的物质称之为氧化剂,得到电子的过程称为还原反应(或被还原)。所以也可以说,氧化还原反应中电子是由还原剂转移给了氧化剂,这也是最易出错的地方,即电子的得和失是守恒的,还原剂的电子转移给了氧化剂,而不是氧化剂从其他地方得到了电子。所以在氧化还原反应中氧化剂得到的电子数就等于反应中还原剂失去的电子数。而这一原理在原电池或电解池中得到了更好的体现。原电池或电解池中两个电极分别发生氧化反应或还原反应。通过原电池的正、负极或电解池的阴、阳极得失电子数目相等即可得到氧化还原反应中的电子转移的情况。
2.氧化还原反应的分析方法
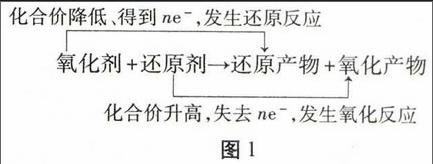
分析氧化还原反应的方法主要有两种,一种是单线桥法,一种是双线桥法。单线桥法是用一个箭头从还原剂指向氧化剂,并在箭头上标出电子转移的数目,它的关键点是从还原剂指向氧化剂。双线桥法是我们最常用的分析方法,它是分别用箭头表示出同种元素在反应前、后的元素化合价的变化情况,箭头的起点和终点是同一种元素,箭头上标出的是该元素在反应前后的化合价变化,或是该元素反应前后的电子得和失,同时要标出化合价是升高了还是降低了,电子是得到了还是失去了。其中元素化合价升高是因为失去了电子,其生成的产物称为氧化产物,而元素化合价降低是得到了电子,所得到的产物称为还原产物,如图1表示出双线桥分析法:
氧化剂+还原剂→还原化合价降低、得到ne-,发生还原反应产物+氧化合价升高,失去ne-,发生氧化反应化产物
图1
双线桥可以将氧化还原反应中的所有概念都联系起来。除了了解各个概念以外,还可以得到:
(1)氧化还原反应中的得、失电子数目是守恒的,即氧化剂得到的电子数等于还原剂失去的电子数;
(2)氧化还原反应中一定有氧化性的是氧化剂和氧化产物,一定有还原性的是还原剂和还原产物,并且氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。
3.氧化还原反应的配平
氧化还原反应的配平也是高考的必考试题。中学一般都是用化合价升降法配平氧化还原反应,即利用氧化还原反应中的化合价升高总数一定等于化合价降低总数。其具体的步骤是:
(1)正确写出反应方程式中各物质的化学式,并表示出元素的化合价特别是发生了元素化合价变化的元素化合价;
(2)用双线桥列出元素在反应前后的化合价变化,即标出1分子氧化剂完全被还原化合价降低的总数,1分子还原剂完全被氧化化合价升高的总数;
(3)求出(2)中标出的元素化合价变化数值的最小公倍数,则所乘的数值即为相应氧化剂和还原剂的系数,用原子守恒的方法算出氧化产物和还原产物的系数;
(4)用观察的方法(即原子数目守恒的方法)配出其他未参加氧化还原反应的物质的系数。
总之,氧化还原反应是中学化学最重要的知识点,在复习中必须理清各种概念,然后通过适当的训练提升解题
能力,这样就可以在高考中立于不败之地。
(收稿日期:2015-08-25)
