靶细胞提取联用HPLC-TOF MS法分析丹红注射液中的活性成分
2015-12-08吕燕妮钱贻崧付龙生
吕燕妮, 钱贻崧, 付龙生*
(1.南昌大学第一附属医院药学部,江西南昌330046;2.南昌大学转化医学研究院,江西南昌330031)
靶细胞提取联用HPLC-TOF MS法分析丹红注射液中的活性成分
吕燕妮1, 钱贻崧2, 付龙生1*
(1.南昌大学第一附属医院药学部,江西南昌330046;2.南昌大学转化医学研究院,江西南昌330031)
目的 应用靶细胞提取联用高效液相飞行时间质谱(HPLC-TOFMS)法分析丹红注射液中的活性成分,并对其防治疾病的分子机制做生物信息学预测。方法 将小胶质细胞(BV2细胞)和丹红注射液共孵育,HPLC-TOFMS法对所得的细胞破碎液进行分析,然后挖掘靶细胞结合成分中与脑卒中相关的蛋白和信号通路。结果 从BV2细胞破碎液中检测到丹参素、原儿茶醛、6-羟基红花黄色素A、迷迭香酸、丹酚酸B这5种丹红注射液中的水溶性成分,再构建靶细胞结合成分-蛋白网络,映射在Biocart信号通路中,包括Toll受体信号通路、神经营养因子、细胞凋亡、MAPK信号通路等,关联脑卒中发病机制的炎症、氧化应激方面。结论 该研究初步阐释了丹红注射液与脑卒中信号通路的关联。
丹红注射液;活性成分;BV2细胞;脑卒中;HPLC-TOFMS;生物信息学
丹红注射液为传统中药丹参与红花的复方制剂,具有活血化瘀、通脉舒络等功效,临床主适应症为中风、冠心病、缺血性脑病等,其疗效确切,已被医学界普遍接受[1]。在之前对丹红注射液信息数据库中成分的信息学研究时发现[2],其与固有免疫途径密切相关。近年来,固有免疫途径和脑缺血再灌注的关联已成为国际研究热点[3],脑缺血再灌注后引起的机体不协调与其释放炎症因子,
引起下游炎症反应密切相关[4]。丹红注射液的主适应症既为脑缺血再灌注,其靶蛋白又与固有免疫途径相关,推测可能通过固有免疫途径来防治脑缺血再灌注。小胶质细胞 (BV2细胞)[5]为固有免疫途径的感应细胞,脑缺血再灌注后启动固有免疫途径,BV2细胞活化,释放下游炎症信号因子,引起神经元损伤。本实验选取BV2细胞作为靶细胞,基于药物与细胞膜上的受体、酶等结合,或直接进入细胞内部而发挥作用的原理,采用高效液相飞行时间质谱(HPLC-TOF MS)法[6-7]对共孵育后的细胞破碎液进行分析,期冀发现丹红注射液在BV2靶细胞中的结合成分[8-10]。
中药复方由于其成分复杂性,在治疗多基因的复杂性疾病时,需要干预多个靶点和信号通路,以网络形式达到理想的药物治疗效果[11]。因此,网络药理学、系统生物学等生物信息学技术应运而生[12],其通过构建中药化学成分与体内靶标的相互关系网络,为药效成分和靶标筛选提供了新的研究手段。本实验进一步对丹红注射液在BV2靶细胞中的结合成分进行生物信息学分析,确定其中成分具体发挥作用的蛋白和信号通路,有助于药物活性成分的筛选及药效机理的研究,可为脑缺血再灌注机制提供新的研究途径。
1 实验部分
1.1 仪器与试剂 自动纯水机(美国Milipore公司);超低温冰箱(美国Thermo公司);Z-323 K冷冻干燥机(德国Herm Le公司);Agilent 1100 LC/ TOFMS系统,包括在线真空脱气机、高压二元梯度泵、盘式自动进样器、柱温箱、二极管阵列DAD检测器、电喷雾ESI离子源(美国Agilent公司)。数据采集及处理采用Agilent HPLC-TOF MS Software Ver.A.01.00及PE Sciex Analyst QS 1.1分析软件。甲醇为色谱纯 (南京化学试剂股份有限公司);乙腈为色谱纯 (美国 Tedia公司)。DMEM高糖培养基(美国GIBCO公司);小牛血清(美国Hyclone公司)。
1.2 实验方法
1.2.1 细胞培养 选用小鼠小胶质细胞(BV2细胞),用DMEM高糖培养基 (含10%小牛血清、青霉素以及链霉素)在培养瓶中培养,隔天更换,生长2~3 d后融合,磷酸盐缓冲液 (PBS)洗涤两次,加入新的培养基,将细胞轻轻吹下,形成细胞悬液后进行计数。以1×105个/m L细胞密度进行传代,在倒置相差显微镜下观察,选择处于指数期状态的细胞供实验用。
1.2.2 靶细胞提取丹红注射液中的成分 选择处于指数生长期的BV2细胞,加入无血清的DMEM溶液,在37℃、5%CO2条件下同化1 h,弃除DMEM溶液,加入含终质量浓度为6.25μL/L丹红注射液的无血清的DMEM溶液,在37℃、5% CO2条件下与细胞共孵育24 h,倒掉药液,用生理盐水冲洗4次,取第4次洗脱液1 mL备用。洗涤后的细胞在-80℃下反复冻融3次,加乙醇10 mL破碎,破碎液减压挥干,用超纯水0.5 m L溶解,10 000 r/min离心10 min,取上清液备用。将第4次洗脱液和加药后的细胞破碎液上清液进HPLCTOFMS作检测。然后,以同样方法,用无血清的DMEM溶液代替药液作空白细胞的破碎液。
1.2.3 色谱及质谱条件 丹红注射液 (批号为14081002,10 mL/支,菏泽步长制药有限公司)用超纯水按1∶5(V/V)稀释,0.22μm滤膜过滤,取过滤液10μL,进HPLC-TOF MS作分析。采用AlltimaTM C18色谱柱(250 mm×4.6 mm,5μm);流动相为0.4%甲酸水溶液 (A)-乙腈 (B),梯度洗脱(0~20 min,3%~12%B;20~30 min,12%~20%B;30~55 min,20%~38%B;55~75 min,38%~80%B);体积流量1 m L/min。质谱参数为负离子模式检测,m/z100~3 000;干燥气温度320℃;体积流量8 L/min;雾化压力40 psig;毛细管负离子模式;电压3.5 kV;进样量10 μL。将加药细胞破碎液和最后一次洗脱液的样品经0.45μm滤膜过滤后,用HPLC-TOFMS检测。
1.2.4 文本挖掘、丹红注射液靶细胞结合成分-蛋白网络及EKGG信号通路的映射 文本挖掘采用Agilent Literature Search(ALS)软件,以丹红注射液靶细胞结合成分的英文名为词条,从文献句子中解析出蛋白名,作为第一部分蛋白集[13-14];在Genecards数据库中搜索与脑卒中“stroke”相关的蛋白,作为第二部分蛋白集。然后,将两部分蛋白集进行交集,得到与两者相关的蛋白集,并在Cytoscape软件中建立丹红注射液靶细胞结合成分-蛋白网络,将网络中的蛋白进行Biocart信号通路的映射,得到相关信号通路。
2 结果与讨论
2.1 空白对照组 丹红注射液的总离子流图见图1,空白细胞破碎液的总离子图 (TIC)见图2A,由于未检测到丹红注射液中的成分,故排除空白细胞的干扰因素。第4次洗脱液的总离子流图见图
2B,未发现明显响应信号,说明细胞膜上的成分已冲洗干净,确定下一步检测成分应为与细胞膜结合或进入细胞的成分。
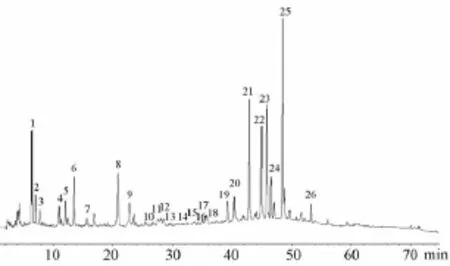
图1 丹红注射液的总离子流图Fig.1 Total ion current chromatogram of Danhong Injection
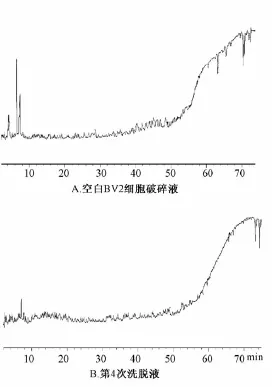
图2 空白BV2细胞破碎液和第4次洗脱液的总离子流图Fig.2 Total ion current chromatograms of blank BV2 cell disruption sap and the fourth eluent
2.2 BV2细胞膜与丹红注射液相互作用的研究
在加药的BV2细胞破碎液中,用提取离子流图定性鉴别丹红注射液中丹参素、原儿茶醛、6-羟基红花黄色素A、迷迭香酸、丹酚酸这5种水溶性成分,见图3。其中,保留时间13.5 min对应6号峰,鉴定为丹参素;保留时间20.8 min对应8号峰,鉴定为原儿茶醛;保留时间26.3 min对应10号峰,鉴定为6-羟基红花黄色素 A;保留时间46.5 min对应23号峰,鉴定为迷迭香酸;保留时间53.2 min对应25号峰,鉴定为丹酚酸B。另外,检测到的成分未在空白对照组和加药细胞最后一次洗脱液中发现,为细胞膜结合和进入细胞的成分。
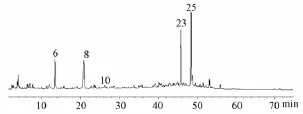
图3 加药后BV2细胞破碎液的总离子流图Fig.3 Total ion current chromatogram of BV2 cell disruption sap after adm inistration
2.3 丹红注射液靶细胞结合成分-蛋白网络及信号通路的分析 在ALS系统中,分别以丹红注射液中5个活性成分丹参素、原儿茶醛、6-羟基红花黄色素A、迷迭香酸、丹酚酸的英文名进行搜索,分别得到丹参素蛋白918个、原儿茶醛蛋白524个、6-羟基红花黄色素A蛋白256个A、迷迭香酸蛋白343个、丹酚酸B蛋白931个,去除重复后,共得到蛋白2 043个。在Genecards数据库系统中,输入 “stroke”后得到相关蛋白1 093个,将两个系统所得到的蛋白进行交集,最终得到与脑卒中相关的蛋白共54个。其中,丹参素蛋白24个、原儿茶醛蛋白23个、6-羟基红花黄色素A蛋白12个A、迷迭香酸蛋白35个、丹酚酸蛋白37个,与蛋白都有相互作用。根据ALS系统所提供的蛋白间关联,最终在Cytoscape软件中可视化建立丹红注射液靶细胞结合活性成分-蛋白相互作用网络,见图4。将蛋白映射在Biocart信号通路上,包括Toll样受体信号通路、神经营养因子信号转导通路、细胞凋亡信号通路、MAPK受体信号通路等。由图可知,Toll样受体通路及其蛋白TLR4、Myd88受体、NFκB信号通路及其蛋白NFκB1、RELA受体均涉及炎症方面,IL6、CYP2C9、IL10蛋白所在的细胞因子通路亦涉及炎症方面,MAPK14、MAPK8、MAPK9蛋白等MAPK信号通路涉及氧化应激方面,MAPK8、FOS、JUN蛋白所在的神经生长因子通路涉及神经营养方面,而HMOX1、TP53、BCL2 L1蛋白所映射的细胞凋亡途径涉及神经元细胞凋亡方面,它们都与脑卒中的发生和发展密切相关。
3 讨论
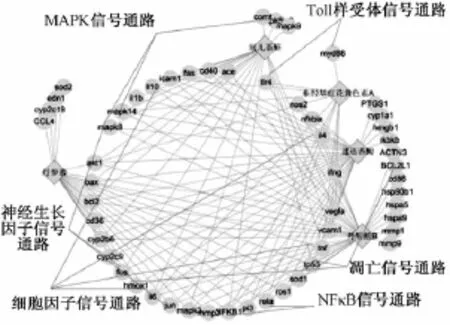
图4 丹红注射液靶细胞结合成分-蛋白信号通路网络Fig.4 Constituents combined w ith target cells-protein signaling pathway netw ork of Danhong Injection
中药复方具有多成分、多靶标的特点,研究其防治疾病的作用机制时,如何识别其活性成分,如何选取作用靶标和信号通路进行验证,成为阐释中药复方作用机制的关键问题之一。对于活性成分不明确的中药复方,可通过靶细胞进行筛选,并针对这些成分进行有目的地分离和药理活性筛选,为含有复杂成分的中药药效物质研究提供新的思路。本实验中,丹红注射液与BV2靶细胞共孵育,HPLCTOFMS法对共孵育后的细胞破碎液进行分析,筛选出丹红注射液作用于BV2细胞的丹参素、原儿茶醛、6-羟基红花黄色素A、迷迭香酸、丹酚酸这5种活性成分,为进一步研究中药复方药效提供物质基础。
以上述5种活性成分及其靶标构建成分-蛋白相互作用网络,发现其相互间既有共同作用蛋白,又各有差异。如丹参素、原儿茶醛、丹酚酸可共同作用于ACE受体,丹参素、原儿茶醛、迷迭香酸、丹酚酸B可共同作用于MAPK3受体,并且所有成分均可作用于NFκB1受体。6-羟基红花黄色素A和和丹酚酸B虽共同作用于TLR4受体,然而前者可通过激活TLR4下游的MYD88受体而发挥作用,而后者可作用于BCL2L1受体关联细胞凋亡途径,另外原儿茶醛可作用于细胞间黏附分子-1 ICAM1受体而发挥作用。由此表明,以上5种活性成分既可通过共同蛋白发挥作用,也可通过其各自蛋白协同作用发挥防治疾病的功效,如丹参素[15]、6-羟基红花黄色素A[16]、迷迭香酸[17]、丹酚酸B[18]均与脑缺血疾病关联,原儿茶醛在心肌缺血再灌注损伤模型上有相关研究[19],并且其作用的NOS2受体与脑卒中有潜在关联[20],也可作为防治脑卒中疾病的靶标。
之前笔者以信息学方式,基于KEGG信号通路来预测信号通路与固有免疫途径相关,KEGG信号通路能提供各个基因间的上下游调控网络,而Biocarta信号通路着重于蛋白质生物学通路,与KEGG不同,它以信号转导通路为主要部分,能够预测具体发挥作用者。Biocart信号通路映射后发现,其中Toll样受体信号转导通路[21]在固有免疫过程中起着重要作用,有文献证实其与脑缺血再灌注的机制相关[22]。Toll样受体蛋白、Nod样受体、视黄酸诱导蛋白RIG-I样受体以及C型凝集素受体共同组成了固有免疫的模式识别受体[23-24],其防治感染性中枢神经系统疾病还可能与调节固有免疫识别途径有关[25]。神经营养因子信号转导通路可调节突触生长[26],保护血管平滑肌[27]。其余细胞凋亡、MAPK信号通路[28]与脑缺血再灌注损伤的神经保护及抑制炎症指标相关,可控制炎症进程,防止其因子对脑缺血再灌注进行损害。靶细胞结合HPLC-TOF MS法可以为含有复杂成分的中药复方与靶细胞的相互作用提供有效成分,而生物信息学分析初步为揭示其防治疾病的分子机制提供方向,为进一步实验提供基础,也为研究成分更为复杂的中药复方作用机理提供思路方法和研究借鉴。
[1] 吴嘉瑞,马利彪,董 玲,等.丹红注射液治疗心脑血管病的临床应用进展[J].中国医药指南,2012,10(19):92-93.
[2] 吕燕妮,魏筱华,肖 频.丹红注射液作用机制的计算机系统生物学研究[J].中国中药杂志,2015,40(3):538-542.
[3] 陈莹莹,孙光玲,兰 倩,等.Toll样受体与脑缺血[J].现代生物医学进展,2014,4(12):2369-2375.
[4] Nakajima K,Kohsaka S.Microglia:neuroprotective and neurotrophic cells in the central nervous system[J].Curr Drug Targets Cardiovasc Haematol Disord,2004,4(1):65-84.
[5] 景浩然,胡利民,王少峡,等.丹红注射液及其活性组分对脂多糖诱导的小胶质细胞NO分泌的抑制作用[J].现代药物与临床,2013,28(3):285-287.
[6] Xie Y Y,Xiao X,Luo JM,et al.Integrating qualitative and quantitative characterization of traditional Chinesemedicine injection by high-performance liquid chromatography with diode array detection and tandem mass spectrometry[J].J Sep Sci,2014,37(12):1438-1447.
[7] 罗娟敏,肖 雪,梁琼麟,等.丹红注射液指纹图谱研究[J].中成药,2011,33(8):1277-1280.
[8] 裴 玉,肖 雪,付 婵,等.柱前衍生化HPLC法测定丹红注射液氨基酸[J].中成药,2012,34(9):1703-1707.
[9] 祝艳斐,毕志明,刘承伟,等.内皮细胞提取和高效液相色
谱-电喷雾飞行时间质谱联用预测玄参中的活性成分[J].中国药科大学学报,2008,39(3):228-231.
[10] 董倩倩,李 萍,宋 越,等.靶细胞提取和高效液相飞行时间质谱联用分析预测丹参中的活性成分[J].分析化学,2007,35(5):648-652.
[11] Yildirim M A,Goh K I,Cusick M E,et al.Drug-target network[J].Nat Biotechnol,2007,25(10):1119-1126.
[12] Yang M,Chen JL,Xu LW,etal.Navigating traditional Chinese medicine network pharmacology and computational tools[J].Evid Based Complement Alternat Med,2013,2013:e731969.
[13] 李 翔,吴磊宏,范骁辉,等.复方丹参方主要活性成分网络药理学研究[J].中国中药杂志,2011,36(21):2911-2915.
[14] 朱艳芳,朱 伟.生脉散血中移行成分分子靶标的计算机系统生物学预测[J].中国实验方剂学杂志,2012,18(4):278-282.
[15] 艾进超,周惠芬,舒明春,等.丹参素在局灶性脑缺血大鼠体内药动学-药效学相关性研究[J].中国中药杂志,2014,39(14):2751-2755.
[16] 姜 华.羟基红花黄色素A对大鼠脑缺血-再灌注损伤的保护作用及机制[J].中药材,2013,36(3):462-464.
[17] 方 蕾.丹酚酸B抑制小鼠脑缺血再灌注炎症反应的机制研究[D].北京:北京中医药大学,2009.
[18] 崔海瑛.迷迭香酸对局灶性脑缺血再灌注损伤小鼠的脑保护及作用机制研究[D].石家庄:河北医科大学,2014.
[19] 袁晓峰,王 军,周 丹.原儿茶醛对大鼠心肌缺血/再灌注损伤的保护作用研究[J].陕西中医,2013,34(8):1091-1093.
[20] Garcia-Bonilla L,Moore JM,Racchumi G,et al.Inducible nitric oxide synthase in neutrophilsand endothelium contributes to ischemic brain injury in mice[J].J Immunol,2014,193(5):2531-2537.
[21] 刘 晔.Toll样受体与固有免疫的进化[J].中国医学科学院学报,2002,24(4):433-436.
[22] Lan L,Tao J,Chen A,et al.Electroacupuncture exerts antiinflammatory effects in cerebral ischemia-reperfusion injured rats via suppression of the TLR4/NF-κB pathway[J].Int J Mol Med,2013,31(1):75-80.
[23] Nakamura N,Lill JR,Phung Q,et al.Endosomes are specialized platforms for bacterial sensing and NOD2 signalling[J]. Nature,2014,509(7499):240-244.
[24] 林文龙,王晓健.NOD样受体蛋白炎症体亚家族研究进展[J].细胞与分子免疫学杂志,2013,29(5):549-552.
[25] Carty M,Reinert L,Paludan S R,et al.Innate antiviral signalling in the central nervous system[J].Trends Immunol,2014,35(2):79-87.
[26] Ballard S L,Miller D L,Ganetzky B.Retrograde neurotrophin signaling through Tollo regulates synaptic growth in Drosophila[J].JCell Biol,2014,204(7):1157-1172.
[27] Han D,Scott E L,Dong Y,et al.Attenuation ofmitochondrial and nuclear p38αsignaling:A novel mechanism of estrogen neuroprotection incerebral ischemia[J].Mol Cell Endocrinol,2015,400:21-31.
[28] Jiang M,Li J,Peng Q,et al.Neuroprotective effects of bilobalide on cerebral ischemia and reperfusion injury are associated with inhibition of pro-inflammatory mediator production and down-regulation of JNK1/2 and p38MAPK activation[J].J Neuroinflammation,2014,11:167-184.
Analysis of bioactive constituents in Danhong Injection by target cell extraction combined with HPLC-TOF MS
LV Yan-ni1, QIAN Yi-song2, FU Long-sheng1*
(1.The First Affiliated Hospital of Nanchang University,Nanchang 33OO46,China;2.Instituteof Translational Medicineof Nanchang University,Nanchang 33OO31,China)
AIM To analyze the bioactive constituents in Danhong Injection by target cell extraction and HPLC-TOF MS and predict its molecular mechanism of prevention and treatment of disease via bioinformatics. METHODS Microglia(BV2 cells)and Danhong Injection were incubated together,the obtained cell disruption sap was analyzed by HPLC-TOFMS.Then the proteins and signaling pathways related to stroke weremined in the constituents combined with target cells.RESULTS Five water-soluble constituents(danshensu,protocatechuic aldehyde,6-hydroxysafflor yellow A,rosmarinic acid and salvianolic acid B)in Danhong Injection were extracted from the BV2 cell disruption sap.The constituents combined with target cells-protein network were then constructed and mapped onto Biocart pathways(Toll-like receptor signaling pathway,neurotrophic factor,apoptosis,MAPK signaling pathways,etc.),which were associated with inflammation and oxidative stress in the mechanism of stroke.CONCLUSION This research preliminarily demonstrates the relationship between Danhong Injection and signaling pathways related with stroke.
Danhong Injection;bioactive constituents;BV2 cells;stroke;HPLC-TOFMS;bioinformatics
R284.1
A
1001-1528(2015)12-2691-05
10.3969/j.issn.1001-1528.2015.12.026
2015-02-10
吕燕妮(1986—),女,博士生,研究方向为临床药理学和信息学。E-mail:lvyanni@126.com
*通信作者:付龙生,男,临床药师。E-mail:305260242@qq.com
