电导率测定法在中药有效成分提取过程中的应用研究
2015-12-08孙冬梅王洛临
孙冬梅, 陈 卉,2*, 王洛临, 陈 朋,2, 周 蓉,2, 谢 媛,2
(1.广东省中医药工程技术研究院广东省中医药研究开发重点实验室,广东广州510095;2.广州中医药大学,广东广州510405)
电导率测定法在中药有效成分提取过程中的应用研究
孙冬梅1, 陈 卉1,2*, 王洛临1, 陈 朋1,2, 周 蓉1,2, 谢 媛1,2
(1.广东省中医药工程技术研究院广东省中医药研究开发重点实验室,广东广州510095;2.广州中医药大学,广东广州510405)
目的 研究电导率测定法在苦参、全蝎、土鳖虫等中药有效成分提取过程中的应用。方法 采用电导率法测定苦参、全蝎、土鳖虫等中药有效成分提取过程中的电导率变化情况,考察提取液电导率值与有效成分含有量随提取时间的变化规律,以及两者之间的定量关系。结果 苦参提取液电导率值与生物碱总含有量,全蝎、土鳖虫提取液电导率值与蛋白多肽含有量均呈线性相关,而且两者随提取时间变化的规律相似。结论 该方法可以快速、准确地指示有效成分的提取规律和提取终点,在中药提取工艺中具有一定应用价值。
电导率;中药;生物碱;蛋白多肽;提取
苦参碱和氧化苦参碱属于生物碱类化合物,是中药苦参的药理活性成分[1-2],其定量测定主要采用高效液相色谱法[3-5],但样品处理过程复杂、操作程序繁琐、对仪器设备要求高,而虫类药全蝎、土鳖虫的主要有效成分为蛋白多肽类[6-11],其含有量测定方法大多都存在样品处理时间长、有毒试剂使用量大等缺点[12-13]。因此,寻找一种简便、快速并能准确监测中药材提取过程的新方法至关重要。
与传统分析方法相比,电导率测定法具有分析快速、操作简便、不消耗样品与试剂等特点,其分析结果能真实、准确地反映提取液中有效成分的提取规律及提取终点[14-15]。所以,本实验应用电导率法对苦参药材提取过程中苦参碱和氧化苦参碱的含有量变化情况进行测定,考察了电导率值与有效成分含有量之间的定量关系,并进一步探讨了该方法在虫类药全蝎、土鳖虫有效成分提取过程中的应用。
1 仪器与试药
Agilent1200高效液相色谱仪(美国Agilent公司);UV-2550紫外可见分光光度计 (日本岛津公司);DDS-307A电导率仪 (上海精密科学仪器有限公司);XS205分析天平(瑞士Mettler Toledo公司);JJ300电子天平 (常熟市双杰测试仪器厂);DZF-6050真空干燥箱 (上海一恒科学仪器有限公司);KQ5200DE数控超声波清洗器 (昆山市超声仪器有限公司);LXJ-IIB离心机(上海安亭科学仪器厂);RE 5298 A旋转蒸发仪 (上海亚荣生化仪器厂);KW-1000DC数显恒温水浴锅 (金坛市科析仪器有限公司)。
苦参、土鳖虫、全蝎 (盐制,含盐量约为15%~17%,广东省药材公司中药饮片厂),经广东省中医药工程技术研究院王洛临主任中药师鉴定,均符合 《中国药典》2010年版一部相关项下规定。苦参碱 (批号110805-200508)、氧化苦参碱 (批号110780-201007,含92.3%C15H24N2O2)对照品(中国食品药品检定研究院)。Lowry法蛋白含量检测试剂盒 (南京凯基生物科技发展有限公司,批号KGP420)。乙腈、无水乙醇均为色谱纯 (德国Merck公司);水为超纯水;其他试剂均为分析纯。
2 方法与结果
2.1 成分定量测定方法
2.1.1 苦参碱、氧化苦参碱的测定
2.1.1.1 色谱条件与系统适用性试验 Waters Spherisorb©NH2色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈-无水乙醇-3%磷酸溶液(80∶10∶10);检测波长为220 nm;体积流量为1.0 mL/min。理论板数按氧化苦参碱峰计算,应不低于2 000。
2.1.1.2 对照品溶液的制备 精密称取苦参碱、氧化苦参碱对照品适量,置于25 mL量瓶中,加乙腈-无水乙醇 (80∶20)混合溶液至刻度,摇匀,制成每lmL分别含苦参碱389.2μg、氧化苦参碱387.3μg的对照品贮备液。再分别精密吸取两种贮备液1、5 mL,混合后置于10 mL量瓶中,加乙腈-无水乙醇 (80∶20)混合溶液至刻度,摇匀,即得每l m L含苦参碱38.92μg、氧化苦参碱193.65μg的混合对照品溶液。
2.1.1.3 标准曲线的绘制 取混合对照品溶液1、2、4、8、12、16、20μL,在 “2.1.1.1”项条件下进样,记录色谱图,测定峰面积。以苦参碱的进样量为横坐标 (X1),峰面积为纵坐标 (Y1)绘制标准曲线图,得回归方程Y1=0.491 1X1-0.076 7,r=0.999 9,表明在38.92~778.4 ng范围内苦参碱的峰面积与进样量呈良好的线性关系;以氧化苦参碱的进样量为横坐标 (X2),峰面积为纵坐标(Y2)绘制标准曲线图,得回归方程Y2=0.550 0 X2-0.013 5,r=0.999 9,表明在 193.65~3 873.0 ng范围内,氧化苦参碱的峰面积与进样量呈良好的线性关系。
2.1.1.4 供试品溶液的制备 精密吸取各时间点提取液5 mL,置于具塞锥形瓶中,60℃下真空干燥,精密加入浓氨试液0.5 mL和三氯甲烷20 mL,密塞,称定重量,超声处理 (功率250 W、频率33 kHz)30 min,放冷,再称定质量,三氯甲烷补
足减失的重量,摇匀,滤过。精密量取续滤液5 m L,加到中性氧化铝柱 (100~200目,5 g,内径1 cm)上,依次以三氯甲烷、三氯甲烷-甲醇(7∶3)混合溶液各20 mL洗脱,合并洗脱液,浓缩回收溶剂至干,残渣加无水乙醇溶解,转移至10 mL量瓶中,加无水乙醇至刻度,摇匀,即得。
2.1.1.5 测定方法 分别精密吸取供试品溶液各10μL,注入液相色谱仪,测定并计算提取液中生物碱的总含有量。空白溶剂、混合对照品及供试品的色谱图见图1。
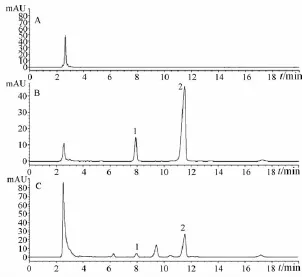
图1 苦参HPLC图谱Fig.1 HPLC chromatogram s of Sophorae flavescentis Radix
2.1.2 蛋白多肽类成分的测定 凯基Lowry法蛋白含量检测试剂盒测定全蝎、土鳖虫提取液中蛋白多肽类成分。
2.2 提取方法
2.2.1 苦参药材提取 称取一定粒度的苦参药材适量,置于圆底烧瓶中,加入一定体积的提取溶剂,加热回流提取4 h。按规定时间点定时吸取样液,4 000 r/min离心10 min以除去样液中干扰电导率和成分定量测定的杂质微粒,30℃恒温下测定样品溶液的电导率值,并用HPLC法测定样品溶液中有效成分的含有量。然后,绘制提取介质电导率值、有效成分含有量随提取时间变化的提取曲线。
2.2.2 全蝎、土鳖虫提取 称取一定粒度的全蝎(脱盐)、土鳖虫适量,置于圆底烧瓶中,加入一定体积的提取溶剂,60℃下水浴加热提取4 h。按规定时间点定时吸取样液,4 000 r/min离心10 min以除去样液中干扰电导率和成分定量测定的杂质微粒,30℃恒温下测定样品溶液的电导率值,并用凯基Lowry法蛋白含量检测试剂盒测定样品溶液中有效成分的含有量。然后,绘制提取介质电导率值、有效成分含有量随提取时间变化的提取曲线。
2.3 电导率测定法对苦参有效成分提取规律的表征 根据不同时间点苦参提取液的电导率与有效成分含有量的测定结果,绘制提取时间分别为60、120、180、240 min时的电导率值、生物碱总含有量与提取时间关系的曲线,结果见图2。由图可知,随着提取时间的增加,提取液电导率值、生物碱总含有量均呈增加趋势,而且两者的变化情况具有相同的规律,即提取前60 min电导率值与生物碱总含有量均增加迅速,60 min后逐渐趋于平缓,180 min后提取过程达到恒定。
2.4 电导率值与苦参有效成分之间的定量关系
根据不同时间点苦参提取液的电导率与有效成分含有量的测定结果,绘制提取液电导率值与生物碱总含有量关系的曲线,并对其进行线性拟合,发现电导率值与生物碱总含有量呈线性相关,相关系数r=0.999 6,见图3。
2.5 电导率测定法在虫类药物提取过程中的应用
根据不同时间点全蝎、土鳖虫提取液的电导率与有效成分含有量的测定结果,分别绘制两者的电导率值、蛋白多肽类成分含有量与提取时间关系的曲线,结果见图4。由图可知,虫类药物提取液的电导率值、蛋白多肽含有量随提取时间的变化规律也相同。
然后,分别绘制全蝎、土鳖虫提取液的电导率值与蛋白多肽含有量关系的曲线,并对其进行线性拟合,考察两者的定量关系,发现全蝎、土鳖虫提取液电导率值与蛋白多肽含有量均呈线性相关,相关系数分别r=0.998 6、0.999 4,见图5。
3 讨论
随着提取时间的变化,提取液的电导率值与有效成分的含有量具有相同的变化规律。因此,采用电导率测定法可以快速、准确地指示有效成分的提取过程和提取终点,既确保了有效成分提取完全,又及时指示提取结束,提高了效率,解决了中药有效成分传统分析方法存在的分析周期长、提取终点判断滞后等问题。
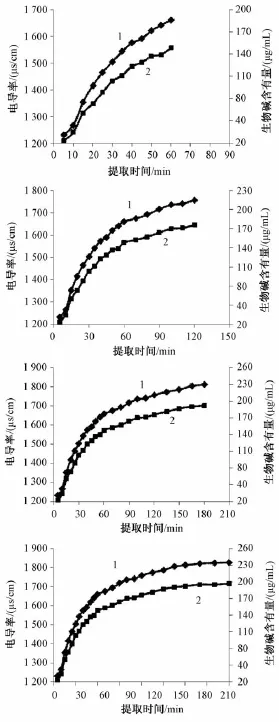
图2 苦参有效成分提取过程中电导率值、生物碱总含有量随提取时间的变化规律Fig.2 Variations of specific conductance values and total alkaloid contents w ith extraction tim e in the extraction of effective constituents from Sophorae flavescentis Radix
通过研究不同中药品种在不同提取条件下的电导率-提取时间规律以及电导率值-有效成分含有量之间的对应关系,使电导率测定法可以快速、直观地反映提取过程中有效成分的含有量及其变化规律,说明该方法不仅能够应用于植物药有效成分的提取,而且对动物药也有相同的规律。因此,可以利用电导率测定法优化中药材提取工艺条件。
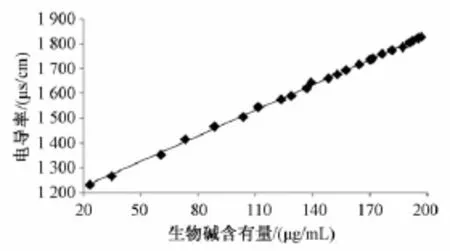
图3 苦参提取液中电导率值与生物碱总含有量间的关系Fig.3 Relationship between specific conductance values and total alkaloid contents in Sophorae flavescentis Radix extract
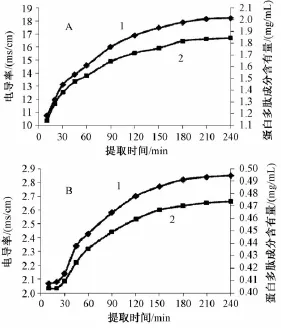
图4 虫类药物有效成分提取过程中电导率值、蛋白多肽含有量随提取时间的变化规律Fig.4 Variations of specific conductance values and protein polypeptide contents w ith extraction time in the extraction of effective constituents from insect drugs
综上所述,电导率测定法不仅适用于生物碱、蛋白多肽类成分的提取工艺,而且在黄酮、皂苷类成分提取过程中也得到了证实,为中药材提取分离过程的表征提供一种可靠的方法。
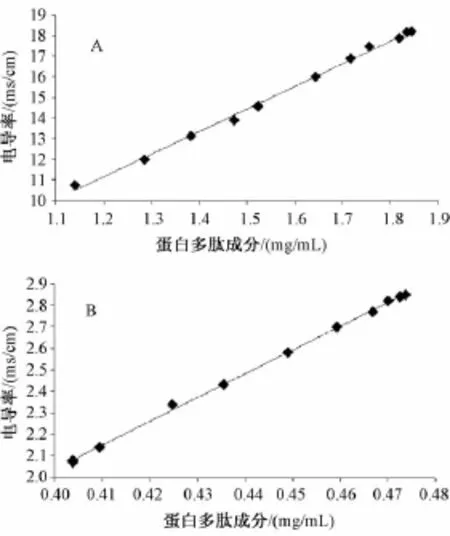
图5 虫类药物提取液电导率值与蛋白多肽含有量间的关系Fig.5 Relationships between specific conductance values and protein polypeptide contents in insect drug extracts
[1] 顾关云,肖年生,蒋 昱.苦参的化学成分、生物活性和药理作用[J].现代药物与临床,2009,24(5):265-271.
[2] 张 翅,马 悦,高慧敏,等.苦参化学成分研究进展[J].中国实验方剂学杂志,2014,20(4):205-214.
[3] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:188-189.
[4] 涂瑶生,李绍林,孙冬梅,等.星点设计-效应面法优选苦参提取工艺[J].中国实验方剂学杂志,2012,18(5):34-37.
[5] 郭德祥,郭亚楠,李向阳.苦参碱的提取纯化工艺研究[J].中国兽药杂志,2014,48(3):24-26.
[6] 王凤霞,吉爱国.药用土鳖虫化学成分及药理作用研究进展[J].中国生化药物杂志,2009,30(1):61-64.
[7] 高 鹏.土鳖虫不同工艺提取物抗凝作用的比较研究[J].时珍国医国药,2012,23(7):1816-1817.
[8] 刘 丹,李兴暖,秦仲君,等.土鳖虫多肽的制备及免疫调节作用研究[J].中药材,2012,35(9):1382-1385.
[9] 雷田香,彭延古,徐爱良.中药全蝎的研究进展[J].湖南中医学院学报,2006,26(4):60-61.
[10] 侯 林,田景振,姬 涛.全蝎匀浆提取工艺研究[J].中成药,2011,33(10):1813-1815.
[11] 罗 跃,彭延古,易小明.全蝎的化学成分及其作用的研究进展[J].湖南中医药大学学报,2008,28(3):78-80.
[12] 李 玲,洪战英,董 昕,等.多肽类药物的质量控制及药动学研究进展[J].药学服务与研究,2013,13(6):405-409.
[13] 胡晓静,孔成诚,方成武,等.不同提取方法盐全蝎水溶性蛋白含量对比研究[J].中国医药科学,2011,1(5):38-39.
[14] 严赞开.电导法测定橙皮苷[J].安徽农业科学,2007,35(9):2575-2577.
[15] 张 鹏,高峻峰,孟 硕,等.电导率测定法在线监测栀子提取物大孔树脂柱分离工艺[J].中国实验方剂学杂志,2006,26(4):60-61.
App lication of specific conductancem ethod in the extraction of effective constituents from traditional Chinesemedicines
SUN Dong-mei1, CHEN Hui1,2*, WANG Luo-lin1, CHEN Peng1,2, ZHOU Rong1,2, XIE Yuan1,2
(1.Guangdong Provincial Engineering and Technology Research Institute of ChineseMedicine,Guangdong Provincial Key Laboratory of ChineseMedicine Research and Development,Guangzhou 51OO95,China;2.Guangzhou University of ChineseMedicine,Guangzhou 51O4O5,China)
AIM To study the application of specific conductancemethod on the extraction of effective constituents from Sophorae Flavescentis Radix,Scorpio and Eupolyphaga.METHODS The changes ofspecific conductances in the extraction of effective constituents from Sophorae Flavescentis Radix,Scorpio and Eupolyphaga were determined by specific conductance method.The variations of specific conductance values and contents of effective constituents,together with the quantitative relationships between these two evaluation indicators were investigated. RESULTS The specific conductance value of Sophorae Flavescentis Radix extract had a linear relationship with the total content of alkaloid,and the specific conductance values of Scorpio and Eupolyphaga extracts also had line-
specific conductance;traditional Chinesemedicines;alkaloid;proteins polypeptide;extracion
R284.2
A
1001-1528(2015)12-2686-05
10.3969/j.issn.1001-1528.2015.12.025
2015-01-06
广东省科技计划项目 (2012A030100017)
孙冬梅 (1969—),女,主任中药师,主要从事中药质量评价研究。Tel:(020)83501292,E-mail:tcmgdp@163.com
*通信作者:陈 卉(1987—),女,博士生,主要从事中药制剂研究。Tel:13631433952,E-mail:chenhuicherry1987@163.com
日期:2015-03-18
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20150318.1019.002.htm l
ar relationshipswith the content of protein polypeptide.In addition,the variations of them with the changes of extraction time were similar.CONCLUSION Thismethod can rapidly and accurately indicate the pattern and terminal point in the extraction of effective constituents,having a certain value in the extraction process of traditional Chinesemedicines.
