新型18F标记心肌灌注显像剂的PET显像实验研究*
2015-12-06王道宇牟甜甜赵祚全张现忠
王道宇 牟甜甜 赵祚全* 郭 风 张现忠 方 纬
新型18F标记心肌灌注显像剂的PET显像实验研究*
王道宇①牟甜甜②赵祚全①*郭 风①张现忠③方 纬①
目的:通过初步动物实验,评价4-氯-2-叔丁基-5-[[6-[[4-(2-氟-18F-乙基)-1H-1,2,3-三唑-1-基]甲基]-2-吡啶基]甲氧基]-3(2H)-哒嗪酮(18F-FPTP2)用于心肌灌注发射型正电子断层显像(PET)的可能性。方法:采用18F-F-取代OTs前体的方法进行标记,通过HPLC非梯度洗脱进行纯化,并通过HPLC确认标记化合物结构。中华小型猪经静脉注射18F-FPTP2(37 MBq/15 kg),并于注射后2 min、10 min、20 min、30 min、40 min、50 min和60 min分别进行PET/CT扫描。结果:18F-FPTP2制备的总时间为70 min,未校正的放化产率为(25±7.2)%,放射化学纯度>98%。PET研究表明,18F-FPTP2在中华小型猪中的心肌摄取随时间的延长而增加,靶器官与非靶器官比值亦随之增加。注射后2 min,心和(或)肝以及心和(或)肺放射性摄取比值分别为0.65±0.10和3.47±0.29。注射后60 min,心和(或)肝以及心和(或)肺放射性摄取比值分别为0.92±0.13和9.28±0.77。结论:18F-FPTP2能够被心肌组织摄取而显影清晰,但心和(或)肝放射性摄取比值需要进一步提高。
18F-FPTP2;哒嗪酮;心肌灌注;发射型正电子断层显像
[First-author’s address] Department of Nuclear Medicine,FuWai Hospital, National Center for Cardiovascular Diseases, Chinese Academy of Medical Sciences,Beijing 100037, China.
心肌灌注显像是临床最常用的心血管核素显像技术,在冠心病危险度分层、治疗决策和预后评价中均发挥着重要的作用[1-2]。目前,临床应用的心肌灌注显像剂主要是99Tcm-MIBI、201Tl和99Tcmtetrofosmin,还有研究中的锝氮核类显像剂,但均为发射型单光子断层(single photon emission computed tomography,SPECT)显像剂[3-5]。SPECT分辨率相对较低,目前难以实现心肌血流量的绝对定量评价[6]。
PET空间分辨率和时间分辨率均明显优于SPECT,可以进行有效的组织衰减校正,实现心肌血流量的绝对定量。但目前的PET心肌灌注显像剂都难以常规临床应用,如15O-H2O和13N-NH3标记的核素半衰期很短,分别为2 min和10 min,必须同时配备现场回旋加速器,成本十分高昂。而82Rb不仅半衰期短(仅为75 s),而且心肌摄取低于15O-H2O和13N-NH3,且价格昂贵[7]。因此,开发新一代更为实用的PET心肌灌注显像剂十分必要。
本研究合成的新型18F标记心肌灌注显像剂18F-FPTP2,以18F作为标记核素,其半衰期适中(110 min),不依赖现场回旋加速器,可以在1 d内完成静息和负荷显像;18F的范德华半径与氢类似,对标记化合物的生物活性影响很小。18F-FPTP2以心肌线粒体NADH-泛醌氧化还原酶(MC-I)为结合位点,有较强的特异性。故本研究将通过初步的小型猪实验探讨18F-FPTP2用于PET显像的效能。
1 材料与方法
1.1 仪器与装置
高效液相色谱仪岛津LC-20AT(日本岛津公司);Kromasil 100-5 C18半制备反相色谱柱250 mm×10 mm (瑞典AkzoNobel公司);Biograph 64 PET/CT(德国西门子公司);RM-905a放射性活度计(中国计量科学研究院)。
1.2 材料与试剂
18F-F-由北京宣武医院提供;标记前体PTP-2OTs由厦门大学公共卫生学院提供;参考物质19F-FPTP2由厦门大学公共卫生学院提供;Kryptofix2.2.2.(K222) (美国Sigma-Aldrich公司)。
1.3 实验方法
1.3.118F-FPTP2的制备
18F-FPTP2制备路线具体步骤如下:用0.3 ml K2CO3水溶液(1 mg/0.3 ml)和1 ml K222的乙腈溶液(13 mg/1 ml)的混合液将18F-F-从QMA柱淋洗至10 ml西林瓶中。110 ℃氮气吹干后,加入0.5 ml无水乙腈蒸发至干。将2 mg PTP-2OTs溶于1 ml无水乙腈,加至反应瓶中,90 ℃密封反应20 min。反应结束后冷却至室温,将反应液注入C18反相半制备柱,收集保留时间为10~11 min的组分,加入40 ml水稀释后,过Sep-Pak C18小柱。用0.5 ml乙醇将小柱上吸附的放射性淋洗至西林瓶中,并加入9.5 ml水混匀,即为5%的18F-FPTP2乙醇溶液。①HPLC条件:A相为水,B相为乙腈;②洗脱条件:0~30 min, 55%A(如图1所示)。

图1 18F-FPTP2制备路线示图
1.3.218F-FPTP2 PET的显像研究
选择5只体重约15 kg的中华小型猪,静脉注射氯胺酮(25 mg/kg)和安定(1.1 mg/kg)进行麻醉。然后将小型猪俯卧于PET/CT检查床上,静脉注射体积为2 ml,活度为37 MBq的18F-FPTP2溶液(溶于5%乙醇溶液中)。
PET/CT扫描分别于注射后2 min、10 min、20 min、30 min、40 min、50 min和60 min进行。先进行CT低剂量扫描,扫描条件为:管电压120 kV,CareDose4D管电流50 mAs,准直为24 mm×1.2 mm,旋转时间0.5 s,螺距为1.2,断层厚度3 mm。用于心脏部位定位及进行衰减校正,然后行PET 8 min。影像采集结束后进行OSEM重建,4次迭代,8个子集。像素单元为128×128,重建放大倍数为2.0,短轴图像层厚为3 mm。勾画心肌、肝和肺的“感兴趣”区,自动得到上述器官的标准化摄取值(standard uptake value,SUV),计算各时间点的心和(或)肝以及心和(或)肺的放射性SUV比值。
2 结果
2.118F-FPTP2的放化产率及放射化学纯度
从18F-F-起,包括HPLC纯化在内的制备时间为70 min,未校正的放化产率为(25±7.2)%。产物的放化纯>98%,比活度约为30 GBq/μmol。放射性峰的保留时间为10.5 min,和相应的参考物质19F-FPTP2的保留时间10.3 min一致,表明所制备的标记物为18F-FPTP2(如图2所示)。
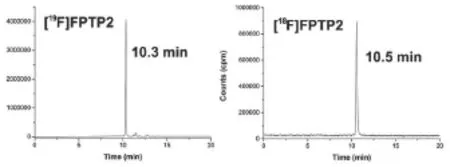
图2 18/19F-FPTP2的HPLC图谱
2.218F-FPTP2 PET的应用研究
18F-FPTP2在中华小型猪心肌中的初始摄取较低,但随着时间的延长,心肌摄取明显增加。18F-FPTP2在各时间点的肺摄取均很低,注射后2 min、10 min、20 min、30 min、40 min、50 min和60 min的心和(或)肺比值分别为3.47±0.29、4.10±0.46、4.57±0.38、6.10±0.59、7.17±0.87、8.01±1.01和9.28±0.77。与此同时,18F-FPTP2在肝部有着显著的初始摄取,随着时间的延长,肝的放射性有一定的清除,但60 min后摄取仍较高。注射后2 min、10 min、20 min、30 min、40 min、50 min和60 min心脏与肝脏的比值分别为0.65±0.10、0.56±0.09、0.58±0.07、0.69±0.09、0.71±0.11、0.79±0.10和0.92±0.13(如图3所示)。
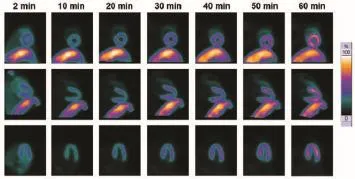
图3 18F-FPTP2 PET在中华小型猪中的显像图
3 讨论
目前,新型PET心肌灌注显像药物的研发在国际上受到高度关注。由于18F被认为是较为理想的标记核素,因此,国内外的心肌灌注显像新药研究主要集中于18F标记的化合物。主要包括两类化合物。
(1)亲脂性阳离子结构化合物。其原理是利用线粒体跨膜电位进入心肌细胞线粒体,分为季铵盐和季膦盐两种结构。季铵盐类化合物以罗丹明衍生物18F-FERhB[8-9]为代表,但其结构中的酯键容易水解造成该化合物在血清中不稳定,因此后续研究较少。季膦盐的代表性结构是18F标记三苯膦类化合物18F-FBnTP,其心肌摄取较高,血液和肺本底低,在心肌缺血动物模型实验中取得了较为满意的显像结果[10-12]。但该标记物在肝脏中代谢较慢,影响了早期成像和心肌图像质量,同时标记过程较为复杂,放射化学产率仅为6%,不利于临床推广。
(2)NADH-泛醌氧化还原酶(MC-I)抑制剂类似物。MC-I抑制剂类显像药物通过与线粒体中MC-I的特异性结合而在心肌中富集,代表性结构是以MC-I抑制剂哒嗪酮为母体,制备得到的18F-BMS-747158-02[13-18]。其在心肌摄取、靶与非靶比值等方面均优于201Tl和99Tcm-MIBI[19]。动物模型PET显示具有较高的心肌摄取和心肌滞留,心肌摄取量与血流量呈正比[20]。18F-BMS-747158-02已进入三期临床试验,但肝部清除相对较慢,最佳显像时间为注射后60 min,且制备较为复杂,仍需要改进[21]。
本研究的前期研究表明:18F-FPTP2具有稳定性佳、放化产率高的特点,在小鼠中具有良好的心肌摄取和较高的靶与非靶比值,值得对其进行进一步研究[22]。同时,18F-FPTP2的HPLC纯化方法为梯度洗脱,所用HPLC需要配备双泵,但许多自动化合成模块所配备的HPLC只有单泵。为了更适于临床研究和推广,本研究中简化了HPLC的纯化方式,将原有的梯度洗脱变为非梯度洗脱,从而降低了对HPLC配置的要求。同时,本研究还将HPLC的出峰时间由原来的18.3 min提前至10.5 min,显著缩短了制备和质量控制的时间,提高了未校正的放射化学产率。
中华小型猪行PET的显像结果与前期小鼠实验相比有所不同。在小鼠生物分布研究中,18F-FPTP2具有很高的初始心肌摄取,注射后2 min为(39.70±2.81)%ID/g,滞留注射后60 min心肌滞留率为51%。而在中华小型猪行PET的显像中,心肌初始摄取较低,但随着时间延长,心肌摄取显著增加。在小鼠生物分布实验中18F-FPTP2在肝中的初始摄取很低,注射后2 min仅为(4.87±1.35)%ID/g。而在小型猪实验中,肝部摄取在注射后2~60 min期间始终摄取较高,造成这种差异的原因可能是由于动物种属的不同。这种现象也曾出现在其他标记物的研究中[23]。18F-FPTP2是否能在其他种属大动物(犬、灵长类)中具有更好的生物性能,仍待后续研究。
标记化合物的肝摄取高,通常与其脂溶性较高有关。在后续研究中可以对标记物结构进行一定调整,适当降低其脂溶性,以期能得到性能更好的心肌灌注显像剂。
[1]Klocke FJ,Baird MG,Lorell BH,et al.ACC/ AHA/ASNC Guidelines for the clinical use of cardiac radionuclide imaging—executive summary:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines(ACC/AHA/ASNC committee to revise the 1995 Guidelines for the clinical use of cardiac radionuclide imaging)[J]. Circulation,2003,108(11):1404-1418.
[2]Berman DS,Hachamovitch R,Shaw LJ,et al. Roles of nuclear cardiology,cardiac computed tomography,and cardiac magnetic resonance: noninvasive risk stratification and a conceptualframework for the selection of noninvasive imaging tests in patients with known or suspected coronary artery disease[J].J Nucl Med,2006,47(7):1107-1118.
[3]Baggish AL,Boucher CA.Radiopharmaceutical agents for myocardial perfusion imaging[J].Circ ulation,2008,118(16):1668-1674.
[4]Bu L,Li R,Jin Z,et al.Evaluation of99mTcNMPO as a new myocardial perfusion imaging agent in normal dogs and in an acute myocardial infarction canine model:comparison with99mTc-Sestamibi[J].Mol Imaging Biol,2011, 13(1):121-127.
[5]Fang W,Liu Y,Zhu L,et al.Evaluation of99mTcN-15C5 as a new myocardial perfusion imaging agent in normal dogs and canines with coronary stenosis[J].Nucl Med Commun, 2008,29(9):775-781.
[6]Zhang WC,Fang W,Li B,et al.Experimental study of [99mTc(PNP5)(DBODC)]+as a new myocardial perfusion imaging agent[J]. Cardiology,2009,112(2):89-97.
[7]Lalonde L,Ziadi MC,Beanlands R.Cardiac positron emission tomography:current clinical practice[J].Cardiol Clin,2009,27(2):237-255.
[8]Heinrich TK,Gottumukkala V,Snay E,et al. Synthesis of fluorine-18 labeled rhodamine B:a potential PET myocardial perfusion imaging agent[J].Appl Radiat Isot,2010,68(1):96-100.
[9]Gottumukkala V,Heinrich TK,Baker A,et al. Biodistribution and stability studies of [18F] Fluoroethylrhodamine B,a potential PET myocardial perfusion agent[J].Nucl Med Biol,2010,37(3):365-370.
[10]Madar I,Ravert HT,Du Y,et al.Characterization of uptake of the new PET imaging compound18F-fluorobenzyl triphenyl phosphonium in dog myocardium[J].J Nucl Med,2006,47(8):1359-1366.
[11]Madar I,Ravert H,Dipaula A,et al.Assessment of severity of coronary artery stenosis in a canine model using the PET agent18F-fluorobenzyl triphenylphosphonium:comparison with99mTctetrofosmin[J].J Nucl Med,2007,48(6):1021-1030.
[12]Higuchi T,Fukushima K,Rischpler C,et al. Stable delineation of the ischemic area by the PET perfusion tracer18F-fluorobenzyl triphenyl phosphonium after transient coronary occlusion[J].J Nucl Med,2011,52(6):965-969.
[13]Yu M,Guaraldi M,Kagan M,et al.Assessment of18F-labeled mitochondrial complex I inhibitors as PET myocardial perfusion imaging agents in rats,rabbits,and primates[J].Eur J Nucl Med Mol Imaging,2009,36(1):63-72.
[14]Yalamanchili P,Wexler E,Hayes M,et al. Mechanism of uptake and retention of18F-BMS-747158-02 in cardiomyocytes:a novel PET myocardial imaging agent[J].J Nucl Cardiol,2007,14(6):782-788.
[15]Yu M,Guaraldi MT,Mistry M,et al.BMS-747158-02:a novel PET myocardial perfusion imaging agent[J].J Nucl Cardiol,2007,14(6): 789-798.
[16]Huisman MC,Higuchi T,Reder S,et al.Initial characterization of an18F-labeled myocardial perfusion tracer[J].J Nucl Med,2008,49(4):630-636.
[17]Higuchi T,Nekolla SG,Huisman MM,et al. A new18F-labeled myocardial PET tracer: Myocardial uptake after permanent and transient coronary occlusion in rats[J].J Nucl Med,2008, 49(10):1715-1722.
[18]Sherif HM,Saraste A,Weidl E,et al.Evaluation of a novel18F-labeled positron-emission tomography perfusion tracer for the assessment of myocardial infarct size in rats[J].Circ Cardiovasc Imaging,2009,2(2):77-84.
[19]Maddahi J,Berman D,Taillefer R,et al.Phase 2 clinical comparison of flurpiridaz F-18 injection PET and SPECT myocardial perfusion imaging for diagnosis of coronary artery disease[J].J Nucl Med,2011,61:469-477.
[20]Nekolla SG,Reder S,Saraste A,et al.Evaluation of the novel myocardial perfusion positronemission tomography tracer18F-BMS-747158-02:comparison to13N-ammonia and validation with microsphere in a pig model[J].Circulati on,2009,119(17):2333-2342.
[21]Maddahi J,Czernin J,Lazewatsky J,et al. Phase I,first-in-human study of BMS747158,a novel18F-labeled tracer for myocardial perfusion PET:dosimetry,biodistribution,safe ty,and imaging characteristics after a single injection at rest[J].J Nucl Med,2011,52(9): 1490-1498.
[22]Mou T,Zhao Z,Zhang P,et al.Synthesis and bio-evaluation of new18F-labeled pyridaben analogues with improved stability for myocardial perfusion imaging in mice[J].Chem Biol Drug Des,DOI:10.1111/cbdd.12499.
[23]Zhao Z,Yu Q,Mou T,et al.Highly efficient one-pot labeling of new phosphonium cations with fluorine-18 as potential PET agents for myocardial perfusion imaging[J].Mol Pharmace ut,2014,11(11):3823-3831.
The preliminary experimental study of a novel 18F-labeled myocardial perfusion imaging agent for PET imaging
WANG Dao-yu, MU Tian-tian, ZHAO Zuo-quan, et al
China Medical Equipment,2015,12(6):50-53.
Objective: To preliminarily evaluate the potential of 2-tert-butyl-4-chloro-5-((6-((4-(2-[18F]fluroethyl)-1H-1,2,3-triazol-1-yl)methyl)-2-pyridinyl)methoxy)-3(2H)-pyridazinone ([18F]FPTP2) as a myocardial perfusion imaging agent, by animal positron emission tomography(PET) imaging. Methods: [18F]FPTP2 was prepared by substituting tosyl of precursor with18F, purified and confirmed by HPLC. [18F] FPTP2 (37 MBq/15 kg) was injected into Chinese mini-swines intravenously by a venous catheter. The cardiac PET scans were performed at 2, 10, 20, 30, 40, 50 and 60 min after injection. Results: The total radio-synthesis time was 70 min, radiochemical yield was 25±7.2% without correction. The radiochemical purities (RCP) were >98% after purification. In PET imaging study, the heart uptake and target-to-nontarget uptake ratios increased with time. The heart/liver and heart/lung ratios were 0.65±0.10 and 3.47±0.29 at 2 min post injection, 0.92±0.13 and 9.28±0.77 at 60 min post injection respectively. Conclusion: Although the higher uptake of [18F]FPTP2 were shown in myocardium, the heart/liver ratio still need to be improved in future study.
[18F]FPTP2; Pyridazinone; Myocardial perfusion; Positron emission tomography imaging
王道宇,男,(1970- ),大专,主管技师。中国医学科学院 国家心血管病中心 阜外心血管病医院核医学科,从事核医学工作。
1672-8270(2015)06-0050-04
R817.4
A
10.3969/J.ISSN.1672-8270.2015.06.016
2015-04-02
国家自然科学基金(81301251)“新型氟-18标记的哒嗪酮类心肌灌注显像剂的研制及PET显像实验研究”
①中国医学科学院 国家心血管病中心 阜外心血管病医院核医学科 北京 100037
②首都医科大学附属北京安贞医院核医学科 北京 100029
③厦门大学公共卫生学院分子影像暨转化医学研究中心 福建 厦门 361102
*通讯作者:418zhaozuoquan@163.com
