碳前驱体在全氟磺酸型碳基固体酸材料设计中的影响
2015-12-05李璀灿张梦晓华伟明乐英红
李璀灿 张梦晓 华伟明 乐英红 高 滋
(复旦大学化学系, 上海市分子催化和功能材料重点实验室, 上海 200433)
碳前驱体在全氟磺酸型碳基固体酸材料设计中的影响
李璀灿 张梦晓 华伟明 乐英红*高 滋
(复旦大学化学系, 上海市分子催化和功能材料重点实验室, 上海 200433)
以碳纳米管、介孔碳分子筛和氮掺杂的介孔碳为前驱体, 采用全氟磺酸-全氟乙烯共聚物(PTFE)液相沉积方法制备了修饰量相同的三种全氟磺酸功能化碳基固体酸催化剂, 利用N2吸附、热重分析(TG)、透射电子显微镜(TEM)、傅里叶红外变换(FTIR)光谱以及电位滴定等方法对材料的结构和酸性进行了表征. 考察催化剂对于苯甲醇与苯甲醚Friedel-Crafts (F-C)反应的催化性能. 结果表明, 前驱体的比表面积越大, 与修饰剂的相互作用越强, 越有利于修饰剂在前驱体表面的分散, 得到的催化剂表面酸量越多, 酸催化活性越好. 因此, 全氟磺酸功能化的氮掺杂介孔碳在F-C反应中表现出最高的活性和稳定性.
碳基固体酸; 全氟磺酸; 酸性; 稳定性; F-C反应
1 引 言
酸催化反应是化工领域中最重要的反应之一.随着环境保护意识的日益增强, 以环境友好的固体酸代替传统使用的液体酸是酸催化反应的发展趋势.1–6目前, 已有不少固体酸催化剂被应用于工业生产,7,8如以各种沸石分子筛为催化剂的催化裂解、二甲苯异构化、甲苯歧化等反应, 以固体超强酸为催化剂的C5/C6异构化反应等. 然而, 对于有水参与的液相反应, 如水解、水合、酯化、F-C反应等, 固体酸成功的例子相对较少, 主要原因是传统固体酸催化剂容易在有水存在的环境中失活, 因此亟需开发新型高效不怕水的固体酸催化剂.
近年来出现的碳基固体酸作为一种全新的可代替液体酸的强酸材料而备受关注.9,10该类材料具有不怕水、在酸、碱介质中十分稳定、表面性质可调等优点, 并且在一些液相催化反应中, 如2,3-二甲基-2-丁烯的水合反应、乙酸的酯化反应、三乙酸甘油酯的酯交换反应、Biginelli反应以及醛氧化制羧酸的反应, 表现出优良的催化性能.9,11–13然而这些催化剂的稳定性还不尽如人意, 尤其是在高温极性介质中, 究其原因在于目前使用的绝大多数为苯磺酸型碳基固体酸, 催化剂表面的苯磺酸在高温下容易发生F-C反应的逆反应, 使得磺酸基团发生脱落. 另外, 这类催化剂制备过程中大量硫酸的使用也会造成一定的污染环境. 为了解决上述问题, 近年来越来越多的学者开展了对酸化的方法和酸化的碳材料的研究与改进, 如磺酸化纳米结构石墨烯,14聚二乙烯基苯枝接强酸等,15均具有较好的活性, 同时又提高了磺酸基团的稳定性, 然而制备过程相对繁杂.
我们课题组16曾采用全氟磺酸-全氟乙烯共聚物的液相沉积方法制备了全氟磺酸功能化的碳纳米管催化剂, 由于从原理上杜绝了磺酸基团脱离的可能性, 该材料在极性和非极性溶液中均十分稳定,并且具有良好的热稳定性. 在对苯二酚与叔丁醇的烷基化反应中也表现出优异的催化性能, 其催化活性与稳定性均高于苯磺酸型的碳纳米管固体酸.
本文是对我们前期工作的进一步深入, 以不同介孔碳材料为前驱体制备了全氟磺酸功能化的碳基固体酸催化剂, 利用N2吸附、透射电子显微镜、红外光谱、热重分析、电位滴定等方法对催化剂的结构和酸性进行了表征, 考察苯甲醇与苯甲醚FC反应的催化性能, 并进行了比较, 探讨了碳前驱体对于最终碳基固体酸材料性能的影响.
2 实验部分
2.1 催化剂的制备
多壁碳纳米管(成都有机化学有限公司, 纯度> 95%), 介孔碳分子筛CMK-3(南京先丰纳米有限公司).
掺氮的介孔碳材料按照文献方法17制备, 具体如下: 将25.5 mmol的苯酚与51 mmol甲醛(37%(w))加入到50 mL 0.2 molL–1氢氧化钠溶液中, 70 °C搅拌40 min, 加入51 mmol三聚氰胺, 153 mmol甲醛(37%(w)), 连续搅拌30 min, 在搅拌下加入50 g Ludox SM-30(30%(w), Aldrich), 密封, 80 °C反应3 d,烘干, 在N2气氛下以5 °Cmin–1速率升温至800 °C,保持3 h, 冷却后溶于2 molL–1氢氧化钠溶液, 80 °C反应12 h, 抽滤, 水洗至pH不变, 烘干; 记为NMC.
将500 mg碳基材料, 加入5 g 5% (w)全氟磺酸-全氟乙烯共聚物的醇溶液, 用75%乙醇稀释至25 g,密封; 电磁搅拌10 min, 超声处理40 min, 电磁搅拌过夜; 敞口置于通风橱中, 待溶剂基本挥发后100 °C烘干, 碾碎为所得PFSA-C (C指碳前驱体), 文中所制得样品分别记为PFSA-CNT、PFSA-CMK-3和PFSA-NMC.
2.2 催化剂的表征
用美国麦克公司的ASAP-2000型自动吸附分析仪测定样品的N2吸附等温线, 比表面积由BET方法得到, 孔径和孔体积利用BJH方法算得. 用美国尼高力(Nicolet)公司Avatar-360型傅里叶红外光谱仪采集样品的红外光谱. 用美国珀金埃尔默(PerkinElmer)公司TGA7型热重分析仪分析样品的热稳定性, 实验在N2气氛下进行, 升温速率10 °Cmin–1. 用日本电子公司JEM 2100型透射电子显微镜观察样品的特征结构和形貌.
样品的酸性表征通过电位滴定法测定,18具体为: 将50 mg催化剂加入到10 mL乙腈中搅拌3 h, 然后用正丁胺的乙腈溶液(0.1 molL–1)滴定, 电位变化用Mettler Toledo FE20型pH计(梅特勒-托利多国际贸易(上海)有限公司)测定, 将电位超过100 mV时所吸附的正丁胺的量定为强酸位, 0–100 mV为中强酸位, –100 – 0 mV为弱酸位, 三者总和作为总酸性位数目.
2.3 催化剂的评价
苯甲醇与苯甲醚F-C反应(见示意图1)是在内衬有聚四氟乙烯的微型高压反应釜中进行的, 使用磁力搅拌, 转速800 rmin–1. 具体的反应条件如下: 苯甲醇6.25 mmol, 苯甲醚92.5 mmol, 催化剂0.20 g, 反应进行2 h, 温度为120 °C, 产物使用配有SE-30毛细管色谱柱(30 m × 0.25 mm × 0.3 μm)的GC122型气相色谱分析, 色谱条件: 气化室温度170 °C, 离子室温度220 °C, 柱箱起始温度75 °C, 7 min后升至180°C, 保持14 min.19,20
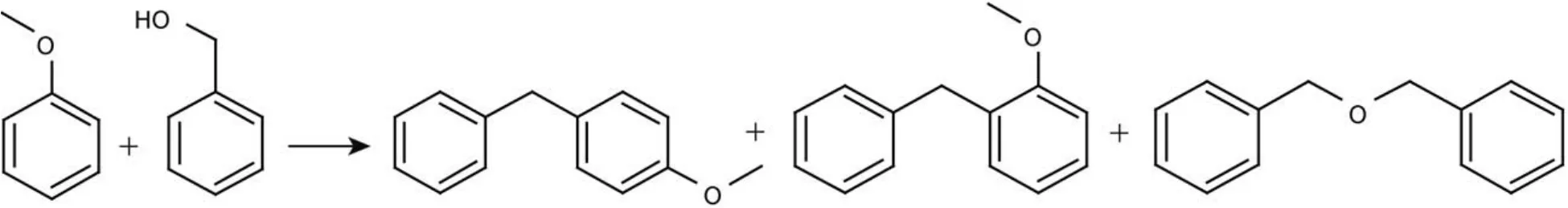
示意图 1 苯甲醇与苯甲醚的F-C反应Scheme 1 Friedel-Crafts alkylation of anisole with benzyl alcohol
3 结果与讨论
3.1 催化剂的表征
分别以碳纳米管CNT、介孔碳分子筛CMK-3和氮掺杂的介孔碳NMC为前驱体, 采用全氟磺酸-全氟乙烯共聚物的液相沉积方法制备了全氟磺酸修饰量相同的三种全氟磺酸功能化碳基固体酸催化剂. 图1分别总结了三种材料功能化前后的N2吸附-脱附等温线. 比较三张图可以发现, 虽然三种样品由于结构上的差异使其本身的吸附等温线有明显的区别, 但每种样品功能化前后的等温线形状却非常相似, 说明全氟磺酸-全氟乙烯的修饰对碳前驱体本身结构的影响很小, 也说明修饰剂较好地沉积在了碳前驱体的表面.
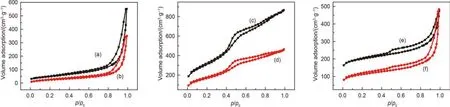
图1 功能化前后碳材料的氮气吸附脱附等温线Fig.1 N2adsorption/desorption isotherms of carbon materials before and after modification
表1列出了上述样品的比表面积、孔容与平均孔径. 与碳前驱体比较, 全氟磺酸-全氟乙烯修饰后样品的比表面积和孔容有所下降, 考虑到样品中碳载体的实际含量改性后有所下降, 碳载体本身的比表面下降程度并不特别大, 这也是孔径改变不明显的原因, 说明全氟磺酸在碳前驱体中均较好地分散. CNT改性后孔径略微增加, 可能是因为全氟磺酸腐蚀介孔孔壁形成了少量大孔. 三种前驱体中, NMC功能化后无论是比表面还是孔体积下降的幅度都最小, 说明修饰剂在其表面分散性最好.
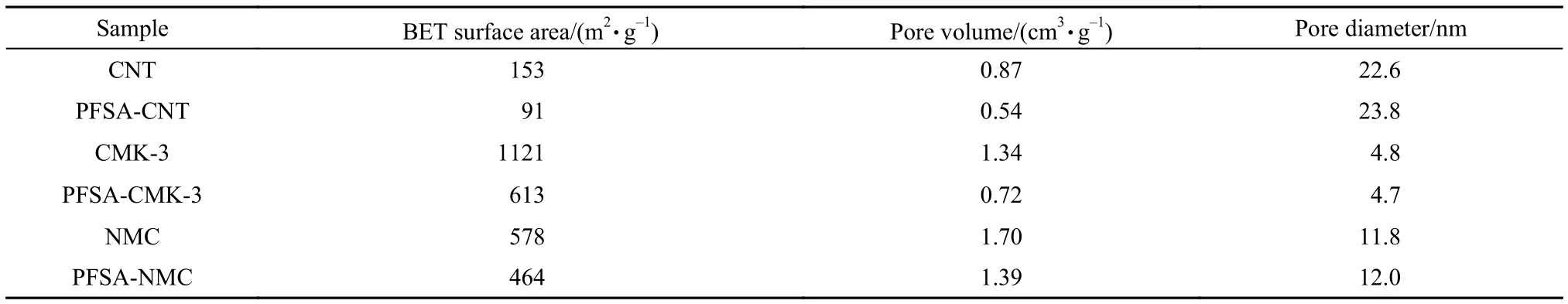
表1 功能化前后碳材料的织构性质Tabl1 Textural properties of carbon materials before and after modification
图2为介孔碳分子筛CMK-3和氮掺杂的介孔碳NMC功能化前后的TEM照片, 可以看到, CMK-3具有非常规整的直孔道, 而NMC的孔道大多为无规则的蠕虫状, 功能化之后碳材料的孔道结构没有被改变. 聚合物在碳纳米管的表面分散良好, 与前面N2吸附的表征结果相一致, 这与碳纳米管样品功能化后的结果完全类似.16

图2 功能化前后的碳材料的透射电镜图Fig.2 TEM images of carbon materials before and after modification
图3给出了三种全氟磺酸功能化碳材料和全氟磺酸-全氟乙烯聚合物(5% (w)杂醇溶液)的热重曲线. 可以看到, 聚合物本身的热重曲线图3(d)在350 °C有一个明显的失重, 这是由于磺酸基团的脱除或分解所致(50 °C 的失重是溶剂醇的挥发造成的). 功能化后的碳样品的热重曲线在300–500 °C区间有类似的失重峰, 对应于沉积在材料表面的全氟磺酸基团的脱除, 表明修饰后全氟磺酸基团的稳定性与修饰前相同.
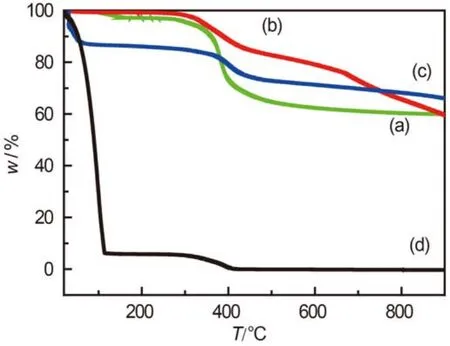
图3 全氟磺酸功能化催化剂的热重曲线Fig.3 Thermogravimetric curves of the PFSA-C catalyst;
图4为三种全氟磺酸功能化碳材料的红外光谱图, 并将它们与全氟磺酸-全氟乙烯的图谱进行了对比. 从红外光谱图上可以看到, 在620和1070 cm–1处出现了磺酸基的特征峰, 说明全氟磺酸基团被成功引入到了三种碳材料表面, 但全氟磺酸是否与表面形成了化学键无法从红外谱图上得到确定. 由于制备时采用的温度较低, 因而推测形成化学键的可能性较小.
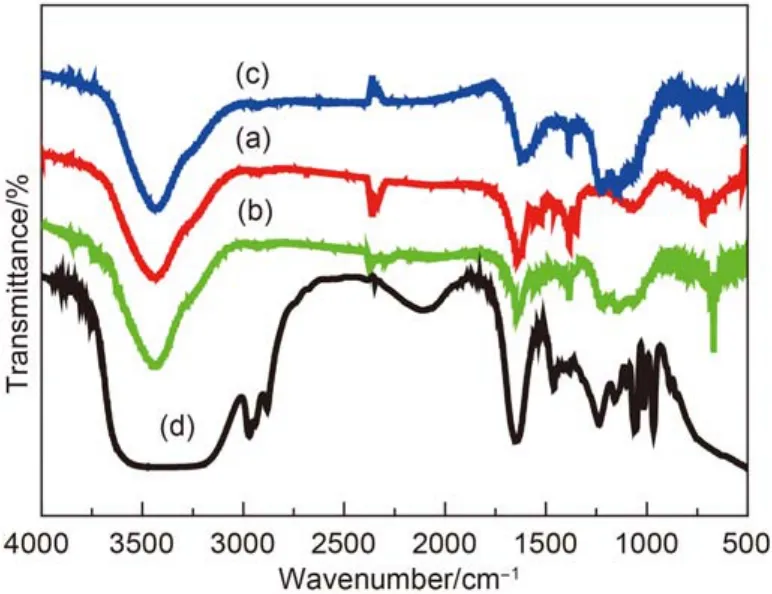
图4 全氟磺酸功能化催化剂的FTIR光谱图Fig.4 Fourier transform infrared spectroscopy patterns of PFSA-C catalysts
3.2 催化剂的酸性
利用电位滴定测试了三种全氟磺酸功能化碳材料的酸性, 结果见表2. 这是一个比较简单的酸碱滴定方法, 其最大的优点是根据滴定时电位不仅可以确定总酸量, 还可以对酸强度进行区分, 因而在用于液相酸催化反应的催化剂酸强度表征方面有着较广泛的应用.21–25虽然全氟磺酸-全氟乙烯修饰量相同, 但三种样品的酸量却各有不同, 这说明修饰剂在三种碳前驱体表面的分散情况有所不同, 其中PFSA-CNT样品的酸量最低, 这可能与其较小的比表面有关, 很显然比表面积越大越有利于修饰剂在表面的分散, 因而暴露的(即可测定到的)酸量就越多. 进一步比较PFSA-CMK和PFSA-NMC样品发现, 虽然PFSA-CMK的比表面积远大于PFSANMC样品, 但其表面酸量却还略低, 这说明修饰剂的分散除了与表面大小有关外, 还受其他因素的影响. PFSA-NMC样品由于有氮的掺杂, 表面偏碱性,导致表面与带酸性基团的修饰剂的相互作用明显增强, 从而促进了修饰剂在表面的分散. 由此可见,比表面积越大, 表面与修饰剂相互作用越强, 修饰剂在表面的分散越好, 得到的催化剂表面的酸量也越多.
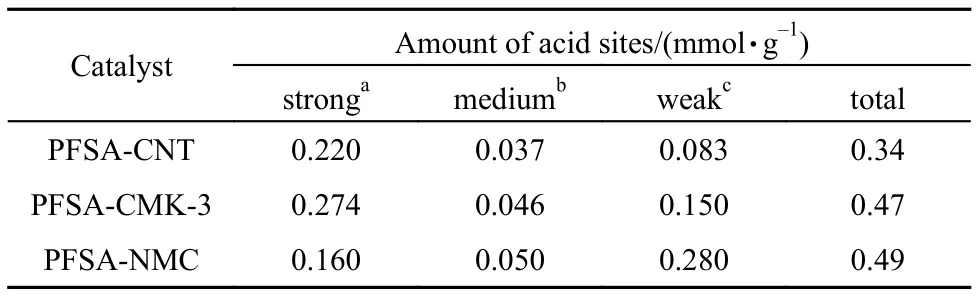
表2 电位滴定法得到的PFSA-C催化剂的酸量Tabl2 Acidity of PFSA-C catalysts obtained by potentiometric titration
从酸量的分布来看, PFSA-NMC样品的强酸量相对较少, 弱酸量相对较多, 这可能是由于其表面的碱性造成的.
3.3 催化剂的活性
芳烃的烷基化是工业生产中重要的反应类型之一, 生成的长链烷基苯, 可以做洗涤剂的中间产物, 因此越来越多的学者研究固体酸催化剂在芳烃烷基化反应中的催化性能, 苯甲醇苯甲醚F-C反应就是其中之一. 该反应主要产物为苄基苯甲醚和二苄醚, 还有少量的苯甲醛及甲基苯甲醇等副产物.表3列出了全氟磺酸修饰的三种碳催化剂对于上述F-C反应的催化性能. 结果发现, 三种催化剂对于此反应均表现出了一定的活性, 其活性大小次序为PFSA-NMC > PFSA-CMK > PFSA-CNT, 与催化剂酸量的次序一致. 这是因为F-C反应是一个典型的酸催化反应, PFSA-NMC催化剂由于载体与修饰剂之间的强相互作用使得其具有最高的酸量, 因而获得最佳的催化活性. 该结果已接近于Amberlyst-15和Nafion催化剂的活性, 远高于沸石、氧化物等其他固体酸催化剂.19
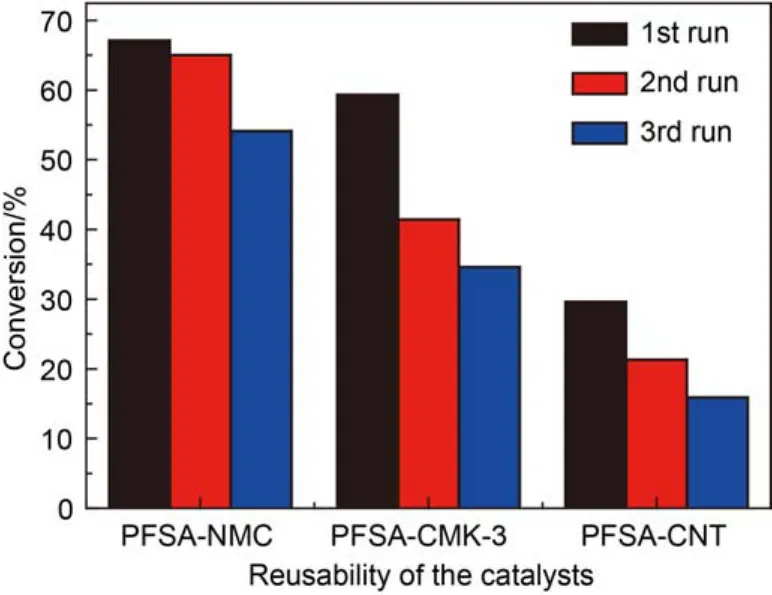
图5 催化剂在苯甲醇苯甲醚F-C反应中的循环使用性能Fig.5 Reusability in the F-C benzylation of anisole with benzyl alcohol
3.4 催化剂的稳定性
对三种催化剂的重复使用性能进行了比较. 催化剂在反应后, 经过离心分离, 用苯甲醚少量多次洗涤, 于100 °C干燥过夜后, 直接用于下一次反应,反应的结果总结于图5. 在三次循环反应之后, 三种催化剂的活性均有所下降, 但下降的程度不同, 其中PFSA-NMC样品稳定性最好, 三次循环后活性仅降低19%, 而在相同反应条件下PFSA-CMK和PFSACNT则分别下降了初始活性的42%和46%. 这说明载体与修饰剂之间的强相互作用对于提高催化剂的稳定性也有帮助.
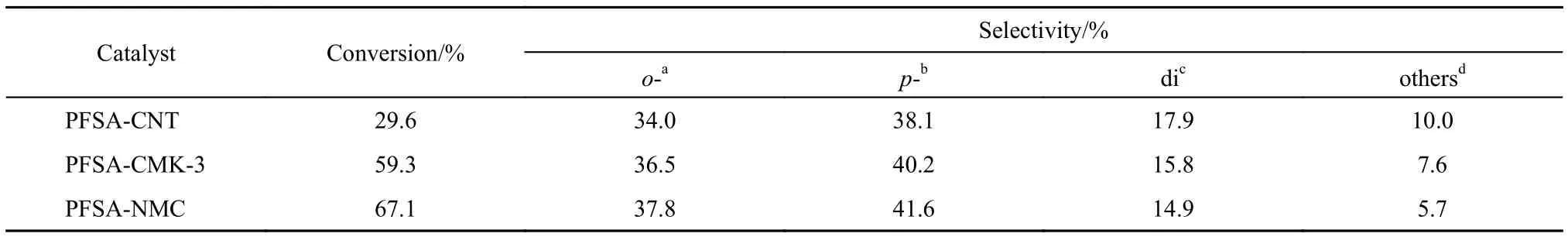
表3 催化剂在苯甲醇苯甲醚F-C反应中的反应活性Tabl3 Catalytic activity in the F-C benzylation of anisole with benzyl alcohol
4 结 论
通过液相沉积方法制备了全氟磺酸功能化的碳纳米管、碳介孔分子筛和氮掺杂的介孔碳三种催化剂, 比较了它们的酸性及酸催化能力. 全氟磺酸功能化氮掺杂的介孔碳催化剂具有最高的表面酸量和最好的苯甲醇苯甲醚F-C反应催化活性, 这是因为氮的掺杂增强了碳前驱体表面与修饰剂之间的相互作用, 促进了修饰剂在表面的分散, 从而提高了表面可接触的酸性位数目. 同时, 碳前驱体表面与修饰剂之间相互作用的增强还提高了催化剂在反应中的稳定性.
(1)Anastas, P. T.; Kirchhoff, M. M. Accounts Chem. Res. 2002, 35 (9), 686. doi: 10.1021/ar010065m
(2)Horvath, I. T.; Anastas, P. T. Chem. Rev. 2007, 107 (6), 2169. doi: 10.1021/cr078380v
(3)Ember, L. R. Chem. Eng. News 1993, 71 (23), 7. doi: 10.1021/cen-v071n023.p007
(4)Amato, I. Science 1993, 259 (5101), 1538.
(5)Sheldon, R. A. Chem. Tech. 1994, 24 (3), 38.
(6)Ember, L. R. Chem. Eng. News 1991, 69 (27), 7. doi: 10.1021/cen-v069n027.p007
(7)Okuhara, T. Chem. Rev. 2002, 102, 3641. doi: 10.1021/cr0103569
(8)Smith, K.; EI-Hiti, G. A.; Jayne, A. J.; Butters, M. Org. Biomol. Chem. 2003, 1 (9), 1560. doi: 10.1039/b301260c
(9)Okamura, M.; Takagaki, A.; Toda, M.; Kondo, J. N.; Domen, K.; Tatsumi, T.; Hara, M.; Hayashi, S. Chem. Mat. 2006, 18 (13), 3039. doi: 10.1021/cm0605623
(10)Torres, P. M.; Pastor, P. O.; Castellón, E. R.; Lepez, A. J. J. Solid State Chem. 1991, 94 (2), 368. doi: 10.1016/0022-4596(91)90203-T
(11)Mo, X. H.; López, D. E.; Liu, Y. J.; Lotero, E.; Goodwin, J. G. J. Catal. 2008, 254, 332. doi: 10.1016/j.jcat.2008.01.011
(12)Moghaddas, M.; Davoodnia, A.; Heravi, M. M.; Hoseini, N. T. Chin. J. Catal. 2012, 33, 706. doi: 10.1016/S1872-2067(11)60377-X
(13)Zhou, L. P.; Dong, B. B.; Tang, S.; Ma, H.; Chen, C.; Yang, X. M.; Xu, J. J. Energy Chem. 2013, 22, 659. doi: 10.1016/S2095-4956(13)60087-X
(14)Liu, F. J.; Kong, W. P.; Wang, L.; Yi, X. F.; Noshadi, I.; Zheng, A. M.; Qi, C. Z. Green Chem. 2015, 17, 480. doi: 10.1039/ C4GC01052C
(15)Liu, F. J.; Noshadi, I.; Zheng, A. M.; Xiao, F. S. Appl. Catal. BEnviron. 2013, 136–137, 193.
(16)Zhang, M. X.; Li, C. C.; Hua, W. M.; Yue, Y. H.; Gao, Z. Chin. J. Catal. 2014, 35 (11), 1875. [张梦晓, 李璀灿, 华伟明, 乐英红,高 滋. 催化学报, 2014, 35 (11), 1875.]
(17)Chen, H. C.; Sun, F. G.; Wang, J. T.; Li, W. C.; Qiao, W. M.; Lin, L. C.; Long, D. H. J. Phys. Chem. C 2013, 117, 8318. doi: 10.1021/jp4017773
(18)Cid, R.; Pecchi, G. P. Appl. Catal. 1985, 14, 15. doi: 10.1016/S0166-9834(00)84340-7
(19)Tagusagawa, C.; Takagaki, A.; Hayashi, S.; Domen, K. J. Phys. Chem. C 2009, 113, 7831. doi: 10.1021/jp900525a
(20)De la Cruz, M. H. C.; Da Silva, J. F. C.; Lachter, E. R. Catal. Today 2006, 118, 379. doi: 10.1016/j.cattod.2006.07.058
(21)Khder, A. S.; EI-Sharkawy, E. A.; EI-Hakam, S. A.; Ahmed, A. I. Catal. Commun. 2008, 9 (5), 769. doi: 10.1016/j. catcom.2007.08.022
(22)Sharma, S.; Vyas, S.; Patel, A. J. Mol. Catal. A-Chem. 2004, 214 (2), 281. doi: 10.1016/j.molcata.2003.12.038
(23)Pizzio, L. R.; Vázquez, P. G.; Cáceres, C. V.; Blanco, M. N. Appl. Catal. A-Gen. 2003, 256, 125. doi: 10.1016/S0926-860X(03)00394-6
(24)Villabrille, P.; Vázquez, P. G.; Blanco, M. N.; Cáceres, C. V. J. Colloid Interface Sci. 2002, 251, 151. doi: 10.1006/jcis.2002.8391
(25)Liu, K.; Wang, X. Y.; Ding, S. D.; Li, Y.; Hua, W. M.; Yue, Y. H.; Gao, Z. J. Mol. Catal. A-Chem. 2013, 380, 84. doi: 10.1016/j.molcata.2013.09.019
Effect of the Carbon Precursor on the Design of Perfluorosulfonic Acid Functionalized Carbon Catalysts
LI Cui-Can ZHANG Meng-Xiao HUA Wei-Ming YUE Ying-Hong*GAO Zi
(Shanghai Key Laboratory of Molecular Catalysis and Innovative Material, Department of Chemistry, Fudan University, Shanghai 200433, P. R. China)
Perfluorosulfonic acid functionalized carbon-based solid acid catalysts were prepared by liquid deposition of perfluorosulfonic acid-polytetrafluoroethylene (PTFE) copolymer using carbon nanotubes, mesoporous carbon molecular sieves, and nitrogen-doped mesoporous carbon as precursors. The obtained catalysts were characterized by N2adsorption, thermogravimetric analysis (TG), transmission electron microscope (TEM), Fourier transform Infrared (FTIR) spectrometer, and potentiometric titration. Their catalytic behavior in the Friedel-Crafts (F-C) alkylation of anisole was also investigated. It was found that the surface area of the precursor and its interaction with perfluorosulfonic acid play important roles in the preparation of highly active catalysts. The highest activity as well as the best stability was observed over perfluorosulfonic acid functionalized nitrogen-doped mesoporous carbon.
Carbon-based solid acid; Perfluorosulfonic acid; Acidity; Stability; Friedel-Crafts alkylation
O643
10.3866/PKU.WHXB201506012
Received: April 16, 2015; Revised: June 1, 2015; Published on Web: June 1, 2015.
*Corresponding author. Email: yhyue@fudan.edu.cn; Tel: +86-21-65642409.
The project was supported by the National Natural Science Foundation of China (21273043).
国家自然科学基金(21273043)资助项目
© Editorial office of Acta Physico-Chimica Sinica
