红花甙对过氧化氢诱导SH-SY5Y细胞凋亡保护作用的实验研究
2015-12-02凌志扬孙晓峰
凌志扬,孙晓峰
氧自由基损伤与许多中枢神经系统退行性病变的发生发展密切相关。如:帕金森病、阿尔兹海默病、多发性硬化等。寻找防治氧自由基损伤的药物对于防治神经退行性疾病具有重要意义[1]。红花甙(carthamin,CAS number:36338-96-2) 是我国传统名药红花(flower of carthamus tinctorius)的主要成分[2]。有广泛的心脑血管系统活性。近来有实验证明红花甙有较强的清除氧自由基的作用[3]。本实验利用过氧化氢(H2O2)致神经母细胞瘤细胞SH-SY5Y细胞株凋亡为神经细胞氧自由基损伤模型,探讨红花甙是否能对抗神经细胞氧化应激损伤,为红花甙用于防治神经系统退行性病变提供依据。
1 材料与方法
1.1 试剂与细胞 红花甙购自科星贸易有限公司。SH-SY5Y细胞购于中国科学院上海生化细胞所。DMEM/F12培养基购于美国Hyclone公司。AnnexinⅤ-APC和碘化丙锭 (PI) 染料购于invitrogen公司。细胞用含10%胎牛血清的DMEM/F12 培养液,置 CO2培养箱(37 ℃、5%CO2)培养,换液1次/2 d,待细胞铺满培养皿底部80%时,分组进行实验。
1.2 分组及药物处理 实验分为空白组 (B)、损伤组(I)及红花甙低(CA-L)、中(CA-M)、高(CAH)剂量组。除空白组外,其余各组均加入终浓度为50 μmol/L的H2O2,受试药组同时给予红花甙终浓度分别为 20、40、80 μmol/L 继续培养 12 h,测定各项实验指标。
1.3 MTT法检测细胞活性 细胞消化后配成单细胞悬液,以每孔1×104个细胞接种于96孔培养板,每组细胞8复孔,于培养结束前4 h加入5 g/L MTT 20 μl,培养结束后,倾去培养基,每孔加入DMSO 150 μl,振荡混匀,使结晶完全溶解,用酶联免疫检测仪于570 nm波长处测定其吸光度值A。对照组细胞生长率为100%,其余各组存活率=A实验/A对照×100%。
1.4 比色法测细胞培养液中MDA含量 分别取各组细胞上清液100 μl,按MDA测定试剂说明书操作,比色法测定细胞培养液中MDA的OD值并计算其含量。
1.5 流式检测细胞凋亡率 将各组细胞用胰蛋白酶消化后,用PBS洗涤细胞2次。用去离子水按1∶4稀释结合缓冲液,加入250 μl结合缓冲液重新悬浮细胞,使其浓度为 1×106/ml;取 100 μl的细胞悬液于 5 ml流式管中,加入 5 μl Annexin Ⅴ-APC 和 5 μl 20 μg/ml的碘化丙锭(PI)溶液;混匀后于室温避光孵育15 min;在反应管中加入400 μl PBS,流式细胞仪检测、分析。
2 结 果
2.1 红花甙对SH-SY5Y细胞活性的影响 损伤组SH-SY5Y细胞存活率29.7%,明显低于对照组(P<0.01),说明 H2O2引起 SH-SY5Y 细胞损伤;与损伤组比较,CA-L、CA-M、CA-H 组细胞存活率明显提高(P<0.05),且随着剂量增加细胞存活率提高,提示红花甙对SH-SY5Y细胞的氧自由基损伤具有保护作用,结果见表1,图1。
表1 各组SH-SY5Y细胞存活率(±s)
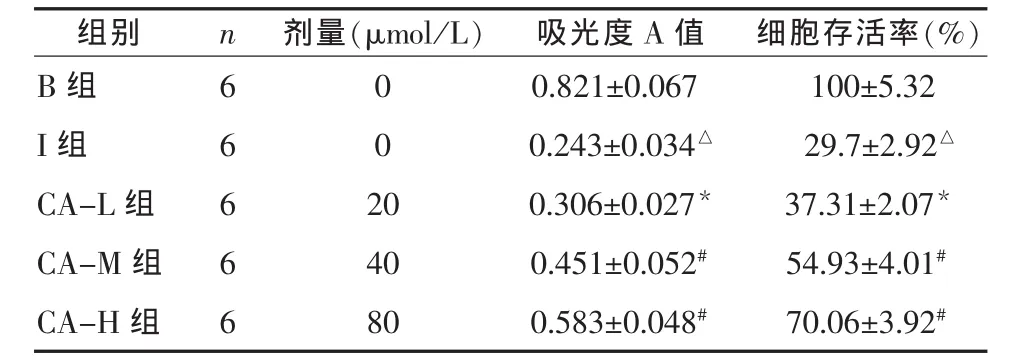
表1 各组SH-SY5Y细胞存活率(±s)
注:与空白组相比,△P<0.01;与损伤组相比,*P<0.05,#P<0.01
组别 n B组 6 I组 6 CA-L 组 6 CA-M 组 6 CA-H 组 6剂量(μmol/L) 吸光度A值 细胞存活率(%)0 0.821±0.067 100±5.32 0 0.243±0.034△ 29.7±2.92△20 0.306±0.027* 37.31±2.07*40 0.451±0.052# 54.93±4.01#80 0.583±0.048# 70.06±3.92#

图1 红花甙对H2O2损伤SH-SY5Y细胞存活率的影响
2.2 细胞培养液中MDA含量测定结果 由表2可见,与空白组相比,损伤组培养液中MDA含量明显增加 (P<0.01)。 与损伤组相比, 红花甙能降低MDA的生成,并随着红花甙加入量的增加而逐渐降低。
2.3 流式检测细胞凋亡率 在流式细胞术参数散点图上,左下象限显示活细胞;右下象限为早期凋亡细胞;右上象限为晚期凋亡细胞和坏死细胞;左上象限是坏死细胞。以右下象限细胞的百分数为考察指标,结果显示损伤组细胞比空白组凋亡率明显升高(P<0.01);与损伤组比较,红花甙高、中、低剂量组细胞凋亡率明显降低(P<0.05),且随着红花甙剂量增加凋亡率逐渐降低。见图2、表3。
表2 各组SH-SY5Y细胞MDA生成情况(±s)

表2 各组SH-SY5Y细胞MDA生成情况(±s)
注:与空白组相比,△P<0.01;与损伤组相比,*P<0.05,#P<0.01
组别 n B组 6 I组 6 CA-L 组 6 CA-M 组 6 CA-H 组 6剂量(μmol/L) MDA(nmol/ml)0.2127±0.0187 0.8791±0.0332△20 0.6223±0.0221*40 0.4749±0.0331#80 0.3225±0.0272#
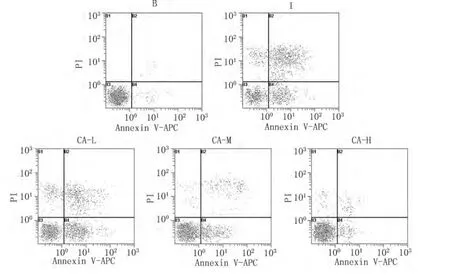
图2 流式细胞术监测细胞凋亡
表3 各组细胞凋亡率(±s,n=3)

表3 各组细胞凋亡率(±s,n=3)
注:与空白组相比,△P<0.01;与损伤组相比,*P<0.05,#P<0.01
组别 剂量(μmol/L) 凋亡率(%)B 0 1.8±0.2 I 27.6±2.2△CA-L 20 23.2±1.6*CA-M 40 18.5±0.9#CA-H 80 7.1±0.5#0
3 讨 论
近年研究表明,氧化应激损伤在神经退行性病变的发病中起着重要作用[4]。神经组织中含有大量不饱和脂肪酸,并且神经组织中抗氧化物质含量低,使其更易受到活性氧的损伤[5]。过氧化氢(H2O2)是一种很好的活性氧供给体,其供给的活性氧参与了许多神经系统疾病的发病,常用作神经细胞氧化损伤的诱导剂[6]。SH-SY5Y细胞是神经母细胞瘤细胞株,具备了神经细胞的一般生物学特征,能稳定传代,可以作为神经细胞的体外模型。H2O2诱导SH-SY5Y细胞凋亡可以作为神经细胞氧化应激模型[7]。
本文实验以体外培养SH-SY5Y细胞为对象,考察了红花甙对SH-SY5Y细胞凋亡的保护作用。结果显示:H2O2处理SH-SY5Y细胞后,流式细胞仪可检测到细胞凋亡,说明一定量的H2O2能使SHSY5Y细胞发生凋亡。红花甙使H2O2作用下的SHSY5Y细胞生存率提高,脂质氧化产物丙二醛减少,并且流式细胞仪检测发现红花甙使H2O2导致的细胞凋亡率降低,说明红花甙对H2O2诱导SH-SY5Y细胞的凋亡具有保护作用。
目前寻找抗神经细胞氧化应激损伤的药物方兴未艾。该类药物在治疗阿尔兹海默病等神经系统退行性病变中有巨大潜力[8]。本研究发现红花甙能抗氧自由基对神经细胞的损伤,这为红花甙用于抗中枢神经系统氧化应激损伤提供了依据,但其作用机制尚需进一步深入研究。
[1] Melo A,Monteiro L,Lima RM,et al.Oxidative stress in neurodegenerative diseases:mechanisms and therapeutic perspectives[J].Oxid Med Cell Longev,2011,46(7):180.
[2] Jinous Asgarpanah,Nastaran Kazemivash.Phytochemistry,pharmacology and medicinal properties of carthamus tinctorius L[J].Chin J Integr Med,2013,19(2):153-159.
[3] Midori Hiramatsu,Tomoko Takahashi,Makiko Komatsu,et al.Antioxidant and neuroprotective activities of mogami benibana(Safflower,Carthamus tinctorius Linne)[J].Neurochem Res,2009,34(8):795-805.
[4] Shibata N,Kobayashi M.The role for oxidative stress in neurodegenerative diseases[J].Brain Nerve,2008,60(2):157-70.
[5] Simonian NA,Coyle JT.Oxidative stress in neurodegenerative diseases[J].Ann Rev Pharmacol Toxicol,1996,36(1):83-106.
[6] Borza LR.A review on the cause-effect relationship between oxidative stress and toxic proteins in the pathogenesis of neurodegenerative diseases[J].Rev Med Chir Soc Med Nat Iasi,2014,118(1):19-27.
[7] Han SM,Kim JM,Park KK,et al.Neuroprotective effects of melittin on hydrogen peroxide-induced apoptotic cell death in neuroblastoma SH-SY5Y cells[J].BMC Complement Altern Med,2014,14(3):286.
[8] Chen Z,Zhong C.Oxidative stress in Alzheimer's disease[J].Neurosci Bull,2014,30(2):271-81.
