乳腺癌原发灶间质纤维化与免疫微环境及预后的关系
2015-12-02赵立朝蔡宏剑庄兴俊李露佳
赵立朝,蔡宏剑,庄兴俊,李露佳
在乳腺癌的发生发展和转移过程中,肿瘤细胞与肿瘤微环境内的成纤维细胞、细胞外基质纤维结构和免疫细胞的相互作用至关重要,也成了近年来研究的热点[1]。肿瘤的细胞外基质纤维结构与正常组织相比明显增多,其成分以胶原蛋白为主,此外还包括纤维连接蛋白、蛋白聚糖、层粘连蛋白等[2]。肿瘤基质纤维结构能够抑制T细胞向肿瘤间质及癌巢的浸润[3],并且抑制治疗药物向肿瘤内渗透[2]。 本研究中,笔者通过乳腺癌原发灶的HE切片观察肿瘤间质纤维化程度,用免疫组织化学的方法检测淋巴细胞亚群(CD4+T细胞、CD8+T细胞、CD20+B细胞)的浸润强度。分析间质纤维化程度与淋巴细胞浸润的关系,并分析间质纤维化程度与早期乳腺癌术后无病生存(disease free survival,DFS)和总生存(overall survival,OS)的关系。
1 资料与方法
1.1 研究对象纳入标准 2001年1月—2003年12月在解放军总医院手术的具有完整临床及随访资料以及病理标本的Ⅰ~Ⅲ期女性乳腺癌患者。术前检查未发现远处转移,病理证实为乳腺原发肿瘤,医院病理科保存有原发肿瘤的石蜡包埋标本,有完整的临床资料。共136例符合标准。对符合标准的136例患者进行电话随访,失访10例,最终有126例患者被纳入。
1.2 免疫组织化学染色方法 调阅126例乳腺癌患者石蜡组织标本,连续切片3张3 μm薄片分别置于阳离子防脱片上。石蜡切片65℃烘烤2 h,二甲苯脱蜡10 min×2次,梯度乙醇水化,蒸馏水漂洗2 min×3次。将组织切片置于柠檬酸缓冲液(pH6.0)或 Tris-EDTA 缓冲液(pH9.0)中进行高压修复,3%H2O2中避光室温孵育10 min,山羊血清37℃孵育10 min后滴加一抗工作液,4℃冰箱保湿盒内过夜。所用一抗为:鼠抗人 CD8 单克隆抗体(DAKO,623,稀释度 1∶100),兔抗人CD4单克隆抗体 (中衫金桥,ZA-0519,稀释度1∶100),鼠抗人 CD20 单克隆抗体(DAKO,604,稀释度 1∶200)。次日取出保湿盒,复温30 min。漂洗后滴加适量兔鼠通用型EnVisionTM二抗工作液(DAKO),37℃孵箱孵育30 min。以上所有步骤前后均用PBS缓冲液漂洗5 min×3次。DAB显色1~3 min,苏木素复染胞核 1~2 min,盐酸酒精分化,温水返蓝约5 min,显微镜下观察染色及分化程度。梯度乙醇脱水,二甲苯透明,中性树胶封片保存。
实验设阳性对照和阴性对照,阳性片为人扁桃体。阴性对照以一抗稀释液代替一抗。
1.3 免疫组化结果及HE切片人工判读方法 组织切片由2位独立的病理医师(对临床和预后情况不知晓)分别进行分析,核对所得结果,获得共识。淋巴细胞癌巢浸润判读:有明确的阳性淋巴细胞浸润入癌巢的肿瘤细胞之间均判读为癌巢浸润阳性,否则为阴性。CD4+、CD8+淋巴细胞亚群在肿瘤间质密度的计数方法如下:LEICA DM2000显微镜下在切片肿瘤区域随机取15个高倍视野(400×),镜下计数间质阳性细胞数,得出平均每个高倍视野的阳性细胞数并除以高倍视野面积0.31 mm2,得出平均每平方厘米阳性细胞数。CD20+间质细胞判读方法:根据是否存在聚集分布将患者分为聚集阳性和聚集阴性2组。调阅患者原发灶的HE染色切片,随机取3个低倍视野(100×),根据细胞外基质纤维结构(HE切片中为均一的粉红色非细胞结构)的多少分别得出纤维化程度评分:1+=纤维化程度低、2+=纤维化程度中等、3+=纤维化程度高,将3个视野得出评分取平均值得到最终的纤维化程度。
1.4 统计学方法 使用SPSS13.0软件包对数据进行统计学处理。为连续变量的实验参数之间以及与连续变量的乳腺癌临床病理参数的相关性采用Spearman秩和检验。连续变量与二分类变量临床病理参数的相关性采用Mann-Whitney U检验,与三分类变量临床病理参数的相关性采用Kruskal-Wallis H检验。分类变量之间的相关性采用Perason Chi-Square检验。年龄按照中位数(48岁)分为2组并赋值、Ki-67按照公认临界值14%分为2组并赋值,所得数据参与单因素和多因素的生存分析。间质纤维化程度(中位数=2.33)按照中位数分为2组并赋值,所得数据参与生存分析。生存分析选用Kaplan-Meier法,单因素分析显著性检验选用Log-rank检验,多因素分析采用COX风险比例模型。P<0.05为差异有统计学意义,单因素P<0.1被认为存在相关趋势。
2 结 果
2.1 乳腺癌患者特征 对符合纳入标准的136例患者进行电话随访,失访10例,最终有126例患者被纳入,失访率为8.6%。截至最后随访期2013-07-06,中位随访时间104个月(7.7~138.6 个月)。患者中位年龄 48 岁(24~80 岁)。所有患者均未接受手术去势、新辅助放化疗和辅助靶向治疗。32例局部复发和/或转移,27例病死;无病生存率74.6%,总生存率79.2%,中位无病生存和中位总生存期尚未达到。126例乳腺癌患者临床病理因素描述见表1。
2.2 乳腺癌原发灶间质纤维化 乳腺癌间质观察到不同程度的间质纤维化(图1)。
2.3 间质纤维化程度与临床病理因素的相关性分析 间质纤维化程度与 SBR分级负相关 (Kruskal-Wallis H,P=0.024)。间质纤维化程度与年龄、月经状况、临床分期、癌栓、ER、PR、HER-2、Ki67 均不相关。
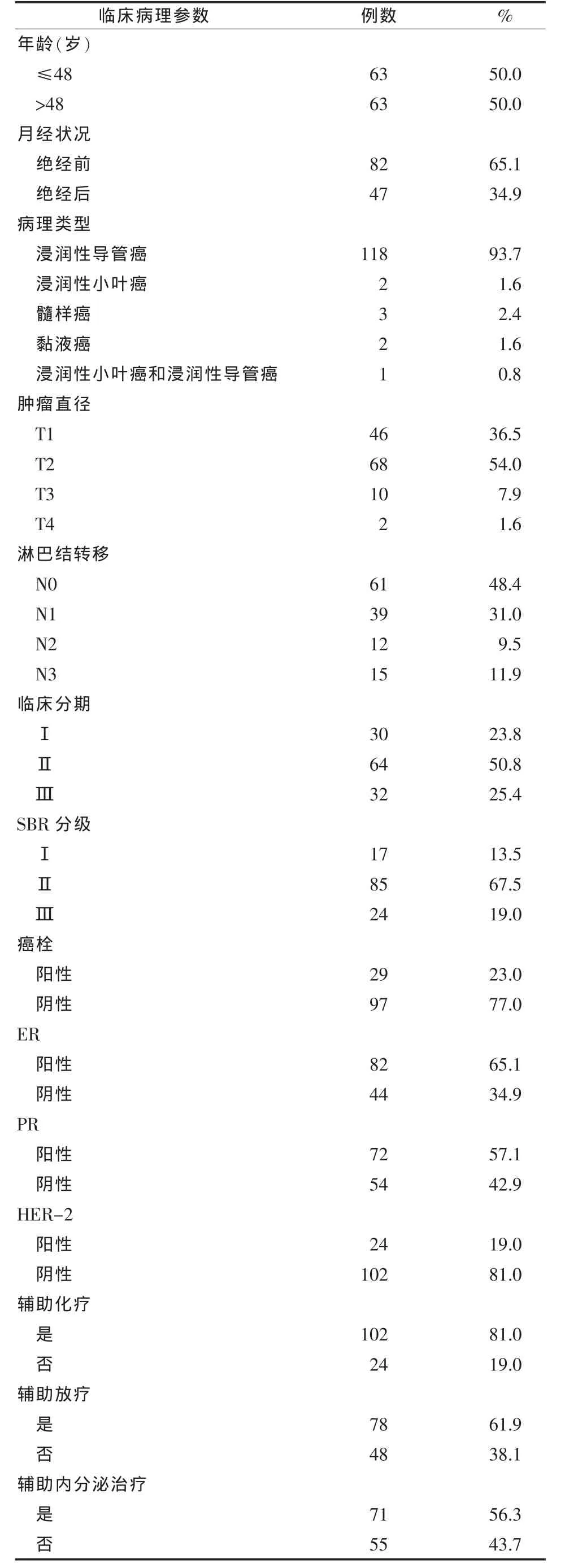
表1 126例乳腺癌患者的临床病理特征
2.4 间质纤维化程度与淋巴细胞亚群的相关性分析 间质纤维化程度与CD20+细胞聚集负相关 (Mann-Whitney U,P=0.002),与 CD4+间质细胞密度负相关(Spearman,P=0.042);与 CD4+细胞癌巢浸润负相关 (Mann-Whitney U,P=0.038),与 CD20+细胞癌巢浸润负相关(Mann-Whitney U,P=0.002)。与CD8+细胞癌巢浸润、CD8+间质细胞密度不相关。
2.5 间质纤维化程度与预后的关系 总体分析时,单因素分析和多因素分析均未见间质纤维化程度与DFS、OS的关联性。各临床病理因素、间质纤维化程度与DFS、OS关系的Cox单因素分析结果见表2。
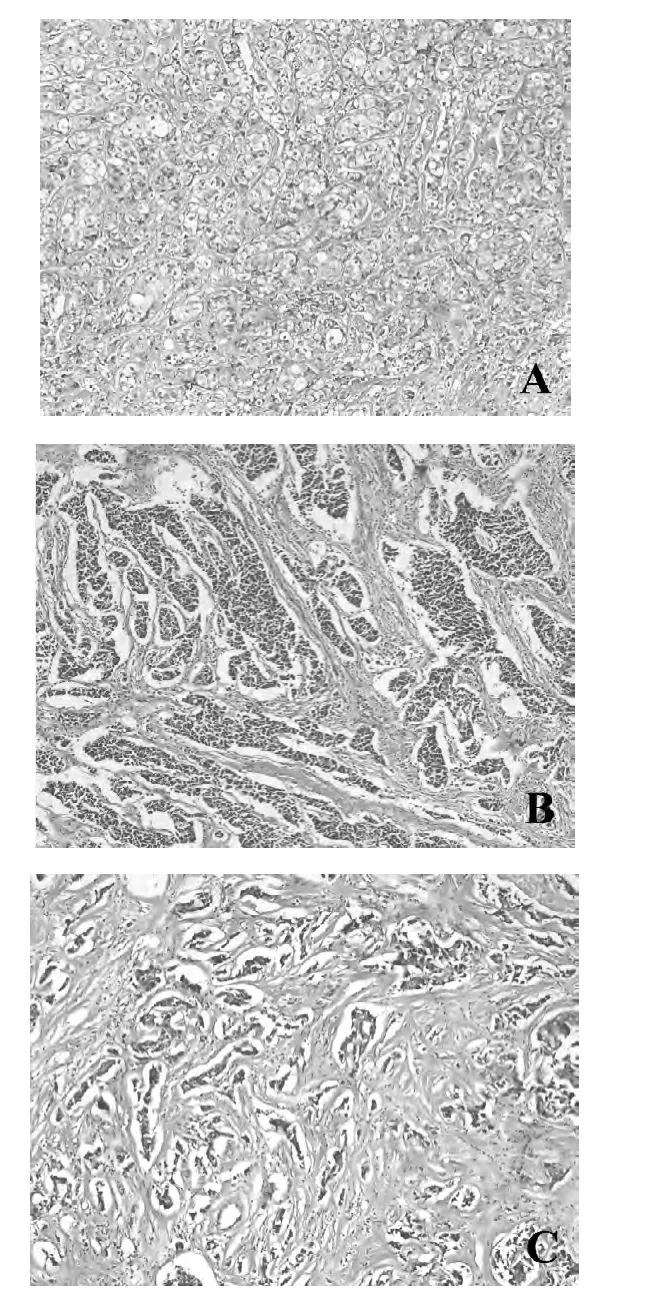
图1 乳腺癌原发灶HE染色结果(200×)
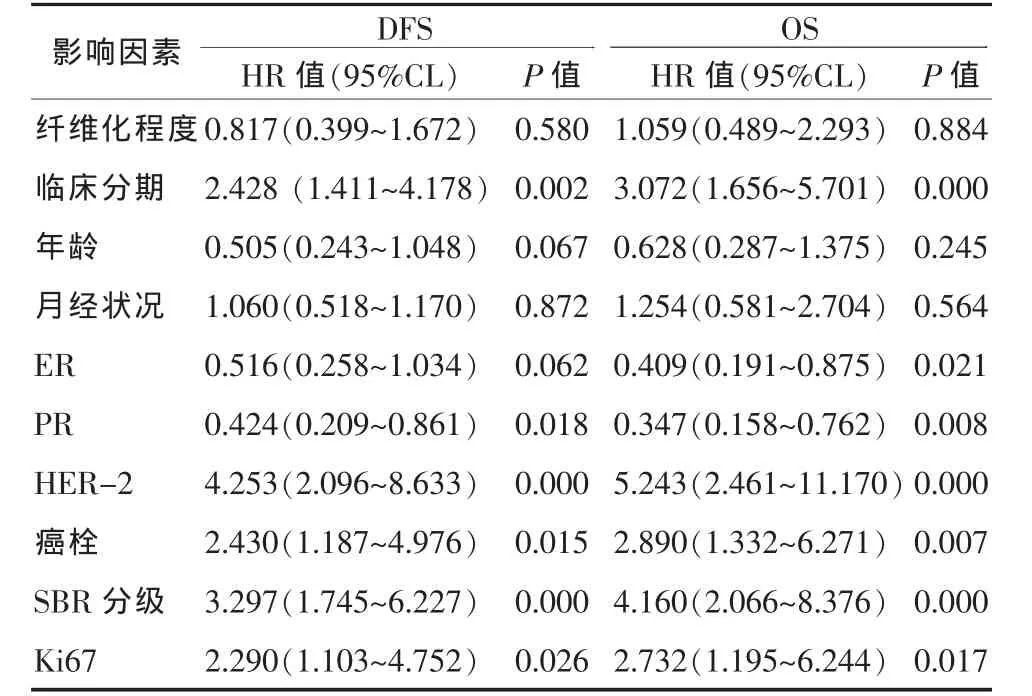
表2 各影响因素与乳腺癌患者DFS、DDFS和OS关系的COX单因素分析
3 讨 论
肿瘤基质中致密的纤维结构形成了T细胞在肿瘤内移动的物理障碍,能够抑制T细胞向肿瘤间质及癌巢的浸润[3]。这一既往研究观察到的现象在本研究中也得到了部分印证。本研究观察到,间质纤维化程度较低的肿瘤间质中,CD20+B细胞聚集的现象更易出现,CD4+T 细胞浸润更多[4,5]。致密的间质纤维结构可能阻碍了B细胞之间空间上的聚集靠近。既往研究认为,乳腺癌间质中CD20+B细胞聚集形成的结构周围聚集着CD4+T细胞形成淋巴滤泡样结构,提示局部存在活跃的免疫反应。间质纤维化程度与CD4+T细胞及CD20+B细胞在癌巢中的浸润负相关,提示,间质纤维化对淋巴细胞向癌巢内移动起到了阻碍作用。
既往研究认为,间质纤维化能够促进肿瘤侵袭并与化疗耐药有关。肿瘤相关成纤维细胞大量合成I型胶原(collagen I),参与间质重构,形成平行有序的基质结构,从而有利于肿瘤细胞的侵袭移动[6,7]。肿瘤相关成纤维细胞合成的I型胶原与给药后肿瘤内较低的化疗药物浓度有关[8]。乳腺癌动物模型研究中,用DNA疫苗降低肿瘤相关成纤维细胞合成I型胶原后,给药后肿瘤内阿霉素等化疗药物的浓度显著增加;可以将乳腺癌肺转移小鼠模型的存活时间与单独化疗相比延长了 3 倍[7]。
总之,乳腺癌原发灶较强的间质纤维化限制了B细胞形成聚集,并且限制淋巴细胞细胞对癌巢的浸润,发挥了抑制免疫的作用。
[1] Reisfeld RA.The tumor microenvironment:a target for combination therapy of breast cancer[J].Crit Rev Oncog,2013,18(1-2):115-133.
[2] Choi IK,Strauss R,Richter M,et al.Strategies to increase drug penetration in solid tumors[J].Front Oncol,2013,3(2):193.
[3] Salmon H,Franciszkiewicz K,Damotte D,et al.Matrix architecture defines the preferential localization and migration of T cells into the stroma of human lung tumors[J].J Clin Invest,2012,122(3):899-910.
[4] Simsa P,Teillaud JL,Stott DI,et al.Tumor-infiltrating B cell immunoglobulin variable region gene usage in invasive ductal breast carcinoma[J].Pathol Oncol Res,2005,11(2):92-97.
[5] Coronella JA,Spier C,Welch M,et al.Antigen-driven oligoclonal expansion of tumor-infiltrating B cells in infiltrating ductal carcinoma of the breast[J].J Immunol,2002,169(4):1829-1836.
[6] Lee HO,Mullins SR,Franco-Barraza J,et al.FAP-overexpressing fibroblasts produce an extracellular matrix that enhances invasive velocity and directionality of pancreatic cancer cells[J].BMC Cancer,2011,11(2):245.
[7] Loeffler M,Krüger JA,Niethammer AG,et al.Targeting tumorassociated fibroblasts improves cancer chemotherapy by increasing intratumoral drug uptake[J].J Clin Invest,2006,116(7):1955-1962.
[8] Heldin CH,Rubin K,Pietras K,et al.High interstitial fluid pressure - an obstacle in cancer therapy[J].Nat Rev Cancer,2004,4(10):806-813.
