不同杂交组合肉羊肌肉组织中MyoD基因mRNA表达的研究
2015-11-28项露颉孙丽敏阮红玲姜怀志吉林农业大学动物科学技术学院长春130118
项露颉,孙丽敏,赵 佳,白 曼,阮红玲,姜怀志(吉林农业大学动物科学技术学院,长春 130118)
遗传育种
不同杂交组合肉羊肌肉组织中MyoD基因mRNA表达的研究
项露颉,孙丽敏,赵 佳,白 曼,阮红玲,姜怀志
(吉林农业大学动物科学技术学院,长春 130118)
生肌决定因子(MyoD)是脊椎动物胚胎期肌肉发育的主导调控基因之一。为了研究MyoD基因mRNA在不同杂交品种肉羊之间的表达差异,试验选取杜泊羊与东北细毛羊杂交(杜东组),小尾寒羊与东北细毛羊杂交(小东组)的两组杂交品种羊各3只,采用实时荧光定量PCR技术,检测MyoD基因的表达量。结果表明:MyoD在各组羊胸肌、后腿肌、背最长肌中均有表达,且在不同杂交组合的同一肌肉组织中表达量差异显著(P<0.05);MyoD基因在杜东组中胸肌的相对表达量为小东组的1.96倍,杜东组中的后腿肌相对表达量为小东组的6.30倍,杜东组中背最长肌的相对表达量为小东组的1.48倍。
肉羊;MyoD;基因表达
随着人们生活水平的提高和膳食结构的改善,羊肉以其独特的营养价值和风味倍受人们的青睐,进而促进了肉羊产业的迅猛发展。国外肉羊业发展的经验表明,利用品种间的杂种优势,采用经济杂交方式是生产优质羊肉最为有效的方法之一。肉羊的主要经济性状是产肉性状和肉质性状,而这二者是与其肌纤维数量和生长密切相关的[1],MoyD(myogenicdiffercntiation 1)基因是正向调节骨骼肌细胞分化和生长的生肌调节因子家族(MRFS)成员之一,与成肌细胞增殖和肌肉增生有关,能促使多种肌细胞的增殖,并调节单核的成肌细胞分化为多核的肌纤维[2]。国内在猪[3-4]、肉牛[5]、山羊[6]等动物的相关研究表明,MoyD基因与动物的产肉性状和肉质性状具有极其密切的相关性,可以作为动物产肉性状及肉质性状的遗传标记。
自上个世纪90年代末期以来,我国肉羊产业发展迅速,但由于缺乏专门化的肉用绵羊品种,各地纷纷利用引进的国外优质肉羊品种与本地绵羊品种进行二元或三元杂交来发展当地的肉羊产业,建立了多种不同的杂交组合模式。吉林省西部农牧交错区近20年来,先后引进多个国外肉用绵羊良种,但由于种羊群体规模较小,广大农户仍以小尾寒羊与当地细毛羊的杂种作为发展肉羊的主要模式。因此,为了比较不同父本品种与当地羊的杂交效果,本研究开展了对不同父本来源的杂交组合羊主要产肉部位肌肉中MoyD基因表达水平的检测,为筛选和优化肉羊杂交组合提供参考依据。
1 材料与方法
1.1 材料
2014年春季于吉林省乾安志华种羊繁育公司的商品肉羊群中,分别在杜泊羊()×东北细毛羊(♀)(简称杜东组)、小尾寒羊()×东北细毛羊(♀)(简称小东组)2个杂交组合中选取出生日期相近,并在相同饲养条件下生长的10月龄育肥羊,屠宰后采集背最长肌、胸肌、腹肌3个部位的样品,置于液氮中保存备用。
1.2 主要试剂和仪器
反转录试剂盒、纯化试剂盒、6×DNA loading buffer、DL 2000dNA Marker、PCR Master Mix、琼脂糖、RNAiso Plus、SYBRgreen Realtime PCR Master Mix等均为Takara公司产品。9700PCR仪和Mx3000P实时荧光定量PCR仪;Tanon2000凝胶成像系统;紫外分光光度计(GeneQuantⅡ,Pharmacia Biotech)。
1.3 荧光定量PCR
1.3.1 总RNA提取和cDNA的合成 肌肉总RNA的提取按Trizol法进行,RNA样品经1%琼脂糖凝胶电泳和紫外分光光度计检测,用核酸浓度测定仪检测提取的总RNA浓度。cDNA第1链合成按照反转录试剂盒的使用说明书进行,PCR反应体系:模版cDNA 2μL,Forward Primer 2μL,Reverse Primer 2μL,2×Taq MasterMix25μL,RNase Freeh2O 19μL;反应条件:94℃预变性2min;94℃ 30s,56℃ 30s,72℃ 30s,26个循环;72℃延伸2min。-20℃冰箱中保存备用。
1.3.2 引物设计 根据GenBank上公布的绵羊MyoD mRNA和β-actin mRNA序列,利用Premier 5.0软件设计MyoD mRNA和β-actin mRNA的引物,由大连宝生物工程公司合成,荧光定量目的基因的引物信息见表1。
1.3.3 荧光实时定量PCR采用SYBR荧光染料法,使用荧光定量PCR仪进行荧光定量,根据SYBRgreen Realtime PCR Master Mix建立PCR反应体系。反应总体系为20μL:其中10μL SYBRgreen Realtime PCR Master Mix,0.8μL PCR Forward Primer(10μM),0.8μL PCR Reverse Primer(10μM),2μL cDNA模板,6.4μLddH2O。95℃预变性1min。PCR循环参数:变性95℃,15s;退火60℃,15s;延伸72℃,45s,循环40次,每次反应均设阴性对照,用于标准曲线的标准品和待测样品(各重复3次)。

表1 荧光定量的目的基因的引物序列信息
1.4 数据统计分析
参照Winer等方法,利用2-ΔΔCt法测定MyoD基因的相对表达水平,β-actin为内参基因校准;对获得的数据利用SPSS17.0软件进行统计分析。
2 结果与分析
由表2可见,MyoD基因mRNA在2种不同杂交组合肉羊的胸肌、腿肌和背最长肌中均有表达,说明该基因不仅是调控纯种地方绵羊肌肉肉质的候选基因,也是调控杂交肉羊肌肉肉质的候选基因。MyoD基因mRNA在杜东组试验羊胸肌、腿肌、背最长肌中的表达水平均显著高于小东组试验羊同一部位的表达水平(P<0.05),且分别为小东组试验羊相应部位肌肉中表达量的1.96倍、6.30倍和1.48倍。MyoD基因mRNA在杜东组试验羊肌肉组织中的表达量为后腿肌>背最长肌>胸肌,而其在小东组试验羊肌肉组织中的表达量为背最长肌>胸肌>后腿肌,说明杂交肉羊的主要产肉部位发育受其父本的影响较大。
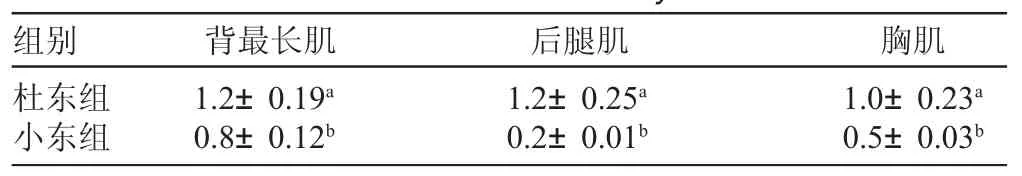
表2 2种杂交组合肉羊不同部位肌肉中MyoD基因的相对表达量
3 讨论
动物的产肉潜力及肌肉品种与肌纤维数量和生长密切相关,所有脊椎动物在出生后,其肌肉中的肌纤维数量是恒定的,即其肌纤维数量是胎儿期形成的,动物生后的肌肉生长主要依赖于肌卫星细胞的增殖分化而导致肌纤维长度和周径增加,而不是依赖于肌细胞数量的增殖[6]。MyoD基因是调控肌肉生成的重要基因,其表达对维持肌细胞分化有重要作用,胚胎期MyoD基因缺失可导致成肌细胞的增殖和分化无法进行[7]。而MyoD基因在动物出生后的主要作用则起到促进多种类型细胞转换为成肌细胞,能促使成肌细胞融合成肌管,进而促进骨骼肌的生长发育[8]。
Brune等[9]研究发现,MyoD基因在不同类型的肌肉组织中有不同的表达模式,并认为这种差异来自于肌肉组织的起源不同。胸肌和腿肌在起源和形成过程中存在一定的差异,胸肌主要是由轴下生肌节的成肌细胞融合而成,腿肌则是由轴下生肌节的成肌细胞迁移到肢芽处分化而成的。陶志云等[10]对高邮鸭和金定鸭胚胎期的骨骼肌发育作用的研究中发现,MyoD基因在不同肌肉中具有不同的表达模式。而本试验也表明,杜东组和小东组肉羊3个不同部位的肌肉中存在MyoD基因mRNA的表达差异。
中国是全世界最大的绵羊饲养国和羊肉第一生产大国。虽然中国有140个绵山羊品种,但固有的绵山羊地方品种中没有专门化的肉用绵羊品种,所生产的羊肉平均胴体重仅为15kg左右。因此,全国各地在发展肉羊生产时,已经开始关注产肉性状和肉质性状的选育与提高。马海玉等对阿勒泰羊MyoD基因的遗传多态性及其与产肉性状的关联性进行了分析,证实MyoD基因可以作为阿勒泰肉羊产肉性能的候选基因[11]。由于目前国内在肉羊生产中普遍采用国外引进优质良种与地方品种的经济杂交模式,但在杂交组合筛选中很少关注不同杂交组合不同部位肌肉的发育状况,而在本研究中发现,杜东组羊主要产肉部位MyoD基因表达水平显著高于小东组羊,正好证实了国外引进的专门化肉用绵羊品种改良本地羊后,可以促使杂种机体的主要产肉部位肌肉优先发育的现象,为国内进一步开展肉羊杂交改良父本品种的选择提供了理论依据。
[1]郭月英,任霞,张静,等.巴美肉羊、小尾寒羊Myf6基因多态性及其与肉质的相关性研究[J].食品工业科技,2014(5):126-129.
[2]李永平,梁炳生.MyoD肌形成作用机制研究进展[J].国际骨科学杂志,2007,28(1):37-40.
[3]朱砺,李学伟,帅素容,等.MyoD基因在不同猪种中的分布及群体遗传结构分析[J].畜牧兽医学报,2007,38(1):1-7.
[4]杨燕军,白亮,庞卫军,等.不同猪品种肌肉组织FoxO1与MyoD基因mRNA的表达及其相关性分析[J].中国生物化学与分子生物学报,2008,24(3):257-261.
[5]田璐,许尚忠,岳文斌,等.MyoD基因对肉牛胴体性状影响的分析[J].遗传,2007,29(3):313-318.
[6]张海军,陈宏,房兴堂,等.山羊MyoD基因家族多态性及与体尺性状的相关性[J].遗传,2007,29(9):1077-1082.
[7]Alves HJ,Alvares LE,Gabriel JE,et al.Influence of the neural tube/nochorcl complexon MyoD expression and cellular proliferation in chicken embryos[J].BrazJ Biol Res,2003,36:191-197.
[8]王琼,朱庆.肌肉生长相关因子MyoD基因的研究进展[J].黑龙江畜牧兽医,2007(4):23.
[9]Brune RM,Bars JB,Dubreuil C,et al.A three-dimension model of the mouse at embryonicday9[J].DevBiol,1999,216(2):457-468.
[10]陶志云,邹剑敏,宋迟,等.鸭胚骨骼肌生肌调节因子MyoD1和Myf5发育性变化的研究[J].中国家禽,2012,34(17):16-19.
[11]马海玉,臧长江,田佳,等.阿勒泰羊MyoD基因的遗传多态性及其与产肉性状的关联分析[J].中国畜牧兽医,2014,41(11):218-222.
Expression of MyoD Gene mRNA in the Muscle Tissues of Different Hybrid Mutton Sheep
XiangLujie,Sun Limin,JiangHuaizhi,et al
(College ofAnimal Science and Technology,Jilin Agricultural University,Changchun 130118,China)
Myogenic determination gene(MyoD)is one of the dominant genes in muscle development in vertebrate embryonic.In order to study the expression of MyoD mRNA in the muscle tissues of different breeds of sheep,the bybrids of Dorper sheep and Small Tail Han Sheep with Northest Fine Wool sheep were used todetect the expression ofMyoD byfluorescence quantitative PCR reaction.The results showed that MyoD gene expression in the pectoral muscle,leg muscle and longissimus muscle in different groups had significant difference(P<0.05);the relative expression in pectoral muscle of MyoD in DD(hybrid of Dorper sheep with Northest Fine Wool sheep)group was 1.96 times as much as the relative expression ofMyoD in XD(hybrid of Small Tail Han sheep with Northest Fine Wool sheep),the relative expression in leg muscle of MyoD in DD group was 6.30 times as much as that in XD,the relative expression in longissimus muscle ofMyoD in DDgroup was 1.48 times as much as that in XD.
mutton sheep;MyoD;gene expression
S826.2
A
2095-3887(2015)05-0001-03
10.3969/j.issn.2095-3887.2015.05.001
2015-05-20
吉林省科技发展计划项目(20110237)、(20120802)
项露颉(1992-),女,硕士研究生。
姜怀志(1968-),男,教授,博士生导师,主要从事绵山羊遗传育种方面的研究工作。
