2-氨甲基吡啶缩5-溴水杨醛席夫碱配合物的合成、表征与抗氧化作用
2015-11-27解庆范卢慧强游兴英卢秀男林长新吴晓玲
解庆范,卢慧强,游兴英,卢秀男,林长新,吴晓玲
(泉州师范学院 化学与生命科学学院,福建 泉州 362000)
Schiff碱是指由含有活泼羰基和氨基的两类物质通过缩合反应形成的含亚胺基(-C=N-)的一类有机化合物.Schiff碱合成相对容易,根据其组成和结构可分为水杨醛类、含硫类、吡啶类、大环类和酰腙类Schiff碱、单、双Schiff碱,以及对称和不对称Schiff碱等类型,其结构丰富多样.Schiff碱含有多个配位原子,与金属有很强的配位能力[1-5].Schiff碱及其配合物具有良好的抗菌、抗癌和抗病毒等广泛的生物活性和药物活性[6]、仿酶催化性[7]、光电性质[8-9],因而越来越受到研究者的重视.研究表明,含有杂环类Schiff碱及其配合物具有良好的抗癌、抗病毒、杀菌和抗氧化等生物活性[10-11].本文作者利用2-氨甲基吡啶与醛类缩合在Schiff碱中引入吡啶杂环[12-15],合成了2-氨甲基吡啶缩5-溴水杨醛Schiff碱的金属配合物,并用DPPH法测定了它们的抗氧化活性.
1 实验部分
1.1 仪器与试剂
AVATAR-360型傅立叶红外光谱仪(美国尼高力);UV-1800PC紫外分光光度计(上海美谱达);Elementar Vario EL型元素分析仪(德国);STA 409PC型热重-差热分析仪(德国耐驰);DDS-320型电导率仪(上海康仪);所用试剂均为分析纯.
1.2 2-氨甲基吡啶缩5-溴水杨醛席夫碱配合物的合成
5-溴水杨醛的合成:按参照文献[9]进行合成.将0.402g(约2mmol)5-溴水杨醛溶于20mL无水乙醇中,加入0.18mL(约2mmol)2-氨甲基吡啶,于70℃下回流搅拌2h;再加入10mL含1mmol乙酸锌的乙醇溶液,并调节溶液pH至6~7,然后在70℃下继续水浴加热搅拌2h;冷却至室温,析出大量的橙红色沉淀,过滤,用无水乙醇洗涤,室温下真空干燥.
以硝酸镉和硝酸钴代替乙酸锌,方法同上,分别得亮黄色镉配合物和棕色钴配合物.
2 结果与讨论
2.1 红外光谱特征
以KBr压片法在400~4 000cm-1的波数范围内测定配合物的红外光谱图,主要吸收数据见表1.
氨基通常在3 300cm-1附近会出现N-H伸缩振动νN-H产生的尖锐的吸收峰,而在3个Schiff碱配合物的IR光谱中未观察到νN-H及归属于5-溴水杨醛羰基νC=O(1 674cm-1)[16]的特征吸收峰.因此配合物的IR中1 632、1 630及1 625cm-1强吸收峰应归属于Schiff碱的亚胺基的伸缩振动νC=N,说明5-溴水杨醛和2-氨甲基吡啶发生缩合形成了Schiff碱(由于亚胺基与不同金属的配位作用不同而发生相对位移).在1 281cm-1处出现的吸收峰为Schiff碱酚羟基的νAr-O特征吸收峰.电导率测定表明锌和镉配合物为非电解质,而钴配合物为1∶1电解质,酚羟基脱除质子与金属配位.出现在3 431、3 454及3 385cm-1处的宽而钝的吸收峰归属于νO-H的特征吸收峰,说明配合物中含有吸附水或是结晶水等水分子.在Co(III)配合物的IR光谱中,在1 384cm-1处还出现了归属于反荷离子NO-3的特征吸收峰,说明在配合物中存在游离的NO-3,即配合物为电解质,这与电导率的测定结果一致.

表1 配合物的红外光谱吸收数据Table 1 IR data of the Schiff base complexes cm-1
2.2 紫外光谱特征
分别配制配合物浓度约为1.0×10-5mol/L的DMF溶液,以DMF为参比,用UV-1800PC型紫外分光光度计扫描其紫外-可见光谱(图1),扫描波长范围为200~500nm.

图1 配合物的紫外光谱图Fig.1 UV spectra of the complexes
在配合物的紫外吸收光谱中分别出现一对吸收峰.在Zn(II)、Cd(II)和Co(III)配合物中268、268、275nm处的吸收峰源自芳环的π→π*跃迁,在379、378和361nm处的吸收峰则源自C=N的n→π*跃迁.由于不同金属离子与亚胺基的配位能力不同,导致最大吸收峰出现位移.
2.3 热重分析
在N2的保护下,以10℃/min的升温速率分析了配合物的热分解行为,结果如图2所示.

图2 配合物的热分析图Fig.2 Thermal analysis of complexes
配合物Zn(II)、Cd(II)的热重分析图显示,配合物不含结晶水和配位水,室温至60℃失重与脱除吸附水有关.因为锌离子与配体的结合力更强,所以锌配合物的热稳定性比镉配合物高.配合物的分解温度分别为240和160℃,其分解基本分为两阶段,第一阶段失去吡啶环片段;第二阶段失重对应于溴苯片段的分解、炭化和挥发.锌配合物在800℃后仍有失重,而镉配合物在740℃后基本恒重.
Co(III)配合物失重也分3个阶段.第一阶段失重区间为55.7~100.6℃,为结晶水失重阶段,失重10.1%,相当于失去3个结晶水,这与理论计算值(9.5%)基本相符.配合物从210℃开始分解,在210~402℃阶段失重约34%,在402~748℃区间失重约33.5%,残重约22%.
2.4 元素分析和摩尔电导率
配合物的元素分析结果和摩尔电导率测定结果见表2.

表2 配合物的元素分析及摩尔电导率Table 2 Elemental analysis and molar conductance of the Schiff base and its complexes
由表2可知,配合物的元素分析结果与理论计算值相符.摩尔电导率测定结果表明,Zn(II)、Cd(II)两个配合物均为非电解质,Co(III)配合物为1∶1型电解质,这与红外光谱表征一致.(Co(III)配合物中的钴离子为Co3+,它是由Co2+在配合物的合成过程中被氧氧化成了Co3+.)
2.5 席夫碱及其配合物的抗氧化性
DPPH是一种以氮为中心的很稳定的自由基,其乙醇溶液在517nm处有最大吸收峰,若Schiff碱及其配合物能清除它,则说明Schiff碱及其配合物具有降低羟基等自由基和打断脂质过氧化链反应的作用.目前DPPH法己被广泛用于自由基清除剂的筛选工作中[17].按照文献[17]的方法,将0.2mL不同浓度的样品溶液分别与3.8mL 6.35×10-5mol/L的DPPH乙醇溶液混合均匀,放置在暗处反应30min后以无水乙醇为参比,在517nm处测其吸光度,计算其清除DPPH的清除率K.
K=[(A0-As)/A0]×100%
式中:A0为DPPH乙醇溶液在517nm处的吸光度;As为不同浓度样品与DPPH溶液反应30min后在517nm处的吸光度.以清除率对溶液质量浓度作图,得到席夫碱及配合物对DPPH自由基清除率曲线(图3).由图3可知,2-氨甲基吡啶缩5-溴水杨醛Schiff碱Zn(II)、Cd(II)配合物对DPPH自由基的清除能力均较弱,但随质量浓度增加,清除率呈上升趋势;而Co(III)配合物在低浓度时对DPPH自由基有弱的清除能力,然后随浓度的增加清除率下降.Co(III)配合物溶液的颜色为棕红色,在517nm处亦有吸收.配合物对DPPH清除率随浓度的增加而下降,这是由于没有与DPPH反应的Co(III)配合物溶液在517nm处产生吸收,致使As增大.

图3 配合物对DPPH自由基清除率曲线Fig.3 Curves of scavenging rate of complexes series on DPPH
3 结论
合成了5-溴水杨醛缩2-氨甲基吡啶Schiff碱的Zn(II)、Cd(II)和Co(III)配合物[ZnL2]、[CdL2]和[CoL2]NO3·3H2O,它们对DPPH自由基具有清除能力,但均较弱.初步推测这三种配合物的配位结构如图4所示.
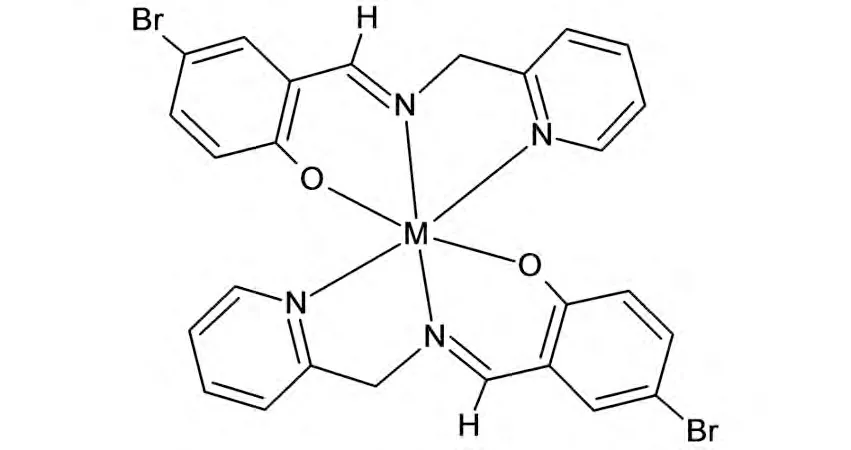
图4 配合物的配位结构(M=Zn、Cd、Co)Fig.4 Coordination structure of the complexes(M=Zn,Cd,Co)
[1]张淑华,蒋毅民,陈美基.5-氯,N(2-磺酸基乙基)水杨醛亚胺Schiff碱的合成及表征[J].广西师范大学学报:自然科学版,2004,22(2):59-61.
[2]李冬成,姚克敏,曹美华,等.稀土元素与3,4-二羟基苯甲醛缩邻氨基苯甲酸配合物的合成和表征[J].应用化学,1993,10(3):8-11.
[3]GUPTA K C,SUTAR A K.Catalytic activities of Schiff base transition metal complexes[J].Coord Chem Rev,2008,252:1420-1450.
[4]SINGH N K,AGRAWAL M S,AGRAWAL R C.Synthesis,structure and antifungal studies of some 3d metal complexes of salicylaldehrde-2-furanthio-carboxyhrdraone[J].Synth React Inorg Met Org Chem,1985,15(1):75-92.
[5]叶勇,胡继明,曾云鹦.三种席夫碱化合物对DNA作用的表面增强啦曼光谱研究[J].光散射学报,1999,11(3):190-193.
[6]蒋毅民,张淑华,徐庆.双核Cu(II)牛磺酸缩水杨醛席夫碱配合物的合成晶体结构及生物活性[J].化学学报,2003,61:573-577.
[7]梁芳珍,杜鸣,任建成.水杨醛缩2-氨基,4-苯基噻唑及其配合物的合成与仿酶催化活性研究[J].无机化学学报,1999,15(3):393-396.
[8]邓崇海,胡寒梅,丁爱民,等.一种新型席夫碱钌联吡啶配合物的光电性质研究[J].合肥学院学报,2005,11(1):22-25.
[9]张秀梅,高伟,褚道葆.水杨醛缩氨基酸、联毗咤配合物的电化学合成[J].安徽大学学报:自然科学版,2007,31(5):69-73.
[10]张金花.2-氨甲基吡啶类席夫碱过渡金属配合物的合成、结构和性质研究[D].西安:西北大学,2005.
[11]梁芳珍.5-溴水杨醛硫代双酰腙的合成与生物活性[J].山东师范大学学报,2003,18(1):50-51.
[12]VIGAT P A,TAMBURINL S.The challenge of cyclic and acyclic Schiff bases and related derivatives[J].Coord Chem Rev,2004,248:1717-2128.
[13]MICHEL L C,KEITU G O,ANTHONY G O,et al.Coordination properties of unsymmetrical Schiff base ligands containing N3donor sets when restricted to bidentate chelate bonding modes.Crystal structures of fac-[PtIMe3(PMAMP)](PMAMP=2-{(2′-pyridylmethylene)aminomethyl}pyridine)and fac-[PtIMe3(PMAQ](PMAQ=8-{(2′-pyridylmethylene)amino}quinoline)[J].Inorg Chim Acta,2000,299:209-220.
[14]姜宗慧,阎世平.合成大环化合物的模板反应[J].化学通报,1984(11):1-6.
[15]TANDON S S,CHANDER S,THOMPON L K.Ligating properties of tridentate Schiff base ligands,2-[[(2-pyridinylmethyl)imino]methyl]phenol(HSALIMP)and 2-[[[2-(2-pyridinyl)ethyl]imino]methyl]phenol(HSALIEP)with zinc(II),cadmium(II),nickel(II)and manganese(III)ions.X-ray crystal structures of the[Zn(SALIEP)(NO3)]2dimer,[Mn(SALIEP)2](ClO4),and[Zn(AMP)2(NO3)2][J].Inorg Chim Acta,2000,300/301/302:683-692.
[16]陈延民,解庆范,黄妙龄.5-溴水杨醛缩三乙烯四胺Schiff碱配合物的合成与表征[J].化学研究,2009,20(2):29-32.
[17]樊素芳,杨国玉,徐翠莲,等.壳寡糖水杨醛系列席夫碱的抗氧化作用[J].河南农业大学学报,2012,46(6):687-690.
