闽江口不同沼泽植被带土壤甲烷产生潜力的温度敏感性
2015-11-24何清华湿润亚热带生态地理过程教育部重点实验室福建福州350007福建师范大学地理科学学院福建福州350007福建师范大学地理研究所福建福州350007福建师范大学亚热带湿地研究中心福建福州350007
杨 平,何清华,仝 川(1.湿润亚热带生态-地理过程教育部重点实验室,福建 福州 350007;2.福建师范大学地理科学学院,福建 福州 350007;3.福建师范大学地理研究所,福建 福州 350007;4.福建师范大学亚热带湿地研究中心,福建 福州 350007)
闽江口不同沼泽植被带土壤甲烷产生潜力的温度敏感性
杨 平1,2,何清华1,2,仝 川1,3,4*(1.湿润亚热带生态-地理过程教育部重点实验室,福建 福州 350007;2.福建师范大学地理科学学院,福建 福州 350007;3.福建师范大学地理研究所,福建 福州 350007;4.福建师范大学亚热带湿地研究中心,福建 福州 350007)
2012年2月采集闽江河口鳝鱼滩短叶茳芏(Cyperus malaccensis),芦苇(Phragmites australis)和互花米草(Scirpus alterniflora) 3个典型潮汐沼泽植被带0~30cm(间隔5cm)土壤样品,在不同温度(10,20和30℃)进行15d室内厌氧培养实验,探讨河口区不同沼泽植被带土壤甲烷产生潜力及其温度敏感性(Q10值)的特征.结果表明,指数模型较好地拟合不同沼泽植被带土壤甲烷产生与温度的相关关系;温度由10℃升至20℃时,3个沼泽植被带土壤甲烷产生潜力Q10值的均值分别为5.04,14.92和14.81,最大值均在培养期间的第13~15d分别出现于10~15cm,15~20cm和20~25cm三个土层;温度由20℃升至30℃时,3个沼泽植被带土壤甲烷产生潜力Q10值的均值分别为3.56,4.99和3.43,最大值分别在培养期间的第4~6d,第4~6d和第7~9d出现于0~5cm,0~5cm和15~20cm三个土层;植被类型和土壤深度对甲烷产生潜力及Q10值均具有显著的影响(P<0.05).
甲烷产生潜力;温度敏感性;Q10值;植被类型;潮汐湿地;闽江河口
甲烷作为仅次于二氧化碳的重要温室气体,在100年时间尺度内其增温潜势是二氧化碳的25倍[1],对全球气候变暖的贡献率达20%左右[1-2].甲烷排放,时空变化规律及产生机制日益受到科学界的重视[3-6].湿地是大气中甲烷主要的自然排放源.据统计,全球天然湿地甲烷年排放量约100~250Tg[7-9],占甲烷总排放量的15%~40%[1,9].目前,国内外学者已对不同湿地生态系统的甲烷排放特征进行较多研究[5-6,10-11].湿地甲烷排放是甲烷产生,传输和氧化过程综合作用的结果,其中甲烷产生是甲烷排放的基本环节.探讨甲烷产生及其对不同环境因子的响应,对于揭示湿地生态系统甲烷排放的关键机制具有重要意义[12].
温度是控制湿地土壤甲烷产生的关键因子[13-14].在全球变暖背景下,关于湿地土壤甲烷产生对温度升高响应的问题已引起相关学者关注[14-16].Valentine等[15]通过“温度T下的甲烷产生量/温度(T-10)下的甲烷产生量”简单的线性关系直接描述甲烷产生对温度升高的响应(Q10值).van Hulzen等[16]通过建立模型探讨荷兰Nieuwkoopse Plassen湿地土壤甲烷产生对温度变化的响应,研究发现土壤甲烷产生的Q10值分为1.1(4~13.5℃)和1.5(13.5~30℃) 2个部分,并指出该种情况与电子受体还原过程持续时间,产甲烷菌活性及底物有效性等密切相关.Updegraff等[17]对美国明尼苏达州的湿地研究也发现类似结果,并指出甲烷产生与温度间呈现指数式增长关系.但Frenzel等[18]在芬兰沼泽的实验中发现土壤甲烷产生对温度的响应并非一定是指数增长模型.Segers[19]对文献中湿地甲烷产生潜力Q10值进行统计,得出甲烷产生潜力Q10值的平均值为4.1,但是变化幅度很大(1.5~28).以上关于湿地土壤甲烷产生对温度变化响应的研究主要聚集在北方湿地,对广大热带和亚热带区域湿地鲜见报道.仅见于Inglett等[14]通过采用Van't Hoff模型拟合甲烷产生潜力与温度之间的关系来研究亚热带圣约翰河源头一个湿地甲烷产生的Q10值.
热带和亚热带区域湿地面积占全球湿地总面积的30%[14,20-21].该区域湿地土壤甲烷产生Q10值的精确量化,对于在区域和全球尺度上评估湿地甲烷产生潜力对气候变暖的响应显得尤为重要[14].本文以地处我国亚热带地区的闽江河口潮汐沼泽湿地为研究对象,采集不同优势沼泽植物群落湿地土壤,测定分析了不同温度下的土壤甲烷产生潜力及其Q10值,旨在:揭示不同植被带土壤甲烷产生潜力的温度敏感性(Q10)特征;探讨植被类型,土壤深度及温度对湿地土壤甲烷产生潜力及Q10值的影响.
1 材料与方法
1.1 研究区概况
研究区域位于闽江河口区面积最大的鳝鱼滩湿地(119°34′12″~119°40′40″E,26°00′36″~26°03′42″N),面积3120hm2.该区域地处中亚热带和南亚热带海洋性季风气候的过渡区,温暖湿润,干湿季明显,年平均气温19.7℃,年均降水日153d,年均降水量1346mm,降水主要集中于3~9月[22].研究区潮汐属于典型的半日潮,水源包括天然降水,河水和潮水.鳝鱼滩湿地主要的优势植物有短叶茳芏(Cyperus malaccensis),芦苇(Phragmites australis)和外来入侵物种互花米草(Spartina alterniflora),所占比例分别为25,15和60%.本研究位于鳝鱼滩湿地的西部,自岸向海方向依次分布着芦苇沼泽植被带,短叶茳芏沼泽植被带和互花米草沼泽植被带,土壤基本理化性质见表1[23].

表1 研究区3个沼泽植被带土壤基本理化特征Table 1 Soil physiochemical properties of three marsh vegetation zones in the Shangyutan wetland in the Min River estuary
1.2 研究方法
1.2.1 土样采集 3个植被带群落结构简单,均为单一种群落.2012年2月中旬,由岸向海方向设置1个样线穿过3个植被带,在每个植被带内的样线中部每隔10m设置1个土壤采样点,每个植被带共3个土壤采样点(图1),每个采样点3个重复,每个植被带9个土芯.用直径为5.5cm的土钻取深度为0~30cm土芯,按顺序将土芯分成层分别代表0~5cm,5~10cm,10~15cm,15~20cm, 20~25cm和25~30cm,共6层(每层3个重复),分别用I,II,III,IV,V和VI表示.各层土芯以原始形态直接装入自制的培养瓶内(150mL),带回实验室后立即进行室内厌氧培养实验,间隔不超过24h.

图1 研究区和采样点位置Fig.1 Locations of study area and sampling sites
1.2.2 甲烷产生潜力室内厌氧培养及测定 每个培养瓶加入20mL去离子水淹没土样,再用橡皮塞和704硅胶密封培养瓶口.培养瓶内的厌氧环境通过充入高纯氮气实现.3个室内厌氧培养温度分别设置为10,20和30℃,每个温度下3个重复,共培养15d.培养期间,每天采集1次气样,每次抽取培养瓶上部3mL气样.每次抽完气体后,重新补上3mL高纯氮气,然后继续培养.采用气相色谱仪(日本岛津GC-2010)对气样进行每天测定1次,每3d计算1次甲烷产生潜力,共5个甲烷产生潜力值.为防止培养瓶内甲烷浓度过高而对甲烷产生造成抑制作用,每采集完3次气样,用高纯氮气洗气3~5min.气相色谱仪甲烷测定检测器为FID (火焰离子检测器),载气为氮气,流速为30mL/min;氢气为燃气,流速为47mL/min;空气为助燃气,流速为400mL/min;检测器温度为200℃,柱箱温度为45℃.
1.2.3 甲烷产生潜力计算 湿地甲烷产生潜力计算公式[24]如下:

式中:P为甲烷产生潜力[μg/(g·d)];dc/dt为培养气室上部气相甲烷浓度单位时间的变化率;VH为培养气室上部气体体积(L);WS为干土柱重[即为鲜土体积×容重](g);MW为甲烷摩尔质量(g/mol);MV为标准状态下气体摩尔体积(22.4L/mol);Tst为标准温度(K);T为培养温度(℃).
1.2.4 甲烷产生潜力Q10值的计算 采用指数模型(Van't Hoff模型)来拟合甲烷产生潜力与温度间的关系[25-27]:

式中:P为土壤甲烷产生潜力[μg/(g·d)],T为培养温度(℃), a为温度0℃时的甲烷产生潜力, b为温度反应系数[26].
采用修正后的Van't Hoff模型来计算温度敏感系数Q10值[14],公式如下:

式中:k1和k2分别是在T1和T2温度下的甲烷产生潜力值P.
1.2.5 数据处理与分析 采用Excel 2003对原始数据进行处理.运用SPSS17.0统计分析软件中的One-Way ANOVA的LSD检验(least significant difference test)分别对同一沼泽植被带不同深度、不同沼泽植被带间的土壤甲烷产生潜力及其Q10值进行单因子差异性方差分析.采用单变量多因素分析方法检验了植被类型、土壤深度和温度对土壤甲烷产生潜力的影响(表3);采用单变量双因素方差分析法(Two-Way ANOVA)检验植被类型、土壤深度对温度敏感系数Q10值的影响(表4);统计检验的显著水平为α=0.05.回归拟合采用SPSS 17.0中Curve Estimation中的Exponential实现,并结合Origin 8.0辅助作图.
不同土层甲烷产生潜力对温度变化响应的分析中,各土层甲烷产生潜力是每层的5个甲烷产生潜力值×3个重复,每层共15个值.在土壤甲烷产生潜力随时间变化的分析中,各沼泽植被带土壤甲烷产生潜力是5个时段的甲烷产生潜力值×3个重复,共15个值.文中误差线均为标准误差.
2 结果与分析
2.1 甲烷产生潜力对温度的响应
2.1.1 甲烷产生潜力的土壤剖面特征 短叶茳芏、芦苇和互花米草沼泽植被带土壤甲烷产生潜力最大值出现的土层均随培养温度的变化而变化(图2).10℃培养条件下,3个沼泽植被带土壤甲烷产生潜力最大值分别出现在第IV层[0.181μg/ (g·d)]、第V层[0.144μg/(g·d)]和第VI层[0.437μg/ (g·d)],对总的甲烷产生潜力的贡献率分别为28.4, 26.3和39.8%. 20℃培养条件下,3个沼泽植被带土壤甲烷产生潜力最大值分别出现在第III层[0.999μg/(g·d)]、第V层[3.340μg/(g·d)]和第V层[4.956μg/(g·d)]的深度,贡献率分别为48.3,55.0和38.3%.30℃培养条件下,甲烷产生潜力最大值分别出现在第VI层[1.642μg/(g·d)]、IV层[2.294μg/(g·d)]和VI层[3.935μg/(g·d)]的深度,贡献率分别为38.9,34.5和32.4%.
单因素方差分析显示,培养温度为10℃时,短叶茳芏沼泽第IV层土壤甲烷产生潜力显著高于第I,II和III层 (P<0.05);芦苇沼泽土壤第V层显著高于第II 和III (P<0.05),互花米草沼泽第VI层显著高于第I,II,III,IV,V层(P<0.05).20℃时,短叶茳芏沼泽的第III层土壤甲烷产生潜力显著高于第I,II,IV,VI层(P<0.05),芦苇沼泽的第V层显著高于第I,II,III,VI层(P<0.05),互花米草沼泽的第V层均显著高于第I,II,III层(P<0.05).30℃时,短叶茳芏沼泽的第VI层土壤甲烷产生潜力均显著高于第I,II,III层(P<0.05),芦苇沼泽第IV层显著高于第I,II,III层(P<0.05),互花米草沼泽的第IV,VI层均显著高于第I,II,III层(P<0.05) (图2).

图2 不同温度下3个沼泽植被带湿地土壤甲烷产生潜力随深度的变化(15d培养期的平均值±标准误差)Fig.2 Methane production potential in different soil depths in three marsh vegetation zones
2.1.2 甲烷产生潜力随培养时间的变化 培养温度为10℃时,3个沼泽植被带土壤甲烷产生潜力在培养期内一直处于较低水平,平均值分别为0.106,0.091和0.183μg/(g·d),最大值分别出现在培养的第1~3d,10~12d和13~15d.培养期间,土壤甲烷产生潜力在大小顺序上表现为互花米草沼泽>短叶茳芏沼泽>芦苇沼泽(P<0.05)(图3).与10℃时相比,20℃培养温度显著增加了3个沼泽植被带土壤甲烷产生潜力(P<0.001).培养期间,各植被带土壤的甲烷产生潜力均随着培养时间推移而增加,平均值分别为0.345,1.012和 1.660μg/(g·d),最大值均出现在培养的第13~15d;此外,互花米草沼泽土壤甲烷产生潜力极显著的高于短叶茳芏沼泽(P=0.003).与培养温度为10和20℃时相比,30℃更明显地增加了各植被带土壤甲烷产生潜力,其中30℃时芦苇沼泽土壤甲烷产生潜力显著高于10℃(P=0.002).培养期间,各植被带土壤甲烷产生潜力亦均随培养时间延伸而增加,平均值分别为0.794,1.141和2.021μg/(g·d),最大值亦均出现在培养的第13~15d.培养期间,亦呈现出互花米草沼泽土壤甲烷产生潜力极显著高于短叶茳芏沼泽(P=0.010).

图3 土壤甲烷产生潜力随培养时间的变化Fig.3 Change of methane production potential in 15 days incubation
2.2 甲烷产生潜力温度敏感性分析
2.2.1 不同土壤深度的Q10值 不同深度土壤甲烷产生潜力Q10值因植被类型和培养温度不同而存有差异.培养温度从10℃升高至20℃时,3个沼泽植被带土壤剖面甲烷产生潜力Q10值变化范围分别为0.98~19.93,0.85~42.41和8.57~32.82,平均值分别为5.04,14.92和14.81,最大值分别出现第III层、第IV层和第V层(表2).培养温度从20℃升高至30℃时,3个沼泽植被带土壤剖面甲烷产生潜力Q10值变化范围分别为0.19~5.75,0.33~10.81和0.85~11.78,平均值分别为3.56,4.99和3.43,最大值分别出现第I层、第I层和第IV层的深度(表2).
2.2.2 Q10值随培养时间的变化 培养温度从10℃升高至20℃时, 3个沼泽植被带土壤甲烷产生潜力的Q10值均随培养时间推移而增大(图4),并均在第13~15d达到最大值;培养期间只有芦苇沼泽第13~15d的Q10值显著高于第1~3d(n=6,P<0.05). 该种增温条件下,互花米草沼泽和芦苇沼泽土壤甲烷产生潜力Q10值均显著大于短叶茳芏沼泽(P<0.05).培养温度从20℃升高至30℃时,3个沼泽植被带土壤甲烷产生潜力的Q10值分别在培养第4~6d、第4~6d和第7~9d时段达到最大,随后开始变小(图4).各植被带不同培养时段土壤甲烷产生潜力Q10值差异性均不显著(P>0.05).该增温条件下,互花米草沼泽土壤甲烷产生潜力Q10值均要显著的大于短叶茳芏沼泽和芦苇沼泽(P<0.05).

表2 不同深度土壤甲烷产生潜力与温度间的指数拟合关系及Q10值Table 2 Relationships between soil methane production potential and temperature and Q10values in the different depths
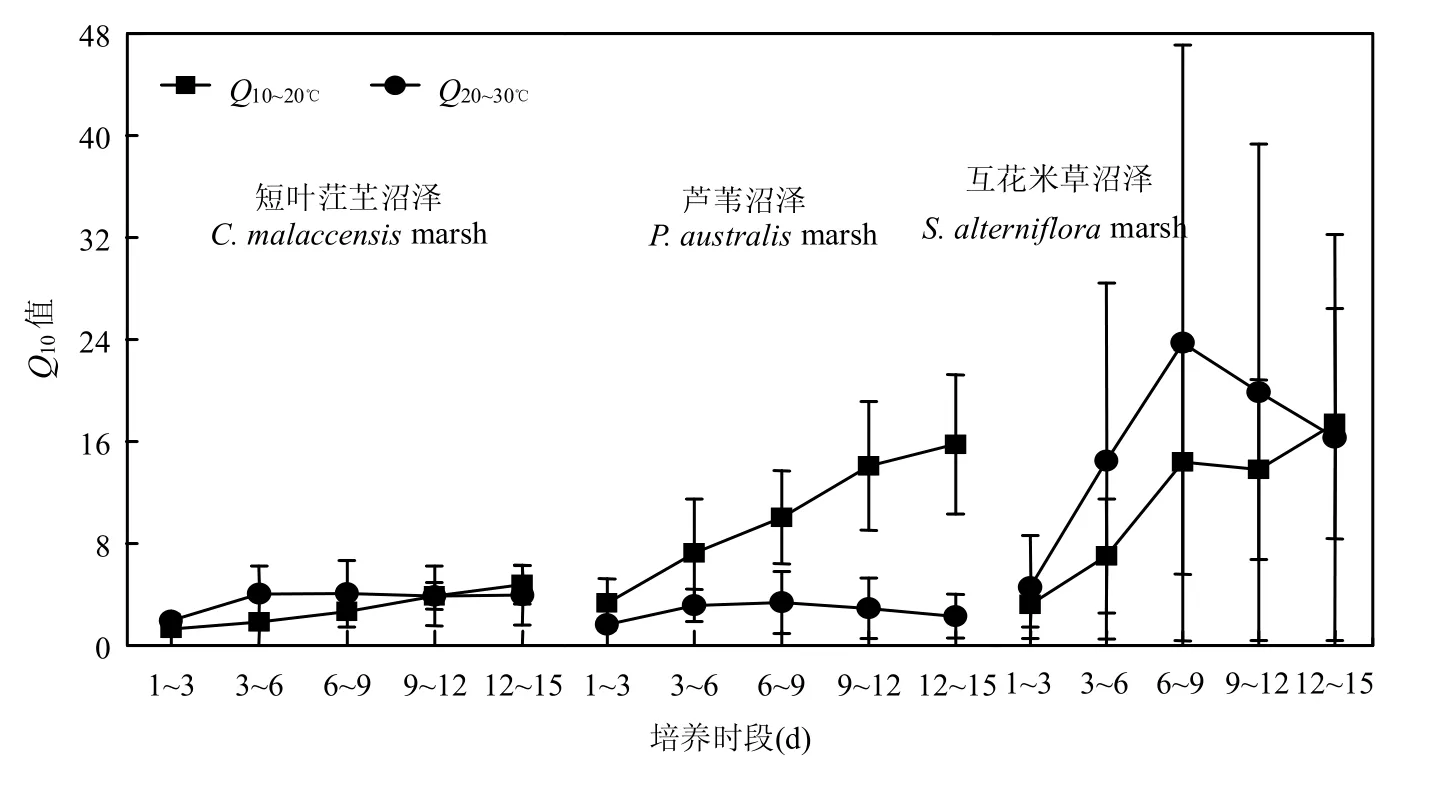
图4 土壤甲烷产生潜力Q10值的时间变化Fig.4 Variations of Q10values of soil methane production potential in 15 days incubation
3 讨论
3.1 植被类型、土壤深度和温度对土壤甲烷产生潜力的影响
相同培养温度下,不同种类植物占优势的湿地土壤甲烷产生潜力明显不同(F=4.397, P= 0.009)(表3),说明植被类型对湿地土壤甲烷产生潜力具有显著影响.这一现象在其他区域的研究中也被发现.Inglett等[14]对美国佛罗里达洲圣约翰河淡水沼泽的研究发现,优势植物为香蒲(Typha domingensis)和荸荠(Eleocharis interstincta)的植物群落土壤甲烷产生潜力高于其他3种沼泽植被(克拉莎 Cladium、黍Panicum,柳树Salix),主要原因之一是由于5种植物群落土壤有机物中易分解碳所占比例不同而引起,不同植物群落易分解碳含量的大小顺序为香蒲(16%)>荸荠(11.3%)>黍(8.0%)>克拉莎(7.0%)>柳树(5.0%).McKenzie等[28]对加拿大安大略湖西北部森林湿地, Bergman等[29]对瑞士Storamyren泥炭沼泽的研究也认为:土壤有机质质量差异是造成不同植被类型间土壤甲烷产生潜力不同的重要因素.因为植物释放或残留的有机物质是产甲烷菌所需底物和能量的重要来源[30],有机质(尤其是不稳定性或可溶性有机物,如DOC)越丰富,底物和能量供应也就越充足,土壤产甲烷能力会越强[31].但在本研究中,土壤DOC与甲烷产生潜力关系较为复杂.本文中,互花米草沼泽与短叶茳芏沼泽间的土壤DOC并无显著差异,甲烷产生潜力却表现出互花米草>短叶茳芏(P<0.001);而芦苇沼泽土壤DOC含量显著低于短叶茳芏沼泽,但甲烷产生潜力表现出芦苇沼泽>短叶茳芏.其可能原因,一是土壤有机质中的DOC含量并不是影响甲烷产生潜力的唯一因素,还会受到土壤有机质中SOC含量的影响.芦苇沼泽DOC虽然显著低于短叶茳芏沼泽,其SOC却显著高于短叶茳芏沼泽,较高的SOC对芦苇沼泽土壤甲烷产生潜力产生具有一定的促进作用[14].二是不同植被类型的群落盖度、根系分布和地下生物量不同[14,32],并与周围环境和土壤相互作用,形成的不同土壤理化性质[29-30,33]等均会影响到沼泽植被带土壤甲烷产生潜力.
关于湿地不同深度土壤甲烷产生潜力对温度响应的研究结果大多数指出,湿地土壤甲烷产生潜力随土壤深度的增加而降低. Dasselaar等[34]对泥炭沼泽土壤研究结果表明,0~5cm是甲烷产生的主要发生层,该层产生的甲烷占总甲烷产生量的70%,且甲烷产生能力随土壤深度增加而大大降低.Avery等[13]对美国White Oak河口潮汐湿地的研究也得出类似结论,并且指出0~10cm是甲烷产生的主要发生层.他们认为这种现象可能是由于不同土层产甲烷基质供应能力所致.本研究也发现,深度对3个沼泽植被带土壤甲烷产生潜力具有显著影响(F=3.845, P=0.003)(图2和表3).但与前人研究所不同的是,本文中各沼泽植被带土壤甲烷产生潜力的最大值并不是出现在表层(0~10cm),总体上出现在20~30cm处.原因之一,可能与研究区域周期性涨落潮及水文动力学过程有关.涨落潮是影响潮汐湿地的一个重要环境因素,在潮汐的影响下,表层土壤较好的水分运动致使碳、氮等元素更易发生水平运移而被潮水带走,或垂直淋失到较深土层,进而导致深层土壤甲烷产生潜力较高.
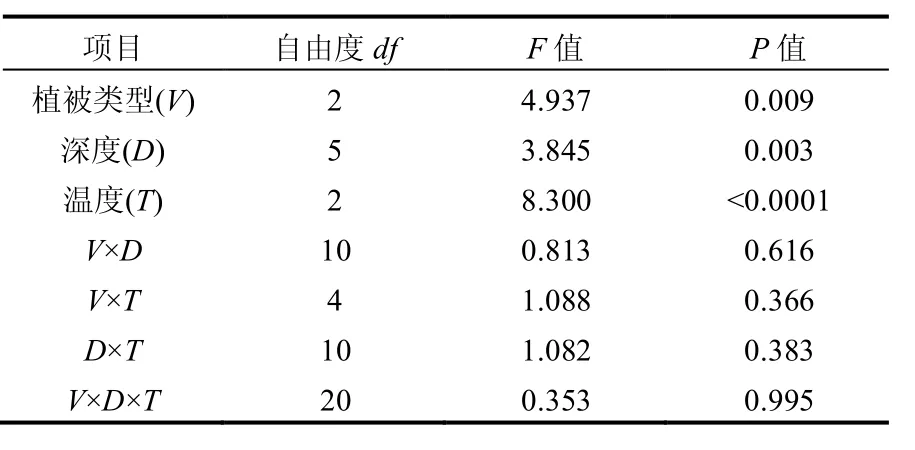
表3 植被类型、土壤深度和温度对甲烷产生潜力的影响及交互作用的影响Table 3 Effects of vegetation type, soil depth and temperature on methane production potential
3个沼泽植被带土壤甲烷产生潜力均随温度的上升而增强,温度对湿地土壤甲烷产生潜力有极显著影响(F=3.845, P<0.0001),这与其他学者的研究结果相似[20,35].温度上升对甲烷产生潜力的促进作用,主要表现在以下2个方面:(1) 温度上升可激发土壤微生物活性,促进土壤有机质分解,产甲烷菌底物供应充足[13-14];(2) 温度上升可改变产甲烷菌菌种的组成,促进优势产甲烷菌群落演替来提高产甲烷菌的产甲烷能力[36].
3.2 温度、植被类型和土壤深度对Q10值的影响
已有研究表明,不同区域不同湿地类型,其Q10值变幅较大(表4).Segers[17]通过对已有文献报道的分析显示,湿地土壤甲烷产生潜力Q10值范围可达1.5~28,均值为4.1.本文对闽江河口沼泽湿地的研究发现,湿地土壤甲烷产生潜力Q10值范围为3.43~14.9,平均值为7.9.从数据分析,闽江河口的Q10值变幅处于Segers[19]研究所报道的范围之内,但平均Q10值要高于Segers[19]的研究结果.此外,与纬度偏北的泥炭湿地以及同处于亚热带的淡水沼泽湿地相比较,本研究中的Q10值均要高于上述地区.不同区域或不同类型的湿地土壤甲烷产生对温度变化响应的差异性是包括温度、盐度、pH值、有机碳质量与含量及微生物群落在内的各关键环境因子综合影响的结果.

表4 本研究与其他湿地甲烷产生潜力Q10值的比较Table 4 Comparison of this study with other studies
甲烷产生潜力温度敏感性是衡量湿地土壤甲烷产生对温度变化响应的一个重要参数.温度同时也是控制湿地土壤甲烷产生潜力敏感性的重要环境因素[15].van Hulzen等[16]研究发现,温度变化幅度为4~13.5℃时,土壤甲烷产生Q10值为1.1;而温度为13.5~30℃时,其Q10值为1.5. Inglett等[14]对美国佛罗里达洲圣约翰河边淡水沼泽的研究也发现,5个沼泽植被带在高温范围变化(20~30℃) 时的土壤甲烷产生Q10值(3.6~5.4)大于低温范围变化(10~20℃)时的Q10值(1.2~2.4).湿地土壤甲烷产生Q10值随温度上升而增大,其原因:一是较高的温度可更有效地激发土壤微生物活性,加快土壤有机质分解,促进甲烷产生的乙酸发酵途径[14,16,38];二是温度升高会提高电子受体的还原速率,结果是低浓度的电子受体将对甲烷产生形成一个正反馈作用,迅速提高甲烷产生量及其对温度的敏感性[17].但本研究中3种沼泽植被带土壤甲烷产生潜力Q10值均呈现出随温度上升而减小的特征(表2).Frenzel等[18]对芬兰沼泽的研究也发现类似结果,当温度为4℃时,湿地土壤甲烷产生对温度升高的响应较为敏感;而当温度大于20℃时,甲烷产生潜力对温度升高的响应却降低.分析原因可能与植物群落土壤产甲烷菌群落结构有关.不同产甲烷菌的最适温度并非完全一致,有些产甲烷菌在较低的温度区间内对温度的变化反应敏感;而在较高的温度区间即使温度升高,其活性的变化也不明显.
双因子方差分析结果表明,在温度变化范围为10~20℃时,植被类型及土壤深度对湿地甲烷产生潜力Q10值均具有显著的影响,且两者的交互作用对Q10值也有显著的影响;然而,当温度变化范围为20~30℃时,土壤深度对湿地甲烷产生潜力Q10值的影响不显著 (表5).已有研究表明,不同湿地植被带及土壤不同深度的产甲烷菌群落结构和数量的差异,是引起植被类型及土壤深度对甲烷产生潜力Q10值具有显著影响的主要原因之一[14,16,20].本研究中,在10~20℃和20~30℃培养条件下,互花米草沼泽植被土壤甲烷产生潜力Q10值均要高于其他2个沼泽植被带,分析其原因,可能与3个植被带间产甲烷菌群落机构和组成的变化存在着密切关系.此外,3个沼泽植被带土壤pH,电导率和DOC含量的不同(表1)也可能是造成甲烷产生潜力Q10值不同的原因之一.在今后的研究中应重点开展不同湿地植物群落及不同深度土壤的甲烷产生菌群落结构和数量的测定.

表5 植被类型和土壤深度对甲烷产生潜力Q10值的影响及交互作用的影响Table 5 Effects of vegetation type and soil depth on Q10values of methane production potential
4 结论
4.1 指数模型较好地拟合了3种沼泽植被带土壤甲烷产生潜力与温度间的关系,其甲烷产生潜力均呈现随温度增加而提高的特征.
4.2 通过温度敏感性系数Q10值分析,与高温范围相比,各植被带土壤甲烷产生潜力均在低温范围内对增温响应较为敏感.
4.3 在相同增温条件下,不同沼泽植被带湿地甲烷产生潜力Q10值因土壤底物可用性、土壤理化性质不同而呈现差异.
4.4 温度和植被类型对河口沼泽湿地甲烷产生潜力及温度敏感性均有显著影响.
[1]Intergovernmental Panel on Climate Change. Climate change 2007: The physical science basis [R]. New York, Cambridge University Press, 2007.
[2]沈李东,胡宝兰,郑 平.甲烷厌氧氧化微生物的研究进展 [J].土壤学报, 2011,48(3):619-628.
[3]Hirota M, Tang Y, Hu Q W, et al. Methane emissions from different vegetation zones in a Qinghai-Tibetan Plateau wetland[J]. Soil Biology and Biochemistry, 2004,36(5):737-748.
[4]Song C C, Xu X F, Tian H Q, et al. Ecosystem-atmosphere exchange of CH4and N2O and ecosystem respiration in wetlands in the Sanjiang Plain, Northeastern China [J]. Global Change Biology, 2009,15(3):692-705.
[5]Sha C Y, Mitsch W J, Mander Ü, et al. Methane emissions from freshwater riverine wetlands [J]. Ecological Engineering, 2011,37:16-24.
[6]Kao-Kniffin J, Freyre D S, Balser T C. Methane dynamics across wetland plant species [J]. Aquatic Botany, 2010,93:107-113.
[7]Chen Y H, Prin R G. Estimation of atmospheric methane emissions between 1996and 2001using a three-dimensional global chemical transport model [J]. Journal of Geophysical Research, 2006,111(D10307).
[8]Mikaloff Fletcher S E, Gruber N, Jacobson A R, et al. Inverse estimates of anthropogenic CO2uptake, transport, and storage by the ocean [J]. Global Biogeochemistry Cycles, 2006,20(2):GB2002.
[9]蒋 娜,陈紫娟,曹 轶,等.低温湿地甲烷古菌及其介导的甲烷产生途径 [J]. 微生物学通报, 2013,40(1):137-145.
[10]Allen D E, Dalal R C, Rennenberg H, et al. Spatial and temporal variation of nitrous oxide and methane flux between subtropical mangrove sediments and the atmosphere [J]. Soil Biology and Biochemistry, 2007,39(2):622-631.
[11]仝 川,王维奇,雷 波,等.闽江河口潮汐湿地甲烷排放通量温度敏感性特征 [J]. 湿地科学, 2010,8(3):240-248.
[12]姜欢欢,孙志高,王玲玲,等.黄河口潮滩湿地土壤甲烷产生潜力及其对有机物和氮输入响应的初步研究 [J]. 湿地科学,2012,10(4):451-458.
[13]Avery G B, Shannon R D, White J R, et al. Controls on methane production in a tidal freshwater estuary and a peatland: methane production via acetate fermentation and CO2reduction [J]. Biogeochemistry, 2003,62(1):19-37.
[14]Inglett K S, Inglett P W, Reddy K R, et al. Temperature sensitivity of greenhouse gas production in wetland soils of different vegetation [J]. Biogeochemistry, 2012,108:77-90.
[15]Valentine D W, Holland E A, Schimel D S. Ecosystem and physiological controls over methane production in northern wetlands [J]. Journal of Geophysical Research-Atmospheres,1994,99(D1):1563-1571.
[16]van Hulzen J, Segers R, Van Bodegom P, et al. Temperature effects on soil methane production: an explanation for observedvariability [J]. Soil Biology and Biochemistry, 1999,31(14):1919-1929.
[17]Updegraff K, Pastor J, Bridgham S D, et al. Environmental and substrate controls over carbon and nitrogen mineralization in northern wetlands [J]. Ecological Applications, 1995,5(1):151-163.
[18]Frenzel P, Karofeld E. CH4emission from a hollow-ridge complex in a raised bog: The role of CH4production and oxidation[J]. Biogeochemistry, 2000,51(1):91-112.
[19]Segers R. Methane production and methane consumption: a review of processes underlying wetland methane fluxes [J]. Biogeochemistry, 1998,41:23-51.
[20]Knoblauch C, Zimmermann U, Blumenberg M, et al. Methane turnover and temperature response of methane-oxidizing bacteria in permafrost-affected soils of northeast Siberia [J]. Soil Biology and Biochemistry, 2008,40(12):3004-3013.
[21]Matthews E, Fung I. Methane emission from natural wetlands:global distribution, area and environmental characteristics of sources [J]. Global Biogeochemical Cycles, 1987,1(1):61-86.
[22]郑彩虹,曾从盛,陈志强,等.闽江河口区湿地景观格局演变研究[J]. 湿地科学, 2006,4(1):29-34.
[23]金玉凤.闽江河口不同沼泽植被带土壤甲烷产生速率的比较及机制分析 [D]. 福州:福建师范大学, 2012.
[24]Wassmann R, Neue H U, Bueno C, et al. Methane production capacities of different rice soil derived from inherent and exogenous substrates [J]. Plant and Soil, 1998,203:227-237.
[25]Grace J, Rayment M. Respiration in the balance [J]. Nature,2000,404(6780):819-820.
[26]Luo Y, Wan S, Hui D, et al. Acclimatization of soil respiration to warming in a tall grass prairie [J]. Nature, 2001,413(6856):622-625.
[27]陈全胜,李凌浩,韩兴国,等.典型温带草原群落土壤呼吸温度敏感性与土壤水分的关系 [J]. 生态学报, 2004,24(04):831-836.
[28]McKenzie C, Schiff S, Aravena R, et al. Effect of temperature on production of CH4and CO2from Peat in a Natural and Flooded Boreal Forest Wetland [J]. Climatic Change, 1998,40(2):247-266.
[29]Bergman I, Klarqvist M, Nilsson M. Seasonal variation in rates of methane production from peat of various botanical origins: effects of temperature and substrate quality [J]. FEMS Microbiology Ecology, 2000,33(3):181-189.
[30]Sutton-Grier A E, Megonigal J P. Plant species traits regulate methane production in freshwater wetland soils [J]. Soil Biology and Biochemistry, 2011,43:413-420.
[31]丁维新,蔡祖聪.土壤有机质和外源有机物对甲烷产生的影响[J]. 生态学报, 2002,2(10):1672-1679.
[32]Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate [J]. Tellus. Series B: Chemical and Physical Meteorology, 1992,44(2):81-99.
[33]王 丹,吕瑜良,徐 丽,等.植被类型变化对长白山森林土壤碳矿化及其温度敏感性的影响 [J]. 生态学报, 2013,33(19):6373-6381.
[34]Dasselaar A, Oenemaa O. Methane production and carbon mineralization of size and density fractions of peat soils [J]. Soil Biology and Biochemistry, 1999,3:877-886.
[35]Cao M, Gregson K, Marshall S. Global methane emission from wetlands and its sensitivity to climate change [J]. Atmospheric Environment, 1998,32(19):3293-3299.
[36]Chin K J, Lukow T, Conrad R. Effect of temperature on structure and function of the methanogenic archaeal community in an anoxic rice field soil [J]. Applied and Environmental Microbiology, 1999,65(6):2341-2349.
[37]Bergman I, Svenson B H, Nilsson M. Regulation of methane production in a Swedish acid mire by pH, temperature and substrate [J]. Soil Biology and Biochemistry, 1998,30:729-741.
[38]Großkopf R, Janssen P H, Liesack W. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval [J]. Applied and Environmental Microbiology, 1998,64(3):960-969.
致谢:野外采样和室内工作得到福建师范大学亚热带湿地研究中心的徐辉、万斯昂、任洪昌、汪旭明和章文龙等同学的帮助,在此表示感谢.
Temperature sensitivity of soil methane production potential in different marsh vegetation zones in the Min River estuary.
Yang Ping1,2, He Qing-hua1,2, Tong Chuan1,3,4*(1.Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fuzhou 350007, China;2.School of Geographical Sciences, Fujian Normal University, Fuzhou 350007,China;3.Institute of Geography, Fujian Normal University, Fuzhou 350007, China;4.Research Centre of Wetlands in Subtropical Region, Fujian Normal University, Fuzhou 350007, China). China Environmental Science, 2015,35(3):879~888
Quantifying response of soil methane production potential to temperature change in different wetland vegetation are vital to accurately evaluate effect of climate change on wetland ecosystem carbon balance. Soil samples at a depth of 0~30cm (5cm interval) from three typical tidal marsh ecosystems dominated by Cyperus malaccensis,Phragmites australis and Spartina alterniflora, respectively, in the Min River estuary were collected in February 2012,and soil methane production potentials were determined using anaerobic incubation method. The results showed that there is an exponential correlation between methane production potential and soil temperature. The averaged Q10value of three marsh vegetation zones were 5.04, 14.92, 14.81, and 3.56, 4.99, 3.43, respectively, with temperature rasing from 10 to 20℃ and from 20 to 30℃. Vegetation type, incubation temperature and soil depth had significant effects on the methane production potential and Q10value (P<0.05).
methane production potential;temperature sensitivity;Q10;vegetation types;tidal wetlands;Min River Estuary
X171.1
A
1000-6923(2015)03-0879-10
杨 平(1986-),男,安徽宣城人,博士研究生,主要从事湿地生物地球化学循环、湿地生态系统服务功能及生态修复研究.发表论文8篇.
2014-07-26
国家自然科学基金资助项目(41371127);福建师范大学校级创新团队项目(IRTL1205)
* 责任作者, 教授, tongch@fjnu.edu.cn
