下调G3BP对抑制肿瘤细胞迁移能力的研究
2015-11-24张浩张彩霞喻冬柯邵荣光何红伟
张浩,张彩霞,喻冬柯,邵荣光,何红伟
·论著·
下调G3BP对抑制肿瘤细胞迁移能力的研究
张浩,张彩霞,喻冬柯,邵荣光,何红伟
目的探讨利用siRNA和靶向G3BP的多肽药物下调G3BP后对多种肿瘤细胞迁移能力的影响。
方法采用人纤维肉瘤HT1080细胞、乳腺癌MCF-7细胞以及人非小细胞肺癌H1299细胞,应用siRNA特异性干扰G3BP后,通过划痕实验观察其对肿瘤细胞迁移能力的影响;用多肽药物GAP161作用于肿瘤细胞后,利用划痕实验以及Transwell迁移实验观察其对肿瘤细胞迁移能力的影响;在MCF-7细胞中高表达G3BP1,在MDA-MB-231细胞中用siRNA下调G3BP1后,采用人全基因芯片分析G3BP1高表达和低表达后的基因表达谱,并进行信号通路分析。
结果siRNA特异性下敲G3BP1和G3BP2后,HT1080、MCF-7和H1299细胞的迁移能力显著降低。利用靶向G3BP的特异性多肽药物GAP161作用于多种肿瘤细胞后,肿瘤细胞的迁移能力显著下调。全基因组芯片分析表明:多个基因同时在G3BP1高表达和低表达组中发生变化,该变化与细胞迁移相关的细胞黏附、整合素、MAPK等信号通路有关。
结论G3BP下调后能够显著降低肿瘤细胞的迁移能力。靶向G3BP的多肽药物具有显著抑制肿瘤细胞迁移的作用。下调或者高表达G3BP后可通过下调或者上调多种与细胞黏附、整合素、MAPK等信号通路相关基因发挥作用。
细胞系,肿瘤;细胞迁移抑制;基因表达谱;MAP激酶信号系统;G3BP
肿瘤转移是恶性肿瘤的重要生物学特征,大多数癌症患者并非死于原发性癌而是死于转移性癌。恶性肿瘤的发生与转移是多因素、多基因相互协调作用的多阶段过程,因此控制癌症细胞的运动在肿瘤治疗中非常重要。G3BP1是通过免疫共沉淀分离得到的第一个RasGAP SH3结构域结合蛋白,之后发现G3BP2也可与RasGAP相互作用,从而认为G3BP在Ras信号传导途径中起作用[1-3]。研究发现,G3BP在多种肿瘤中过表达,包括头颈部癌、肺癌、结直肠癌和乳腺癌[4-5]。G3BP还参与肿瘤侵袭转移相关基因的表达,Taniuchi等[6-7]发现G3BP能够结合并且降解BART的mRNA,从而下调它的表达量。BART能够抑制肿瘤细胞的转移和侵袭。前期研究我们发现,下调G3BP能够抑制HCT116细胞增殖并且引起细胞凋亡,还能够抑制肺癌细胞的增殖和侵袭转移能力[8-9]。本研究中我们采用特异性siRNA和靶向G3BP的多肽药物GAP161作为工具,探讨了G3BP对多种肿瘤细胞迁移能力的影响,进一步采用基因芯片的方法对瞬时下敲和高表达G3BP1的乳腺癌细胞进行全基因组表达谱分析,分析其对迁移相关基因以及信号传导通路的影响,为G3BP作为一个肿瘤转移标志物的研究提供基础。
1 材料与方法
1.1 材料
1.1.1 细胞与细胞培养人纤维肉瘤HT1080细胞用含10%胎牛血清和双抗(青霉素及链霉素各100 kU/L)RPMI 1640液培养于37℃、5%CO2培养箱中。人乳腺癌MCF-7和人非小细胞肺癌H1299细胞用含10%胎牛血清和双抗(青霉素及链霉素各100 kU/L)DMEM液培养于37℃、5% CO2培养箱中。人乳腺癌MDA-MB-231细胞用含10%胎牛血清和双抗(青霉素及链霉素各100 kU/L)L15液培养于37℃、5%CO2培养箱中。
1.1.2 实验仪器5415型台式离心机为德国Eppendorf公司产品;芯片杂交盒、芯片清洗盒、芯片杂交仪和LuxScan 10K/A双通道激光扫描仪购自北京博奥生物有限公司;Transwell小室为美国Corning公司产品。
1.1.3 主要试剂DMEM、RPMI 1640、L15培养基购自美国Hyclone公司;新生胎牛血清购自美国Gibco公司;多肽药物GAP161由武汉凯泰新生物技术有限公司合成提供,用生理盐水配制成10 mmol/L贮存液,-80℃保存;质粒pcDNA3.1由本室保存;脂质体Lipofectamine2000和Lipofectamine RNAiMAX均购自美国Invitrogen公司;人类全基因组寡聚核苷酸芯片购自台湾Phalanxiotech公司;芯片杂交试剂盒购自美国Genisphere公司。
1.2 方法
1.2.1 siRNA设计和合成由广州锐博公司设计合成G3BP1和G3BP2的siRNA。靶向G3BP1的siRNA序列为5'GCAACAGUAUUUCGGUA UAdT dT-3',靶向G3BP2的siRNA序列为5'GU AAGAAAGUAGCCAUAAAdT dT-3'。对照mock siRNA序列是5'UUCUCCGAACGUGUCACGU dT dT-3'。将合成的siRNA粉末用缓冲溶液溶解,配成20 μmol/L的储备溶液。
1.2.2 细胞转染将对数生长期细胞用2 ml含10%胎牛血清的无抗生素组织培养液以30万个/孔接种到六孔板中。将100 nmol/L siRNA或者2 μg pcDNA-G3BP1用无抗生素无血清的Opti-MEM培养液250 μl稀释,取6 μl脂质体与250 μl无抗生素无血清的Opti-MEM培养液混匀,5 min之内将siRNA或pcDNA溶液与脂质体稀释液轻轻混匀。siRNA或pcDNA与脂质体复合物于室温静置20 min后,把500 μl siRNA(pcDNA)-脂质体复合物加到细胞培养板中。细胞在给药前用无抗生素无血清的Opti-MEM培养液洗1遍后,再加入新的500 μl无抗生素无血清Opti-MEM培养液。这样,转染后每孔溶液终体积为1000 μl。转染5 h后,每孔中补加1000 μl含20%胎牛血清的无抗生素培养液。
1.2.3 划痕愈合实验将对数生长期的细胞消化、计数,每孔以3×105个/ml的细胞数接种于6孔板中,分别进行以下两种方式处理:①当细胞生长24 h后,覆盖度接近100%时,用10 μl Tip头在单层细胞上划痕,PBS冲洗后,在含有特定浓度多肽药物的无血清培养基中继续培养;②当细胞生长24 h后,进行siRNA转染,继续培养24 h,当覆盖度接近100%时,用10 μl Tip头在单层细胞上划痕,PBS冲洗,在无血清培养基中继续培养。每隔一段时间,于倒置显微镜下观察伤痕合拢的情况,并照相。实验重复3次。如下公式计算细胞迁移率:
迁移率(%)=(原划痕宽度-现划痕宽度)/原划痕宽度×100%
1.2.4 Transwell迁移实验在Transwell(8.0 μm)的上室中加入无血清培养基,于37℃培养箱中平衡过夜。取对数生长期的细胞,消化计数。用含无血清培养基洗涤细胞3次。用含无血清及不同浓度多肽药物(或不同细胞)的培养基重悬细胞,使细胞密度为2×105个/ml,在Transwell的上室中加入100 μl细胞重悬液,2×104个/孔,下室加入600 μl的培养液(含20%血清),置培养箱中培养24~48 h。取出Transwell小室,弃培养液,用PBS轻柔洗涤3遍,甲醇固定10 min,PBS洗3遍。下室侧表面的细胞为迁移穿透膜的细胞,苏木素染色。显微镜下观察,每张膜计数3~5个100倍视野,计算迁移细胞数。实验重复3次,取平均值。
1.2.5 基因芯片杂交分析收集siRNA干扰48 h的MDA-MB-231细胞,以及转染pcDNA-G3BP1 48 h的MCF-7细胞,用Trizol提取总RNA,纯化后,将RNA逆转录并标记荧光基团,与人全基因组芯片进行杂交,基因芯片扫描仪进行扫描并分析得到全基因的表达数据。取表达差异大于1.5倍的基因进行代谢通路和信号传导通路分析。
1.3 统计学处理
每次实验至少重复3次,结果用平均值表示,两组均数比较采用两样本Student's t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 下敲G3BP抑制肿瘤细胞迁移能力
之前我们的研究结果显示,下敲G3BP后能够抑制非小细胞肺癌H1299细胞的侵袭迁移能力[9]。此次,我们采用siRNA特异性下敲G3BP1和G3BP2 24 h后,通过划痕实验观察其对HT1080、MCF-7和H1299细胞等肿瘤细胞迁移能力的影响(图1)。结果显示,用G3BP1-siRNA和G3BP2-siRNA处理后,HT1080细胞的迁移率降为32.39%和49.17%;MCF7细胞的迁移率降为12.08%和11.94%;H1299细胞的迁移率降为16.11%和34.29%。结果表明,下敲G3BP能够显著抑制肿瘤细胞的划痕愈合能力,从而抑制肿瘤细胞的迁移能力。

图1 下敲G3BP对肿瘤细胞HT1080(A)、MCF-7(B)和H1299(C)迁移能力的抑制作用(与对照组相比,*P<0.05)Figure 1Knockdown of G3BP inhibited the migration of tumor cell HT1080(A),MCF-7(B)and H1299(C)(*P<0.05 vs control)
2.2 靶向G3BP的多肽药物GAP161抑制肿瘤细胞迁移
前期研究结果表明,多肽药物GAP161靶向G3BP,处理细胞后能够降低G3BP蛋白[8]。为了验证siRNA的结果,我们用GAP161处理肿瘤细胞,观察其对细胞迁移能力的影响。采用10、30 μmol/L GAP161处理细胞,细胞划痕实验结果表明GAP161能够显著抑制HT1080(31.82%和13%)(图2)、MCF-7(33.75%和16.92%)(图3)及H1299(15.83%和8.19%)(图4)的迁移能力。进一步,采用Transwell实验检测GAP161对肿瘤细胞迁移能力的影响。结果显示,GAP161处理后,能够显著抑制HT1080、MCF-7和H1299的迁移能力(图2~4)。
2.3 瞬时高表达G3BP1后细胞转移相关基因表达谱变化
为了进一步探讨G3BP1发挥其生物学功能的分子机制,我们采用基因芯片的方法分析G3BP1表达的变化对细胞基因水平的影响。选择侵袭转移能力较低的MCF-7细胞检测G3BP1对细胞内迁移相关基因的影响。结果显示,G3BP1高表达后能够诱导与细胞增殖、运动以及代谢有关的许多其他基因表达的变化。与对照组相比,G3BP1高表达后共1565个基因表达发生了改变(>1.5倍),其中有673个基因表达上调,892个基因表达下调。以Kyoto百科全书基因以及基因组(Kyoto encyclopedia of genes and geneomes,KEGG)对表达差异大于1.5倍的基因所参与的信号通路进行分析[10]。结果显示,在这些上调的基因中,G3BP1高表达诱导了包括MAPK、黏附连接以及细胞骨架调节等细胞迁移相关基因的表达(表1)。
2.4 瞬时下敲G3BP1后细胞转移相关基因表达谱变化

图2 GAP161对HT1080细胞迁移能力的抑制作用(与对照组相比,*P<0.05)(A:划痕实验;B:Transwell实验)Figure 2GAP161 inhibited HT1080 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
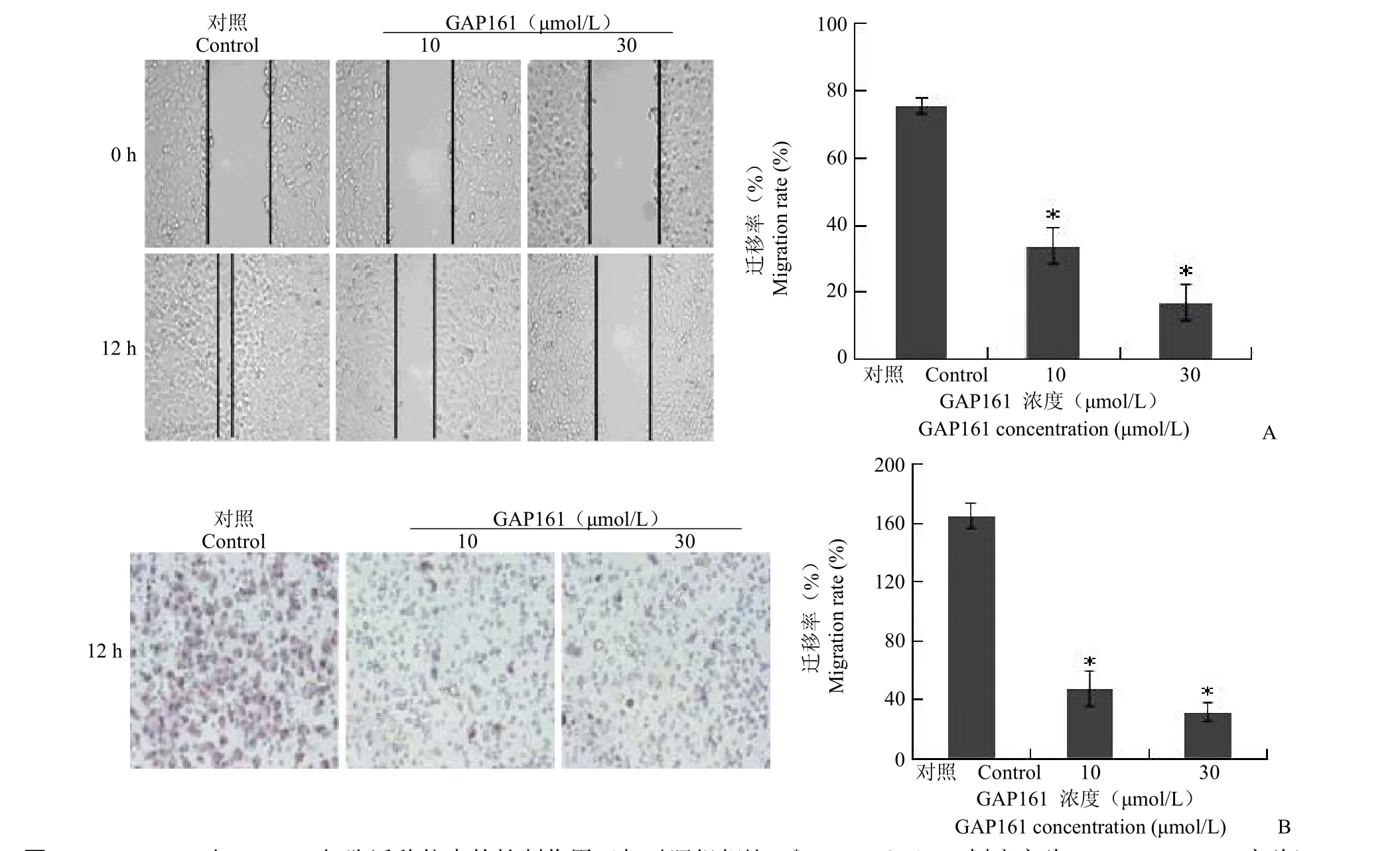
图3 GAP161对MCF-7细胞迁移能力的抑制作用(与对照组相比,*P<0.05)(A:划痕实验;B:Transwell实验)Figure 3GAP161 inhibited MCF-7 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
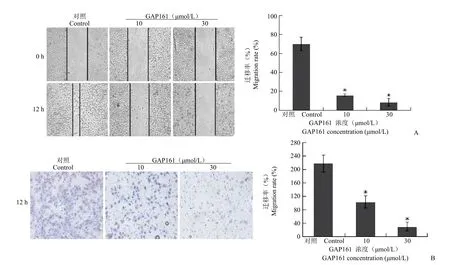
图4 GAP161对H1299细胞迁移能力的抑制作用(与对照组相比,*P<0.05)(A:划痕实验;B:Transwell实验)Figure 4GAP161 inhibited H1299 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
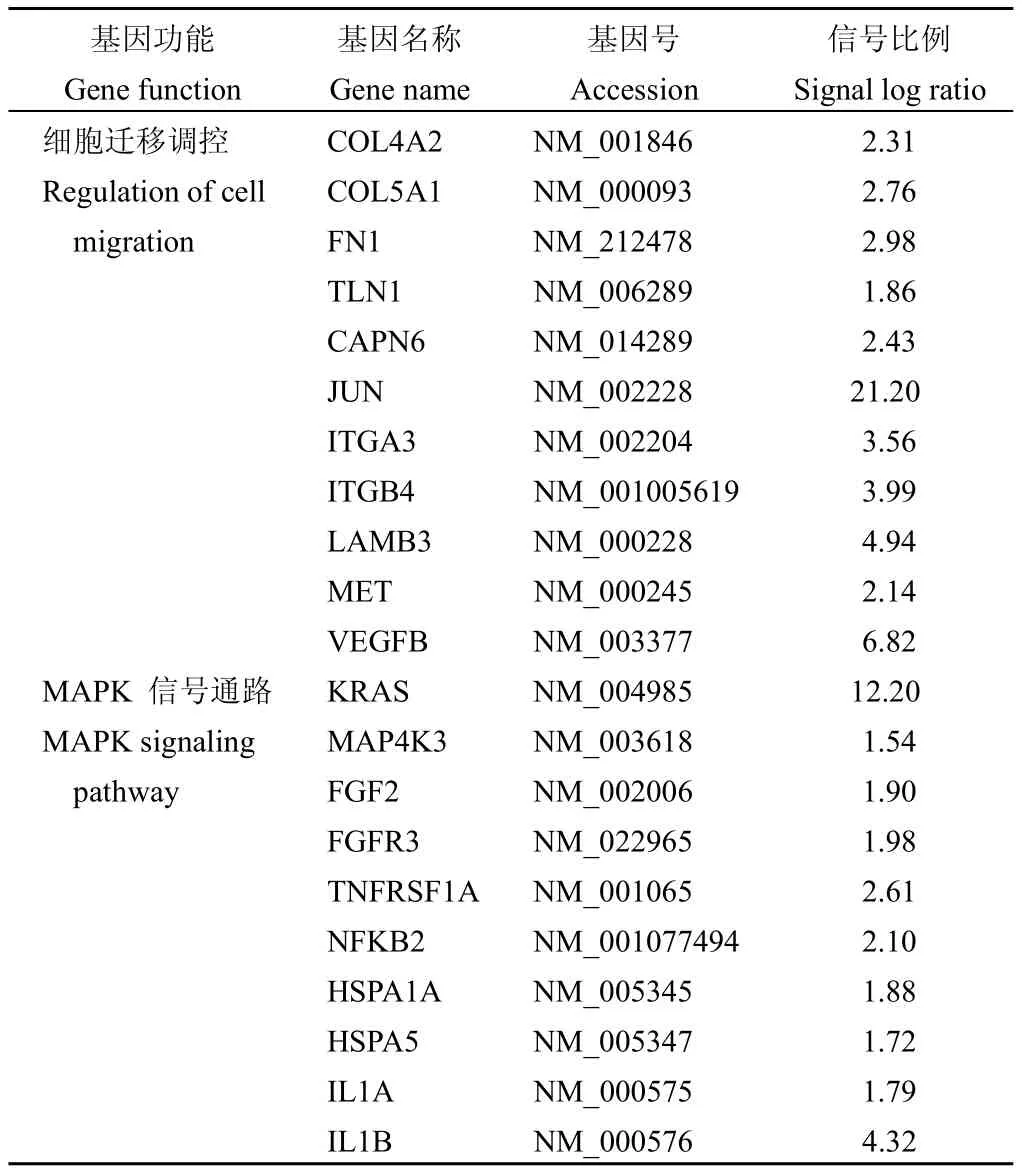
表1 MCF-7细胞中高表达G3BP1后上调的细胞迁移相关基因和信号通路Table 1Overexpression of G3BP1 upregulates migration associated genes and signaling pathways in MCF-7 cells
选择侵袭转移能力较高的MDA-MB-231细胞检测G3BP1-siRNA对细胞基因表达的影响。通过G3BP1-siRNA处理组细胞与mock-siRNA处理组细胞之间基因表达差异的比较,显示G3BP1-siRNA能够降低细胞增殖、运动以及代谢有关的许多基因的表达。与mock-siRNA处理组相比,G3BP1-siRNA处理组细胞共940个基因表达发生了改变(>1.5倍),其中有195个基因表达上调,745个基因表达发生下调。KEGG信号通路分析表明,与高表达G3BP1对MCF-7细胞相关基因表达的影响相反,G3BP1-siRNA抑制了包括MAPK、黏附连接以及细胞骨架调节等细胞迁移相关基因的表达(表2)。
3 讨论
癌症细胞在侵袭以及恶化过程中,能够通过自身的运动在组织中迁移。日前有研究人员发现,早期阶段未侵入周边组织的乳腺癌细胞已经含有高运动性的细胞,为肿瘤进行转移扩散做好准备[11]。肿瘤细胞的运动包括许多过程,为许多信号分子所调控,如FAK调节的细胞与基质之间的黏附,MLCK以及Rho相关卷曲螺旋形成蛋白激酶(Rho/ROCK)等调控的肌球蛋白收缩等[12-13]。
我们前期研究证实,下调G3BP能够抑制肺癌细胞的转移侵袭能力[9]。为了探讨G3BPs在其他多种肿瘤细胞迁移侵袭中的作用,采用siRNA特异性瞬时沉默肿瘤细胞中的G3BPs来观察肿瘤细胞运动能力的变化。结果发现,下调G3BP后,多种肿瘤细胞包括HT1080、MCF-7和H1299的运动迁移能力都受到了抑制。GAP161是靶向G3BP的特异性多肽药物,它能够降低G3BP的表达。用GAP161处理肿瘤细胞后,HT1080、MCF-7和H1299细胞迁移能力显著降低。
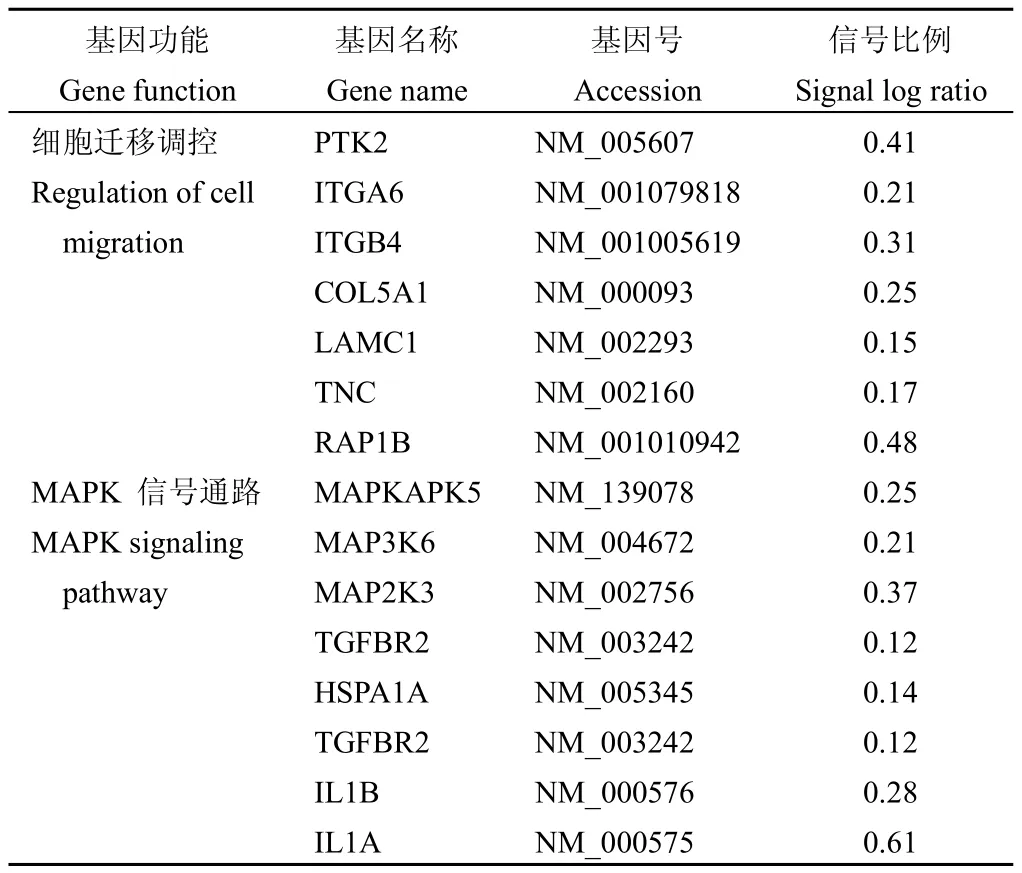
表2 MDA-MB-231中下敲G3BP1后抑制的细胞迁移相关基因和信号通路Table 2Knockdown of G3BP1 inhibits migration associated genes and signaling pathways in MDA-MB-231 cells
已有研究发现,G3BP参与了肿瘤侵袭转移相关基因的表达[6-7]及细胞骨架的动态变化,而细胞骨架重构在肿瘤的侵袭转移过程中有重要作用[14-15]。但缺乏G3BP如何参与肿瘤细胞的迁移侵袭的分子机制研究,也未见对全基因组水平的影响展开研究。我们在侵袭能力较低的乳腺癌MCF-7细胞中高表达G3BP1,并且在恶性程度较高、侵袭能力较强的MDA-MB-231细胞中下敲G3BP1,收集mRNA后分别进行基因芯片分析。结果表明,上调G3BP1后能够引起肿瘤细胞MAPK、Wnt、TGF-β、细胞周期、细胞黏附连接以及细胞骨架调节等相关信号通路发生变化。其中,与转移能力相关的细胞黏附、整合素和MAPK等信号通路和基因都发生上调。而对G3BP1下敲的MDA-MB-231细胞进行了全基因组分析后,结果显示,下敲G3BP1后显著下调了转移相关的信号通路和基因,其影响的信号通路和基因与上调G3BP1后影响的信号通路相似。
综上所述,沉默G3BP可降低肿瘤细胞迁移能力。因此,G3BP可以作为一个潜在的抗肿瘤转移治疗靶点和分子标志物。通过全基因组芯片分析,表明下敲G3BP可以影响肿瘤转移侵袭相关信号通路和基因表达,并且为深入研究G3BP参与肿瘤侵袭转移的分子机制提供基础。
[1]Irvine K,Stirling R,Hume D,et al.Rasputin,more promiscuous than ever:a review of G3BP.Int J Dev Biol,2004,48(10):1065-1077.
[2]Parker F,Maurier F,Delumeau I,et al.A Ras-GTPase-activating protein SH3-domain-binding protein.Mol Cell Biol,1996,16(6):2561-2569.
[3]Zhang H,Shao RG.G3BP:a promising target for cancer therapy.Acta Pharm Sinica,2010,45(8):945-951.(in Chinese)张浩,邵荣光.G3BP:一个潜在的肿瘤治疗靶点.药学学报,2010,45(8):945-951.
[4]French J,Stirling R,Walsh M,et al.The expression of Ras-GTPase activating protein SH3 domain-binding proteins,G3BPs,in human breast cancers.Histochem J,2002,34(5):223-231.
[5]Guitard E,Parker F,Millon R,et al.G3BP is overexpressed in human tumors and promotes S phase entry.Cancer Lett,2001,162(2):213-221.
[6]Taniuchi K,Nishimori I,Hollingsworth MA.Intracellular CD24 inhibits cell invasion by posttranscriptional regulation of BART through interaction with G3BP.Cancer Res,2011,71(3):895-905.
[7]Taniuchi K,Nishimori I,Hollingsworth MA.The N-terminal domain of G3BP enhances cell motility and invasion by posttranscriptional regulation of BART.Mol Cancer Res,2011,9(7):856-866.
[8]Zhang H,Zhang S,He H,et al.GAP161 targets and downregulates G3BP to suppress cell growth and potentiate cisplaitin-mediated cytotoxicity to colon carcinoma HCT116 cells.Cancer Sci,2012,103(10):1848-1856.
[9]Zhang H,Zhang SH,He HW,et al.Downregulation of G3BPs inhibits the growth,migration and invasion of human lung carcinoma H1299 cells by suppressing the Src/FAK-associated signaling pathway. Cancer Gene Ther,2013,20(11):622-629.
[10]Ogata H,Goto S,Sato K,et al.KEGG:kyoto encyclopedia of genes and genomes.NucleicAcids Res,1999,27(1):29-34.
[11]Pearson GW,Hunter T.Real-time imaging reveals that noninvasive mammary epithelial acini can contain motile cells.J Cell Biol,2007,179(7):1555-1567.
[12]Sonoda Y,Matsumoto Y,Funakoshi M,et al.Anti-apoptotic role of focal adhesion kinase(FAK).Induction of inhibitor-of-apoptosis proteins and apoptosis suppression by the overexpression of FAK in a human leukemic cell line,HL-60.J Biol Chem,2000,275(21):16309-16315.
[13]Zhao JH,Reiske H,Guan JL.Regulation of the cell cycle by focal adhesion kinase.J Cell Biol,1998,143(7):1997-2008.
[14]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation. Cell,2011,144:646-674.
[15]Schmitz AA,Govek EE,Böttner B,et al.Rho GTPases:signaling,migration,and invasion.Exp Cell Res,2000,261(1):1-12.
MethodsEffect of G3BP knockdown on tumor cell migration was examined by wound healing assay in HT1080,MCF-7 and H1299 cells.Effect of GAP161 on the migration of tumor cells was measured by wound healing assay and Transwell assay.Human whole genome oligonucleotide microarray was used to analyze the gene expression profiles in MCF-7 cells with G3BP1 over-expression and MDA-MB-231 cells with G3BP1 knockdown.Pathway analysis was then performed according to the microarray data.
ResultsDown-regulation of G3BP1 and G3BP2 by specific siRNAs significantly inhibited cell migration in HT1080,MCF-7 and H1299 cells.GAP161 also significantly reduced the tumor cell migration ability.Whole genome microarray analysis showed that over-expression of G3BP1 and knockdown G3BP1 in MCF-7 and MDA-MB-231 cells,respectively,affected cell adhesion,integrin and MAPK signaling pathways in an opposite manner.
ConclusionKnockdown of G3BP by siRNA significantly inhibited tumor cell migration.G3BP-targeted peptide G3BP1 markedly reduced the cell migration abilities.Over expression of G3BP1 could up-regulate genes expression associated with cell adhesion,integrin and MAPK signaling pathways,while down-regulation of G3BP1 exerts opposite effects.
Down-regulation of G3BPinhibits tumor cell migaration
ZHANG Hao,ZHANG Cai-xia,YU Dong-ke,SHAO Rong-guang,HE Hong-wei
ObjectiveTo investigate the effect of G3BP down-regulation by siRNA or G3BP-targeted peptide GAP161 on tumor cell migration.
Cell line,tumor;Cell migration inhibition;Gene expression profiling;MAP kinase signaling system;G3BP
HE Hong-wei,Email:hehwei@163.com
10.3969/cmba.j.issn.1673-713X.2015.01.004
国家自然科学基金(81302802);国家重点基础研究发展计划(973计划)(2009CB521807);“重大新药创制”国家科技重大专项(2012ZX09301-002)
100050北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
何红伟,Email:hehwei@163.com
2014-06-03
www.cmbp.net.cn中国医药生物技术,2015,10(1):11-17
Author Affiliation:Department of Oncology,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences,Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(1):11-17
