RNAi表达载体在哺乳动物中的研究进展
2015-11-19侯莹成志云王立强许瑞安唐明青
侯莹,成志云,王立强,许瑞安,唐明青
(华侨大学 生物医学学院,福建 泉州362021)
RNA 干扰(RNAi)是一种由19~29个核苷酸(nt)非编码RNA(ncRNA)引起的靶基因特异性沉默效应,已发展成为基因调控的最有效技术之一.RNAi表达载体是一种能携带和表达目的小RNA“基因”的荷载介质,能够很好地弥补化学合成型RNAi的不足,实现RNAi分子的长效、安全、可控性表达,为个体化和靶向性基因治疗奠定了基础,已被广泛应用于基因调控、功能分析、疾病诊断和基因治疗等方面[1-3].鉴于此,本文以哺乳动物为基础,对已知RNAi表达载体的发生发展、构成、作用机制、递送系统及主流应用做一个较为全面的综述.
1 发展与分类
1.1 发生发展
2002年,Brummelkamp等[4]首次将小干扰RNA(siRNA)嵌入至短发夹式骨架中表达,发现其对目的siRNA 的表达长久而高效,成功构建了第一个RNAi表达载体(短发夹RNA 表达载体、shRNA载体),标志着第一代RNAi表达载体的诞生.但随着研究的深入,shRNA 载体存在的脱靶效应[5-6]、细胞毒性和干扰内源性miRNA 通路[7]等问题极大地限制了shRNA 载体的发展.于是,Zeng等[5]通过模拟内源性miRNA 的发生通路,成功构建了第二代RNAi表达载体(人工微小RNA 表达载体、amiRNA载体),并发现其与原始shRNA 载体相比,具有组织特异性强、毒性低、时间及沉默水平可控等优点.
随着基因治疗的快速发展,开发安全、可控、高效的RNAi表达载体日益重要.在shRNA 载体方面,可以通过载体表达框的优化(如发夹环的序列、结构和大小等)提高载体的安全性和沉默效率[8-9].近期发展起来的双功能shRNA 表达载体借助RNAi的旁路途径促进主体RNAi的进行,显著提高了基因沉默效率,弱化了脱靶效应,是目前shRNA 载体的一种新形式[10].在amiRNA 载体方面,提高载体表达效率及靶向性、扩充载体使用范围一直是研究的重点,如改造表达骨架的前体结构,在套索结构两侧增添互补碱基,或使侧翼序列错配等[11-12],显著提高了目的小RNA 在体内的表达效率及沉默效果.鉴于表达骨架的种属特异性及进化保守性,以鼠源[13]、鸡源[14]为表达骨架的研究也在不断开展,均实现了靶基因的有效沉默,为amiRNA 表达载体的广泛应用奠定了基础.
1.2 系统分类
目前,RNAi表达载体并没有公认的分类标准,学术界和产业界存在多种不同的叫法,如小干扰RNA(siRNA)载体[15]、短发夹RNA(shRNA)载体[4]、微小RNA(miRNA)载体[16]、人工微小RNA(amiRNA)载体[5]、shRNAmir载体[17]等.各种载体之间的区别与联系,各自载体的范围和特性的界定成为当前的一大问题,尤其是第一代和第二代载体之间的具体划分标准依然不明确,这将直接干扰今后载体的选择和优化.
2 构成与构建及其作用机制
2.1 构成与构建
RNAi表达载体一般由启动子、表达框及辅助元件构成.其中,表达框是整个载体的核心,包含目的小RNA 和表达骨架两部分,前者由正义链和反义链构成,后者由连接目的小RNA 的套索序列及侧翼序列构成.RNAi表达载体的代表性研究,如表1所示.
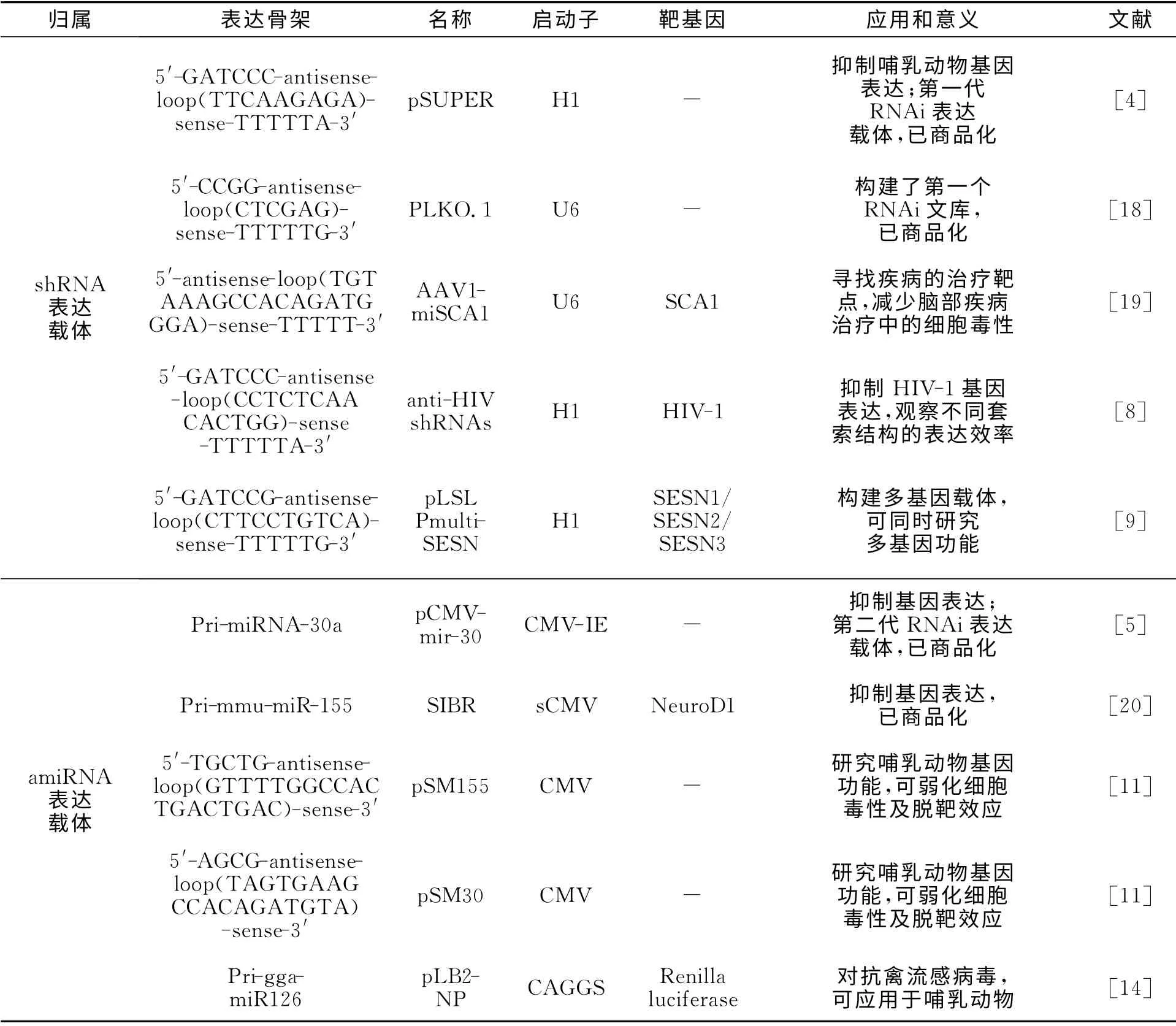
表1 RNAi表达载体的代表性研究Tab.1 Representative researches about RNAi expression vector
目前,RNAi表达载体的构建主要有“串联法”和“并联法”.前者主要针对siRNA 载体,由两个独立的启动子完成两条串联的目的小RNA 单链序列的分别表达,对表达骨架依赖性低(或完全不需要),但构建过程复杂且表达效果欠佳,目前应用相对较少,构建过程如图1(a)所示.后者主要针对shRNA 载体、amiRNA 载体及miRNA 载体,通常由单一启动子完成发夹式目的小RNA 序列的转录,构建过程简单,但对表达骨架依赖性强,需要合适的表达骨架方可实现目的小RNA 的理想表达,是目前主流的载体构建方法,构建过程如图1(a)所示[4,8].
2.2 作用机制
RNAi表达载体在体内发挥干扰作用主要通过内源性通路和外源性通路两条途径[21].前者主要为miRNA 和amiRNA 载体作用通路,通常由组织特异性Pol-II启动子诱导miRNA/amiRNA 的初级产物(Pri-miRNA/Pri-amiRNA)形成,在Drosha 酶的作用下形成miRNA/amiRNA 的前体结构(PremiRNA/Pre-amiRNA),由出核蛋白(Exportin-5)运输至细胞质,并在Dicer酶的加工下形成成熟的miRNA/amiRNA,在与RISC-AGO 复合体的共同作用下调控靶mRNA 的翻译(图1(b))[9].后者为shRNA 与siRNA 载体的作用通路,一般由Pol-Ⅲ启动子诱导转录,形成siRNA 的前体结构(shRNA),之后在胞质内由Dicer类似酶加工形成成熟的siRNA(而siRNA 载体转录后直接生成成熟的siRNA),随后在RISC-AGO 复合体的共同作用下发挥降解靶mRNA 的作用[21](图1(b)).

图1 RNAi表达载体的构成构建与作用机制Fig.1 Construction and mechanism of RNA interference expression vector
3 递送系统
3.1 非生物载体
纳米颗粒是目前研究较多的非生物递送载体,具有免疫原性低、可被生物体自动分解等特点[22].近期,有研究者采用纳米颗粒载体递送靶向VEGF-A 的shRNA 质粒载体,用于抗角膜血管生成,通过基质内注射的方法直接作用于病灶部位,成功抑制了血管生成基因的表达[23].另外,最近的一项研究显示,纳米颗粒递送有望实现抗肿瘤shRNA 质粒载体的口服递送[24],为口服基因治疗奠定了基础.
3.2 细菌载体
近年来,细菌载体被创新性地拉入了RNAi表达载体的递送系统行列[25].早期细菌介导的RNAi技术在线虫体内应用较多,随后有报道称治疗性细菌能够通过脉管系统进入肿瘤细胞[26].基于此,有研究者将重新构建的大肠杆菌用于哺乳动物细胞中shRNA 的递送,目前,以此递送系统为基础的一项治疗遗传性结肠癌的项目正处于临床检测阶段[27].除此之外,减毒鼠伤寒杆菌亦可用于递送shRNA 载体,通过靶向肿瘤细胞表面受体,减少了肿瘤的负荷,提高了受试动物的存活率[28].
3.3 病毒载体
病毒载体是RNAi表达载体中应用最为广泛的递送系统,主要包括腺病毒、逆转录病毒、慢病毒、腺相关病毒等.其中,腺病毒在基因治疗的临床试验中应用较广,但腺病毒自身可高度表达非编码RNA,干扰RNAi通路的正常进行[29].此外,腺病毒是一类游离型递送系统,只能进行瞬时爆发性表达.
与之相比,腺相关病毒载体介导的RNAi则较为稳定,无明显致病性,而且RNAi表达框普遍短小的特点正好弥补了此类递送系统包装容量小的缺陷.此外,逆转录病毒与慢病毒均可整合入宿主基因组进行长期表达,在稳定性RNAi效应中颇受偏爱[30],对全基因组筛选及基因文库的构建做出了巨大贡献,但其安全性有待进一步完善.
4 主流应用
4.1 RNAi文库
RNAi文库是人工构建且通过RNAi抑制众多不同基因表达的混合文库,可用于功能缺陷型生物或细胞库的构建及表型筛选.随着RNAi表达载体的发展,RNAi文库构建中存在的细胞类型限制以及基因沉默持久度的问题均得到了很好的解决,使RNAi文库在植物及哺乳动物基因组的研究中[18],尤其在肿瘤细胞多药耐药性[31]、特异性药物靶点选择[32]等方面得到了广泛地应用.
目前,基于RNAi表达载体的RNAi文库资源,如表2所示.近期,一项RNAi的“传感器实验”使强效的shRNA 分子的大量平行识别成为了可能,并为amiRNA 型RNAi文库的功能性确认提供了新的策略[33].
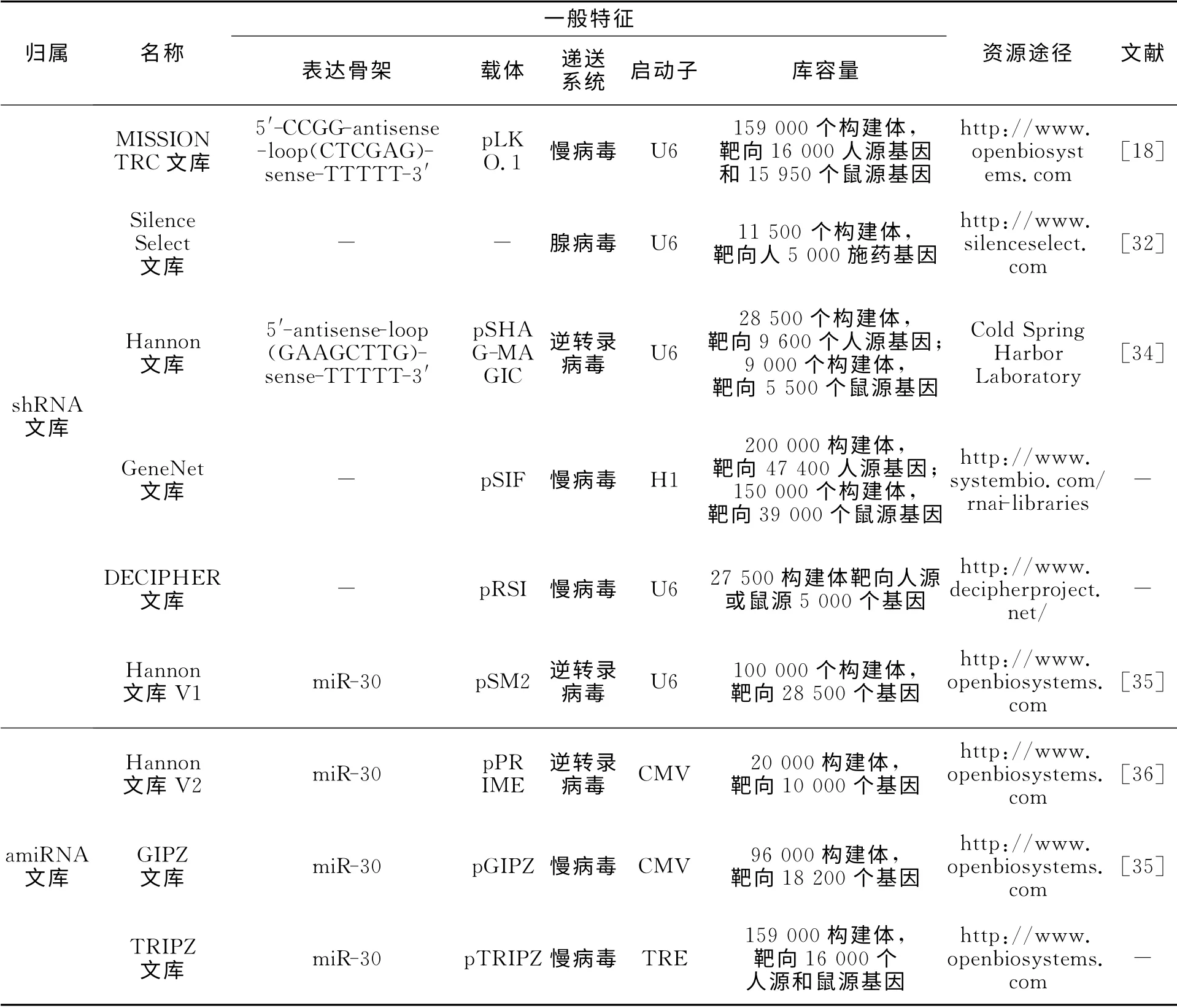
表2 基于RNAi表达载体的RNAi文库资源Tab.2 Available sources of RNAi library based on RNAi expression vectors
4.2 单基因调控
RNAi表达载体通过转录获得的功能性序列抑制单基因表达在基因功能研究方面发挥着重要作用,尤其为当前无明显药物治疗效果的疾病提供了一种治疗策略.例如,Zhou等[37]对宫颈癌的发病机理进行体外研究,采用shRNA 靶向沉默人类乳头瘤病毒原癌基因E6和E7,导致p53及pRB蛋白大量积累,MCM7和p16蛋白减少,癌细胞的增殖和扩散能力显著降低,揭示了E6和E7基因在宫颈癌的发生和发展过程中的重要作用,展现了shRNA 表达载体在基因功能研究中的巨大潜力.但良好的设计是效应分子发挥高效沉默的前提,在此基础上采用多个shRNA 载体分子靶向同一基因[38],可有效避免非靶向性沉默的发生,使RNAi表达载体的应用更加安全可靠.
4.3 转基因
转基因动物是RNAi表达载体的另一创新性应用.目前已成功构建的转基因动物主要有转基因大鼠、小鼠、猪、羊等,其中,前两者在基础研究中应用较广.早期,采用shRNA 表达载体构建基因敲除小鼠,存在严重的脱靶效应及细胞毒性[19],目前已逐渐被amiRNA 表达载体所替代,增加了模型的可诱导性及基因沉默的可逆转性,为不同品系转基因动物的构建奠定了基础[39].转基因动物成功构建的关键在于强效的RNAi效应分子及稳定的表达系统.近期,Dow 等[40]通过优化以miR-30 为表达骨架的amiRNA 表达载体和amiRNA 分子设计,同时结合重组酶介导的盒式策略(RMCE),进一步挖掘了有效转基因小鼠品系的发展潜力,为转基因动物的构建提供了一种快速、经济、高效的方法.
5 问题与展望
RNAi技术是继反义寡核苷酸技术和基因敲除技术之后的又一重要的基因调控手段,也是目前最为普遍和常用的基因调控策略[1-3].RNAi表达载体实现了干扰性小RNA 的长效、高效、安全和靶向性表达.但现有的RNAi表达载体还存在诸多问题:1)已被关注的shRNA 载体存在的细胞毒性和干扰内源性miRNA 通路问题[5,7],amiRNA 载体的种属反应性和表达效率问题[20]等;2)尚未重视的RNAi表达载体的分类界定,对目的小RNA 的表达保真性及有效性等问题.
以RNAi表达载体的系统分类为例,实质上,第一代shRNA 表达载体和第二代amiRNA 载体都存在模拟内源性miRNA 表达骨架的过程,只不过前者模拟程度较小,而后者是最大程度的模拟.由于对两个划时代的RNAi表达载体缺乏明确的划分标准,以致出现siRNA 载体、shRNA 载体、miRNA 载体、amiRNA 载体和shRNAmir载体等多套凌乱的分类名称,这给将来的载体选择和针对性载体优化工作带来潜在麻烦.因此,RNAi表达载体的系统分类不能仅凭其对内源miRNA 表达骨架的模拟程度而定,也不能根据其自身的某一结构组成来定,最好同时结合其结构和功能进行系统分类.鉴于此,提出一种基于结构组成和加工机制双重属性的载体系统分类方法:1)siRNA 载体-载体的表达框为成熟siRNA,直接转录产生成熟siRNA;2)shRNA 载体-载体的表达框为shRNA,转录产物需经Dicer类似酶加工产生成熟siRNA;3)amiRNA 或shRNAmir载体-载体的表达框为pri-siRNA(即pri-amiRNA),转录产物需经Drosha和Dicer类似酶加工产生成熟siRNA(即成熟amiRNA);4)miRNA 载体-载体的表达框为pri-miRNA,转录产物需经Drosha和Dicer酶加工产生成熟miRNA.
6 结论
对RNAi表达载体的非生物与生物递送系统及基因调控、文库构建、转基因等主流应用方面的研究进展进行综述,对RNAi表达载体的结构组成、发展沿革及体内作用机制进行归纳分析,提出基于结构组成和加工机制双重属性的分类方法.但是,该方法在实际操作中还存在一些问题:1)RNAi表达载体中各个组件之间或多或少地存在一定的连接序列,因此很难确定其表达框是shRNA 还是pri-miRNA;2)需要对每一个RNAi表达载体进行加工机制研究.因此,较为系统的命名方法有待研究的进一步深入而最终建立.
[1]HUANG H Y,CHIANG B L.siRNA as a therapy for asthma[J].Curr Opin Mol Ther,2009,11(6):652-663.
[2]WHEELER L A,VRBAMAC V,TRIFONOVA R,et al.Durable knockdown and protection from HIV transmission in humanized mice treated with gel-formulated CD4aptamer-siRNA chimeras[J].Molecular Therapy:The Journal of the American Society of Gene Therapy,2013,21(7):1378-1389.
[3]LI Yang,LU Jin-feng,HAN Yan-hong,et al.RNA interference functions as an antiviral immunity mechanism in mammals[J].Science,2013,342(6155):231-234.
[4]BRUMMELKAMP T R,BERNARDS R,AGAMI R A.System for stable expression of short interfering RNAs in mammalian cells[J].Science,2002,296(5567):550-553.
[5]ZENG Y,WAGNER E J,CULLEN B R.Both natural and designed micro RNAs can inhibit the expression of cognate mRNAs when expressed in human cells[J].Molecular Cell,2002,9(6):1327-1333.
[6]van GESTEL M A,van ERP S,SANDERS L E,et al.shRNA-induced saturation of the microRNA pathway in the rat brain[J].Gene Therapy,2014,21(2):205-211.
[7]KOZOMARA A,GRIFFITHS J S.Mirbase:Integrating microRNA annotation and deep-sequencing data[J].Nucleic Acids Research,2011(39):D152-D157.
[8]SCHOPMAN N C,LIU Y P,KONSTANTINOVA P,et al.Optimization of shRNA inhibitors by variation of the terminal loop sequence[J].Antiviral Research,2010,86(2):204-211.
[9]CHUMAKOV S P,KRAVCHENKO J E,PRASSOLOV V S,et al.Efficient downregulation of multiple mRNA targets with a single shRNA-expressing lentiviral vector[J].Plasmid,2010,63(3):143-149.
[10]WU Jun-zhu,LIU Shi-he,YU Jian,et al.Vertically integrated translational studies of PDX1as a therapeutic target for pancreatic cancer via a novel bifunctional RNAi platform[J].Cancer Gene Ther,2014,21(2):48-53.
[11]WU Jun-zhu,BONSRA A N,DU Guang-wei.pSM155and pSM30vectors for miRNA and shRNA expression[M].Totowa:Humana Press,2009:1-15.
[12]FELLMANN C,HOFFMANN T,SRIDHAR V,et al.An optimized microRNA backbone for effective single-copy RNAi[J].Cell Reports,2013,5(6):1704-1713.
[13]YUE Jun-ming,SHENG Yi,REN Ai-xia,et al.A miR-21hairpin structure-based gene knockdown vector[J].Biochemical and Biophysical Research Communications,2010,394(3):667-672.
[14]CHEN S C Y,STERN P,GUO Zhu-yan,et al.Expression of multiple artificial microRNAs from a chicken miRNA126-based lentiviral vector[J].PloS One,2011,6(7):e22437.
[15]LEE N S,DOHJIMA T,BAUER G,et al.Expression of small interfering RNAs targeted against HIV-1rev transcripts in human cells[J].Nature Biotechnology,2002,20(5):500-505.
[16]CHEN Chang-zhen,LI Ling,LODISH H F,et al.MicroRNAs modulate hematopoietic lineage differentiation[J].Science,2004,303(5654):83-86.
[17]SILVA J M,LI M Z,CHANG K,et al.Second-generation shRNA libraries covering the mouse and human genomes[J].Nat Genet,2005,37(11):1281-1288.
[18]MOFFAT J,GRUENEBERG D A,YANG X,et al.A lentiviral RNAi library for human and mouse genes applied to an arrayed viral high-content screen[J].Cell,2006,124(6):1283-1298.
[19]BOUDREAU R L,MARTINS I,DAVIDSON B L.Artificial microRNAs as siRNA shuttles:Improved safety as compared to shRNAsinvitroandinvivo[J].Molecular Therapy:The Journal of the American Society of Gene Therapy,2009,17(1):169-175.
[20]CHUNG K H,HART C C,AL-BASSAM S,et al.Polycistronic RNA polymerase Ⅱexpression vectors for RNA interference based on BIC/miR-155[J].Nucleic Acids Research,2006,34(7):e53.
[21]WILSON R C,DOUDNA J A.Molecular mechanisms of RNA interference[J].Annual Review of Biophysics,2013,42:217-239.
[22]陈光伟,王士斌.纳米载体共载基因与化疗药物用于癌症治疗的研究进展[J].药学学报,2013,48(7):1091-1098.
[23]QAZI Y,STAGG B,SINGH N,et al.Nanoparticle-mediated delivery of shRNA.VEGF-aplasmids regresses corneal neovascularization[J].Investigative Ophthalmology and Visual Science,2012,53(6):2837-2844.
[24]HAN Lu,TANG Cui,YIN Chun-hua.Oral delivery of shRNA and siRNA via multifunctional polymeric nanoparticles for synergistic cancer therapy[J].Biomaterials,2014,35(15):4589-4600.
[25]陆艳梅,张金文,魏玉洁,等.罂粟COR 和BBE基因RNAi载体构建及烟草转化[J].药学学报,2013,48(7):1169-1177.
[26]MACDIARMID J A,MUGRIDGE N B,WEISS J C,et al.Bacterially derived 400nm particles for encapsulation and cancer cell targeting of chemotherapeutics[J].Cancer Cell,2007,11(5):431-445.
[27]KEATES A C,FRUEHAUF J H,XIANG Shuang-lin,et al.Cequent Pharmaceuticals,Inc:The biological pitcher for RNAi therapeutics[J].Pharmacogenomics,2007,8(7):867-871.
[28]MACDIARMID J A,AMARO-MUGRIDGE N B,MADRID-WEISS J,et al.Sequential treatment of drug-resistant tumors with targeted minicells containing siRNA or a cytotoxic drug[J].Nature Biotechnology,2009,27(7):643-651.
[29]ANDERSSON M G,HAASNOOT P J,XU N,et al.Suppression of RNA interference by adenovirus virus-associat-ed RNA[J].Journal of Virology,2005,79(15):9556-9565.
[30]卢善良,黄轶群,马旭东.下调组蛋白去乙酰化酶1的表达引起人白血病HL-60细胞的分化[J].药学学报,2013,48(5):668-674.
[31]BOREL F,van LOGTENSTEIN R,KOORNNEEF A,et al.Invivoknock-down of multidrug resistance transporters ABCC1and ABCC2by AAV-delivered shRNAs and by artificial miRNAs[J].J RNAi Gene Silencing,2011,7:434-442.
[32]van ES H H,ARTS G J.Biology calls the targets:Combining RNAi and disease biology[J].Drug Discovery Today,2005,10(20):1385-1391.
[33]FELLMANN C,ZUBER J,MCJUNKIN K,et al.Functional identification of optimized RNAi triggers using a massively parallel sensor assay[J].Molecular Cell,2011,41(6):733-746.
[34]PADDISON P J,SILVA J M,CONKLIN D S,et al.A resource for large-scale RNA-interference-based screens in mammals[J].Nature,2004,428(6981):427-431.
[35]BOUDREAU R L,MONTEYS A M,DAVIDSON B L.Minimizing variables among hairpin-based RNAi vectors reveals the potency of shRNAs[J].Rna,2008,14(9):1834-1844.
[36]STEGMEIER F,HU G,RICKLES R J,et al.A lentiviral microRNA-based system for single-copy polymerase IIregulated RNA interference in mammalian cells[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(37):13212-13217.
[37]ZHOU J,LI B,PENG C,et al.Inhibition of cervical cancer cell growthinvitroandinvivoby lentiviral-vector mediated shRNA targeting the common promoter of HPV16E6and E7oncogenes[J].Antiviral Research,2013,98(2):305-313.
[38]CHUMAKOV S P,KRAVCHENKO J E,PRASSOLOV V S,et al.Efficient downregulation of multiple mRNA targets with a single shRNA-expressing lentiviral vector[J].Plasmid,2010,63(3):143-149.
[39]VIDIGAL J A,MORKEL M,WITTLER L,et al.An inducible RNA interference system for the functional dissection of mouse embryogenesis[J].Nucleic Acids Research,2010,38(11):e122.
[40]DOW L E,PREMSRIRUT P K,ZUBER J,et al.A pipeline for the generation of shRNA transgenic mice[J].Nature Protocols,2012,7(2):374-393.
