基于微小隐孢子虫重组CP15/60蛋白的间接ELISA检测方法的建立及上海市猪隐孢子虫感染情况调查
2015-11-19刘宇轩米荣升于慧珠詹婷婷周金林陈兆国
刘宇轩,米荣升,2,黄 燕,2,于慧珠,胡 盼,詹婷婷,周金林,2,陈兆国,2
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室 农业部动物产品质量安全生物性危害因子风险评估实验室(上海),上海 200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
基于微小隐孢子虫重组CP15/60蛋白的间接ELISA检测方法的建立及上海市猪隐孢子虫感染情况调查
刘宇轩1,米荣升1,2,黄 燕1,2,于慧珠1,胡 盼1,詹婷婷1,周金林1,2,陈兆国1,2
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室 农业部动物产品质量安全生物性危害因子风险评估实验室(上海),上海 200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为建立敏感、特异的猪隐孢子虫感染血清学检测方法,了解上海市猪隐孢子虫感染情况,以纯化的重组CP15/60(rCP15/60)为诊断抗原,建立了检测隐孢子虫感染的间接ELISA方法,并对上海市猪隐孢子虫感染情况进行血清学调查。结果显示,与Nested PCR方法检测结果相比,本研究建立的rCP15/60-ELISA方法的阴阳性符合率为83.3%,敏感性为100%,特异性为80%;重复性试验的变异系数在12.5%之内;对341份猪田间血清进行检测,阳性为194份,占56.89%,表明该方法可用于实验室初步诊断和现场猪隐孢子虫病的流行病学调查。
微小隐孢子虫;重组CP15/60;间接ELISA;调查
隐孢子虫病(cryptosporidiosis)是由隐孢子虫(Cryptosporidium spp.)引起的以持续性腹泻为主要临床症状的一种全球性、水源性传播的人兽共患寄生虫病,严重时可导致人和动物死亡。其病情的严重程度与机体免疫状况有关,免疫功能正常的人或动物在感染后会出现腹泻症状,但可自愈;而免疫功能低下者,尤其是婴幼儿和艾滋病患者,感染后病情严重,甚至危及生命[1]。自1907年Tyzzer[2]首次发现隐孢子虫以来,研究报道显示在世界上大多数国家和地区存在该虫,研究人员已注意到其在全球的感染数量被严重低估[3]。在欠发达地区以及高收入国家的研究均已证实,隐孢子虫是引起人和动物腹泻以及儿童营养不良的重要病原[3]。尽管对该病的防治已经进行了大量的研究,但至今仍没有一种有效的防治方法。因此,发展隐孢子虫病病原检测技术,及时了解疾病感染情况,对于预防和减少疾病危害具有重要意义。
酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)具有很高的特异性、敏感性、稳定性和重复性,且操作简便,已成为酶免疫测定技术中应用最广、研究最多和最完善的技术[4]。应用该技术可在一天之内检查几百甚至上千份样品,特别适合于大规模的流行病学调查。用于ELISA诊断的隐孢子虫抗原主要是卵囊和子孢子抗原,其中表面抗原的免疫原性和反应原性研究最为深入,其编码基因也被认为是隐孢子虫疫苗的重要候选基因。微小隐孢子虫(Cryptosporidium parvum)子孢子表面蛋白CP15/60是公认的具有保护性的抗原之一[5],也是隐孢子虫子孢子成份中反应最强烈的蛋白之一[6]。Jenkins等[7]从微小隐孢子虫噬菌体表达文库中获得编码CP15/60的基因,含有该基因的重组质粒免疫母牛后,血清和初乳中产生了很强的抗隐孢子虫特异性抗体,免疫抑制的成年鼠口服免疫母牛的初乳后,对隐孢子虫感染也产生了部分保护作用[8]。何宏轩等[9]将含有CP15/60的真核重组质粒pcDNA3-15/60经鼻粘膜免疫怀孕成年山羊,同样发现抗CP15/60抗体存在于免疫山羊的血浆和初乳中,并能将免疫力传给哺乳的羔羊,使羔羊对微小隐孢子虫感染产生保护。在众多的已知隐孢子虫抗原中,CP15/60显示出高度的免疫原性和反应原性,被认为是很有前途的免疫诊断和疫苗候选抗原[5]。
本实验室在前期工作中克隆和表达了微小隐孢子虫CP15/60基因,本研究以原核表达的重组CP15/60(recombinant CP15/60, rCP15/60)蛋白为抗原,建立检测隐孢子虫病的间接ELISA诊断方法,并应用于现场分离的猪血清样品检测,评估其在隐孢子虫病诊断和流行病学调查中的应用前景。
1 材料与方法
1.1 质粒与菌株 含微小隐孢子虫CP15/60基因的重组质粒pET-28b-CP15/60及转化了该重组质粒的BL21(DE3)菌液由本实验室制备保存[4]。
1.2 主要试剂 蛋白分子量标准购自Thermo公司;6× Protein Loading Buffer购自上海康稳生物科技有限公司;Ni-NTA His Bind Resin层析柱购自Merck公司;胰蛋白胨、酵母提取物、脱脂奶粉购自英国OXOID公司;硫酸卡那霉素购自生工生物工程(上海)股份有限公司;DAB、TMB购自天根生化科技(北京)有限公司;过硫酸铵、丙烯酰胺、TEMED购自Sigma公司;兔抗猪IgG-HRP购自Abcam公司;硝酸纤维素膜购自Whatman公司;FastDNA SPIN Kit for Soil试剂盒购自MP公司;ELISA酶标板为Costar公司产品;其他试剂均为国产分析纯。
1.3 血清 隐孢子虫感染猪血清、隐孢子虫猪阴性血清及相应粪便采自2月龄以内的广西巴马小型猪,采用Nested PCR方法对每3 d采集1次的粪便连续多次重复检测确定;猪附红细胞体(Mycoplasma suis)阳性血清采自田间猪样本,经PCR检测为猪附红细胞体感染,间接ELISA检测抗体阳性;弓形虫(Toxoplasma gondii)感染猪血清、猪瘟病毒(Classical swine fever virus,CSFV)感染猪血清、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染猪血清分别由上海兽医研究所王权研究员、马志永研究员和周艳君研究员馈赠;猪田间血清采自上海市长宁区、松江区和嘉定区某屠宰场成年育肥猪。
1.4 重组质粒的诱导表达与重组蛋白纯化 将10 mL pET-28b-CP15/60重组质粒转化菌加入到250 mL自转录培养基中37℃培养16h,离心收集菌体。加入10mL结合缓冲液重悬菌体,冻融3次后进行冰浴超声,4℃、10000×g离心10min,收集上清,再次离心后,取上清用0.45 μm滤膜过滤除杂,利用Ni-NTA His BindResin层析柱纯化rCP15/60蛋白,进行SDS-PAGE分析纯度并用ThermoFisher公司的NanoDrop 2000c分光光度计测定蛋白浓度,-70℃保存备用。
1.5 Western blot检测 按文献[4]报道的方法,用Western blot技术对纯化的rCP15/60的反应原性进行检测,所用一抗血清为隐孢子虫感染猪血清(1:100稀释),二抗为HRP标记的兔抗猪IgG(1:1000稀释),DAB显色。
1.6 间接ELISA检测方法的建立
1.6.1 重组抗原最适包被浓度和血清最佳稀释度的确定 通过方阵实验确定抗原最适包被浓度和血清最佳稀释度。用0.05mol/L碳酸钠-碳酸氢钠缓冲液(pH9.6)将重组抗原依次稀释成0.5、1.0、2.0、4.0、8.0μg/mL,分别包被酶标板,每孔100 μL,4℃包被过夜。用PBST洗涤酶标板3次,每次5min,然后用5%脱脂奶粉37℃封闭2h。再用PBST洗涤酶标板3次,以1:100、1:200、1:400、1:800稀释的阳性血清以及阴性血清为一抗,37℃作用45min。PBST洗涤3次后,加入100 μL HRP标记的兔抗猪IgG(1:800稀释),37℃作用30min。每孔加入100μL TMB-H2O2避光显色15min,再加入50μL 2mol/L硫酸终止反应,测定450nm波长处的光密度值(OD450),选择阳性OD450>1.0、阴性OD450较小、P/N值较大的抗原包被浓度、血清稀释度组合作为最适包被浓度和血清最佳稀释度。
1.6.2 酶标二抗最适稀释度的确定 用重组抗原最适稀释浓度包被酶标板,阳、阴性血清按最佳浓度稀释,酶标二抗稀释成1:400、1:800、1:1600、1:3200共4个梯度,进行ELISA测定,并重复3次,以P/N值最大时的酶标二抗稀释度为最适稀释度。
1.6.3 rCP15/60-ELISA判定标准的确定 参考Case等[10]的方法来确定阴阳性标准临界值。收集60份经Nested PCR法检测粪便DNA为阴性的猪血清样品,用Nested PCR间接ELISA法检测,重复3次,并设阳性对照。测定OD450值后求出所有阴性血清样品的OD450平均值()和标准差(s)。以OD450(样本)值x≥+4 s时判为阳性;OD450(样本)值x<+3 s时判为阴性;当+3s≤OD450(样本)值<+4 s时判为
1.7 重复性试验
1.7.1 批内重复性试验 在相同试验条件下,用同一批制备的rCP15/60包被酶标板,选取抗体效价不同的4份阳性血清和4份阴性血清,用rCP15/60-ELISA方法检测,测定OD450,每份血清样品平行做8个重复,按以下公式计算变异系数(coefficient of variance,CV):CV=[样本 OD450值标准差(s)/样本 OD450值平均数()]×100%。
1.7.2 批间重复性试验 以4批不同时间纯化的重组蛋白作为抗原分别包被酶标板,利用rCP15/60-ELSIA技术,对抗体效价不同的4份阳性血清和4份阴性血清进行检测,测定OD450,每份样品重复3次,取平均值,同1.7.1观察其CV值。
1.8 敏感性、特异性试验 从田间同时收集猪的粪便及血清样品,其中血清用rCP15/60-ELISA技术检测;粪便利用FastDNA SPIN Kit for Soil试剂盒提取DNA,按Chen等[11]报道的方法进行Nested PCR检测,按祖立闯等[12]报道的方法计算其阴阳性符合率、敏感性、特异性。
1.9 交叉反应试验 用rCP15/60包被酶标板,然后分别用1:100稀释的猪附红细胞体感染猪血清、弓形虫感染猪血清、猪瘟病毒感染猪血清、猪蓝耳病病毒感染猪血清作为一抗,按rCP15/60-ELISA方法,加入对应的HRP标记二抗,检测血清交叉反应情况,每份血清平行做3个重复。
1.10 田间样品检测 2012年7月从上海市长宁区某屠宰场采集成年育肥猪血清167份,同年10月从上海市松江区和嘉定区某屠宰场采集成年育肥猪血清67份和107份,共341份,应用建立的rCP15/60-ELISA技术对其进行检测。
2 结果
2.1 rCP15/60蛋白的表达与纯化 重组质粒pET-28b -CP15/60转化菌诱导表达16h后,经SDS-PAGE电泳,出现了大小约21kDa的明显条带,与预计大小相同表达产物经Ni-NTA His Bind Resin层析柱纯化后,得到了较纯的目的蛋白(图1),浓度为2.4 mg/mL。

图 1 重组蛋白的 SDS-PAGE 电泳Fig.1 SDS-PAGE electrophoresis of the expressed recombinant protein
2.2 重组蛋白的Western blot分析 结果显示,rCP15/60能与隐孢子虫感染猪血清反应,而与未感染隐孢子虫的阴性猪血清无反应(图2)。
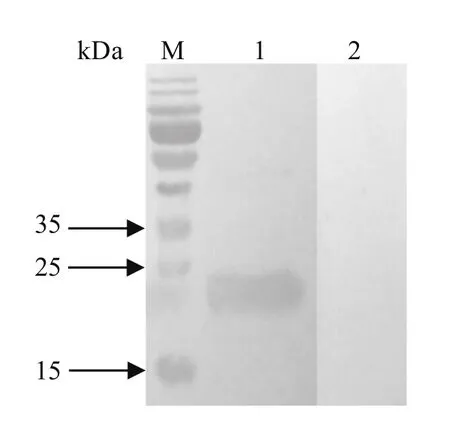
图 2 重组蛋白的 Western blot 分析Fig. 2 Western blot analysis of the expressed recombinant protein
2.3 间接ELISA检测方法的建立
2.3.1 重组抗原最适包被浓度、血清最佳稀释度、酶标抗体工作浓度的确定 通过方阵试验确定了抗原最适包被浓度为2 μg/mL,一抗血清最佳稀释度为1:100(表1),兔抗猪IgG-HRP酶标二抗工作浓度为1:800(表2)。
2.3.2 阴、阳性临界值的确定 60份阴性猪血清样本OD450平均值()和标准差(sd)分别0.270 844与0.052 524+4s=0.480 49+3s=0.428 41。当样品OD450值x≥0.480 49时判为阳性;当样品OD450值x<0.428 41时判为阴性;当样品OD450值介于0.428 41(含0.42841)与0.48049之间则判为疑似。对可疑样本重检时,当OD450值x≥+3.5s=0.45445为阳性,OD450值x <+3.5s=0.45445为阴性。
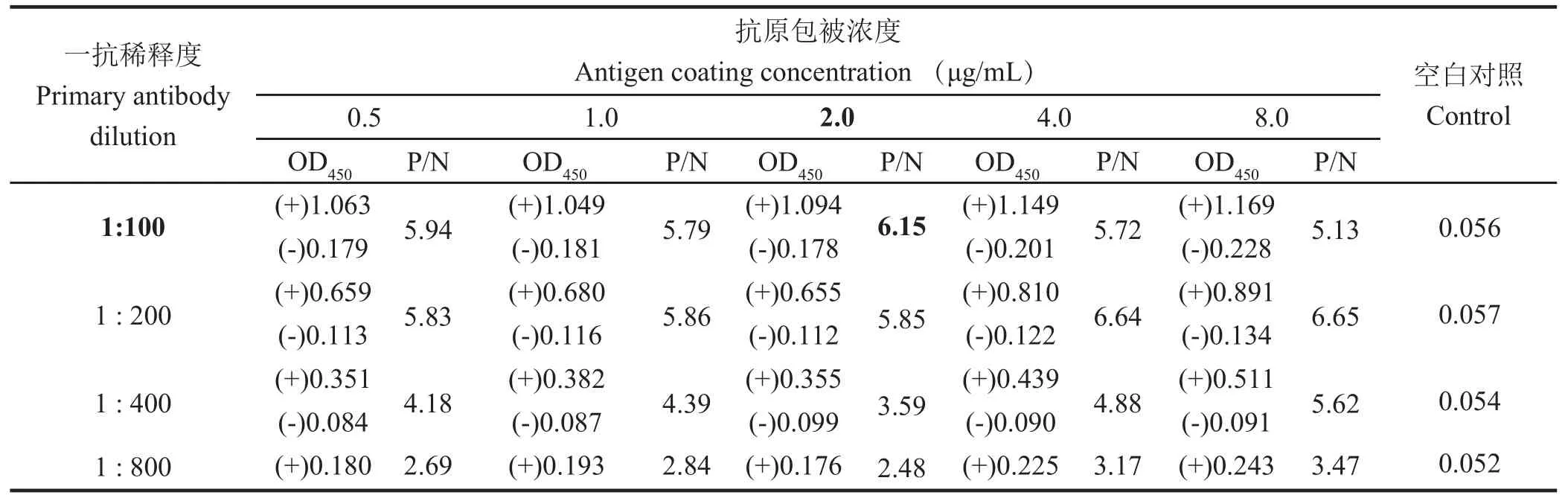
表1 棋盘法筛选抗原和一抗工作浓度Table 1 Determination of the most appropriate concentration of antigen and primary antibody using chessboard method

表 2 二抗工作浓度的确定Table 2 Determination of the most appropriate concentration of rabbit anti-pig IgG/HRP
2.4 重复性试验结果 批内重复性试验的CV为3.47%~8.52%,均小于10%;不同批次重组抗原的批间重复性试验CV为6.25%~12.5%,均小于15%(表3)。

表3 重复性试验结果Table3 The results of repetition test
2.5 rCP15/60-ELISA的敏感性、特异性试验 应用rCP15/60-ELISA技术对采集的18份血清样品进行检测,检测出阳性6份,阴性12份,阳性率为33.33%。对应宿主的粪便样品DNA用nested PCR法检测,结果阳性样品为3份,阴性样品为15份,阳性率为16.67%。rCP15/60-ELISA技术检测阳性率高于Nested PCR法检测结果,rCP15/60-ELISA相对于Nested PCR的阴阳性符合率为83.3%,敏感性为100%,特异性为80%(见表4)。
2.6 交叉反应试验结果 以rCP15/60蛋白包被酶标板,与猪附红细胞体感染猪血清、弓形虫感染猪血清、猪瘟病毒感染猪血清、猪繁殖与呼吸综合征病毒感染猪血清反应,OD450分别为0.178、0.356、0.146、0.053,均低于0.428 41。阳性对照OD450为0.976,阴性对照OD450为0.143。
2.7 田间样品检测 341份猪田间血清样品检测结果显示,阳性为194份,占56.89%,其中长宁区屠宰场阳性102份,占61.08%;松江区屠宰场阳性32份,占47.76%;嘉定区屠宰场阳性60份,占56.07%(表5)。从不同时间来看,7月采集样品167份,阳性102份,占61.08%;10月采集样品174份,阳性92份,占52.87%。

表 4 微小隐孢子虫感染不同检测方法检测结果比较Table 4 Comparison of different methods for detecting Cryptosporidium

表 5 不同屠宰场场猪隐孢子虫感染情况Table 5 The Cryptosporidium infection situation of pigs from different slaughterhouse
3 讨论
建立高敏感、特异强、重复性好的免疫学诊断技术,对于人和动物隐孢子虫病的防控具有重要意义。尽管有不少抗原已被用于建立隐孢子虫病免疫学诊断技术,但迄今尚无比较理想的隐孢子虫病免疫学诊断试剂盒。本研究利用重组表达的CP15/60蛋白,建立了检测猪隐孢子虫感染的间接ELISA技术。对批内和批间抗原的重复性检测显示,两者分别小于10%和15%,提示重复性良好。同时,相对于Nested PCR技术,rCP15/60-ELISA的敏感性为100%,特异性为80%,阴阳性符合率为83.3%,符合率较高。其中有部分ELISA检测阳性的样品,Nested PCR检测为阴性,这可能原因有两个:第一,当每克粪便有200个以上卵囊时,Nested PCR法才能检测到,而每克粪便中卵囊量小于200个时,Nested PCR法检测不出[13]。在本研究中,猪感染隐孢子虫后,可能粪便中卵囊不足以被检测出,所以部分样品ELISA检测为阳性而Nested PCR检测为阴性。第二,猪感染隐孢子虫一段时间后,粪便中已停止排出卵囊,而体内却已产生抗体,导致抗体能够检出而粪便卵囊没有检测到。ELISA和 nested PCR的检测对象不同,反映不同的感染现象,在做流行病学调查时,如能将两种方法结合使用,更能准确的反应出隐孢子虫的真实感染情况。
Chen等[11]用Sheather's蔗糖漂浮法和改良抗酸染色法对上海市12个猪场猪隐孢子虫感染情况进行调查,结果显示上海市猪的平均感染率为34.4%,不同猪场普遍存在隐孢子虫感染,但各场间感染率差异很大,在14.1%~90.6%之间。其中上海市嘉定区3个猪场的感染率分别为80.0%、63.0%和14.1%;上海市松江区某猪场隐孢子虫感染率为82.61%。本文采用CP15/60-ELISA方法对嘉定区和松江区的猪场进行检测,结果阳性率分别为56.07%和47.76%,其中前者在上次调查结果范围之内,后者比前次调查结果低,这可能与检测猪年龄较大有关,但仍然提示上海市不同地域猪隐孢子虫感染率普遍较高。不同场之间感染率略有差别,长宁区某屠宰场猪的阳性率高于嘉定区和松江区,这可能与猪个体差异、饲喂条件、生长环境以及运输过程中的差异有关,具体的原因有待于进一步分析。从不同月份来看,感染率要高于秋季,这与隐孢子虫病在温暖潮湿季节多发的流行特点相吻合。上海市温暖潮湿的季节较长,因此要特别注意本病的流行,加强管理,做好卫生,降低损失。在后续的研究中,本实验室将继续采集更多的样品进行检测,并与利用其他抗原建立的免疫学诊断方法进行比较,以更好地评价其诊断效果,为最终构建试剂盒,应用于生产实践奠定基础。同时,将进一步对其他动物样品,比如牛、鸡、鼠等进行检测,观察对这些动物样品的检测效果,扩大其使用范围,为动物隐孢子虫病防控提供技术支持。
综上所述,本研究采用重组表达的CP15/60蛋白,建立了检测猪隐孢子虫感染的rCP15/60-ELISA方法,经与Nested PCR法比较,显示该方法具有较好的敏感性、特异性和重复性。诊断抗原rCP15/60易纯化、产量高、操作简便、生产成本低,为rCP15160-ELISA试剂盒研发奠定了坚实基础。
致谢:本论文受上海市闵行区高层次人才科研项目资助;中国农业科学院上海兽医研究所马志永研究员、周艳君研究员和王权研究员分别为本研究提供了猪瘟病毒感染猪血清、猪繁殖与呼吸综合征病毒感染猪血清和弓形虫感染猪血清,特此表示衷心的感谢。
[1]Hunter P R, Nichols G. Epidemiology and clinical features of Cryptosporidium infection in immunocompromised patients [J]. Clin Microbiol Rev, 2002, 15(1):145-154.
[2]Tyzzer E E. A sporozoon found in the peptic glands of the common mouse [J]. Proc Soc Exp Biol Med, 1907, 5:12-13.
[3]Checkley W, White A C Jr, Jaganath D, et al. A review of the global burden, novel diagnostics, therapeutics, and vaccine targets for Cryptosporidium [J]. Lancet Infect Dis, 2015,15(1): 85-94.
[4]于慧珠,陈兆国,岳城,等.微小隐孢子虫子孢子表面抗原CP15/60基因的克隆与原核表达[J].中国兽医科学, 2008,38(8): 670-675.
[5]De Graaf D C, Spano F, Petry F, et al. Speculation on whether a vaccine against cryptosporidiosis is a reality or fantasy[J]. Int J Parasitol, 1999, 29(8): 1289-1306.
[6]Jenkins M C, Fayer R. Cloning and expression of cDNA encoding an antigenic Cryptosporidium parvum protein[J]. Mol Biochem Parasitol, 1995, 71(1): 149-152.
[7]Jenkins M C, Fayer R, Tilley M, et al. Cloning and expression of a cDNA encoding epitopes shared by 15- and 60-kilodalton proteins of Cryptosporidium parvum sporozoites[J]. Infect Immun,1993, 61(6): 2377-2382.
[8]Jenkins M C, O'brien C, Trout J, et al. Hyperimmune bovine colostrum specific for recombinant Cryptosporidium parvum antigen confers partial protection against cryptosporidiosis in immunosuppressed adult mice [J]. Vaccine, 1999, 17(19): 2453-2460.
[9]何宏轩,张西臣,尹继刚,等.微小隐孢子虫子孢子表面蛋白CP15/60编码基因核酸疫苗的研究[J].中国农业科学,2003, 11: 1357-1361.
[10]Case J T, Ardans A A, Bolton D C, et al. Optimization of parameters for detecting antibodies against infectious bronchitis virus using an enzyme-linked immunosorbent assay: temporal response to vaccination and challenge with live virus [J]. Avian Dis, 1983, 27(1): 196-210.
[11]Chen Z G, Mi R S, Yu H Z, et al. Prevalence of Cryptosporidium spp. in pigs in Shanghai, China [J]. Vet Parasitol,2011, 181(2-4): 113-119.
[12]祖立闯,朱远茂,王延辉,等.牛传染性鼻气管炎病毒重组gD蛋白间接ELISA方法的建立及应用[J].中国预防兽医学报, 2008, 30(7): 537-543.
[13]Hadfield S J, Robinson G, Elwin K, et al. Detection and differentiation of Cryptosporidium spp. in human clinical samples using real-time PCR [J]. Clin Microbiol, 2010,49(3): 918-924.
DEVELOPMENT OF INDIRECT ELISA WITH RECOMBINANT CP15/60 OF CRYPTOSPORIDIUM PARVUM AND SEROLOGICAL SURVEY OF PIG CRYPTOSPORIDIOSIS IN SHANGHAI
LIU Yu-xuan1, MI Rong-sheng1,2, HUANG Yan1,2, YU Hui-zhu1, HU Pan1, ZHAN Ting-ting1,ZHOU Jin-lin1,2, CHEN Zhao-guo1,2
(1. Laboratory of Quality and Safety Risk Assessment for Animal Products on Biohazards (Shanghai), Ministry of Agriculture, Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009,China)
To develop sensitive and specific serological detection method of pig Cryptosporidium infection and understand the situation of Cryptosporidium infection in pigs in Shanghai, an indirect ELISA method were developed to detect Cryptosporidium infection in pigs with the recombinant CP15/60 (rCP15/60) protein as diagnostic antigen. The reproducibility, sensitivity and specificity of the method were evaluated. The situation of pigs Cryptosporidium infection were serological detected with the developed method. The result showed that comparing with Nested PCR detection results, the negative and positive coincidence, sensitivity and specificity were 83.3%,100% and 80%, respectively. The coefficient of variability of reproducibility was≤12.5%. Total of 194 (56.89%) sera were positive in 341 sera collected from pigs in field in Shanghai. These results indicated that the method was suitable to be used as laboratory primary diagnosis and field serological survey of porcine cryptosporidiosis.
Cryptosporidium parvum; recombinant CP15/60; indirect ELISA; survey
S852.723
A
1674-6422 (2015)04-0037-07
2015-03-03
国家科技重大专项项目(2012ZX10004220);2015年国家畜禽产品质量安全风险评估项目(GJFP201500803);家畜疫病家畜疫病病原生物学国家重点实验室开放基金课题(SKLVEB2013KFKT017);上海市科技兴农重点攻关项目(沪农科攻字[2005]第1-10号[2005]第3-4号)
刘宇轩,男,硕士研究生,预防兽医学专业
陈兆国,E-mail:zhaoguochen@shvri.ac.cn
