睡眠呼吸暂停低通气综合征与NAFLD关系的Meta分析
2015-11-18王琳田建立李岱冯淑芝任美书
王琳,田建立,李岱,冯淑芝,任美书
循证医学
睡眠呼吸暂停低通气综合征与NAFLD关系的Meta分析
王琳,田建立△,李岱,冯淑芝,任美书
目的评价睡眠呼吸暂停低通气综合征(SAHS)与非酒精性脂肪性肝病(NAFLD)的相关性。方法检索Web of science、EMbase、Pubmed、SpringerLink、EBSCO数据库、中国学术期刊网全文、重庆维普中文科技期刊全文、万方科技期刊全文数据库中发表的有关SAHS与NAFLD关系的病例-对照研究,由2名评价员独立对纳入的研究进行质量评价和数据提取,利用RevMan 5.1和Stata 12.0统计软件进行Meta分析。结果共纳入符合标准的文献11篇。Meta分析结果显示SAHS患者与非SAHS患者相比存在NAFLD的危险增加(RR=2.82,95%CI:2.03~3.92,P<0.01);SAHS患者血清丙氨酸转氨酶(ALT)升高(SMD=0.53,95%CI:0.02~1.05,P<0.05);在SAHS患者中,重度NAFLD患者呼吸暂停低通气指数(AHI)较轻度NAFLD者升高(SMD=1.42,95%CI:0.12~2.72,P<0.05)。结论SAHS患者患NAFLD的风险增加,NAFLD的严重程度随间歇低氧严重程度的增加而增加。
睡眠呼吸暂停综合征;脂肪肝;转氨酶类;Meta分析;非酒精性脂肪性肝病;丙氨酸转氨酶;天冬氨酸转氨酶;睡眠呼吸暂停低通气综合征
睡眠呼吸暂停低通气综合征(SAHS)是一种具有潜在危险的常见病。SAHS不仅发病率高,而且可引起心脑血管系统、呼吸系统、泌尿生殖系统、内分泌系统等多系统损害[1-2]。近年的临床和基础研究结果显示肝脏也是受累器官之一,肝损伤主要表现为非酒精性脂肪性肝病(nonalcoholic fatty liver dis⁃ease,NAFLD)组织学特征[3-5]。SAHS已被认为是临床慢性肝病病因之一。然而SAHS患者的NAFLD患病率尚缺乏大规模流行病学调查,对丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)的影响如何,以及SAHS患者肝损伤的严重程度与SAHS严重程度指标呼吸暂停低通气指数(apnea hypopnea index,AHI)之间的关系,各家报道不一,结果并不完全一致。本研究对国内外的有关文献进行荟萃分析,从而综合评价SAHS与NAFLD之间的关系。
1 资料与方法
1.1 检索策略中文检索词:阻塞性睡眠呼吸暂停低通气综合征、睡眠呼吸暂停低通气综合征、睡眠呼吸暂停、慢性间歇低氧、低氧、非酒精性脂肪性肝病、肝酶、谷丙转氨酶、谷草转氨酶、丙氨酸转氨酶、天冬氨酸转氨酶、脂肪肝、脂肪性肝炎、脂肪性肝纤维化、肝硬化。英文检索词:chronic intermittent hypoxemia,obstructive sleep apnea,OSAS,sleep apnoea,sleep apnea hypopnea syndrome,SAHS,NASH,NAFLD,non-alcohol⁃ic steatohepatitis,nonalcoholic fatty liver disease,fatty liver,liv⁃er fat,liver enzymes,alanine aminotransferase,aspartate amino⁃transferase,ALT,AST,severity of liver disease,fibrosis。检索数据库包括:Web of Science、EMbase、Pubmed、SpringerLink、EBSCO英文数据库,中国学术期刊网(CNKI)全文、重庆维普(VIP)中文科技期刊全文、万方科技期刊全文数据库。
1.2 纳入标准(1)研究设计合理,研究目的明确、统计方法正确。(2)患者通过多导睡眠图(polysomnography,PSG)或24 h血氧监测确诊SAHS;NAFLD诊断通过肝组织活检或影像学检查(包括超声、磁共振)或肝酶升高。同时排除其他原因引起的肝脏病变。(3)SAHS患者进行PSG检查后6个月内进行肝脏病评估,评估前均未予任何治疗。(4)发表语种限制为中文和英文。
1.3 排除标准(1)动物实验、病例报道和综述类文献。(2)病例数少于10例。(3)SAHS诊断不是通过PSG或24 h血氧监测,大量饮酒、病毒性肝炎等其他原因引起的肝脏疾病。(4)重复报道,质量较差,研究类型不符及信息太少,缺乏数据等无法利用的研究。
1.4 文献质量评价及资料提取由2位研究者独立阅读所获文献题目和摘要,在排除明显不符合纳入标准的试验后,对可能符合纳入标准的试验阅读全文,以确定是否符合纳入标准。2位研究者交叉核对纳入试验的结果,对有分歧而难以确定其是否纳入的试验通过讨论或由第3位研究者决定其是否纳入。缺乏资料的通过电话或信件与作者进行联系予以补充。提取资料主要包括:(1)一般资料。题目、作者姓名、发表日期和文献来源。(2)研究特征。研究对象的一般情况、各组患者的基线可比性、干预措施。(3)结局测量指标。方法同1.2。
1.5 统计学方法按照荟萃分析的要求进行数据整理,对二分类资料用相对危险度(relative risk,RR)进行评估,对连续性变量通过计算标准化均数差值(Satndardised mean difference,SMD)和95%可信区间(CI)进行评估。并行异质性检验,定义χ2检验P<0.1及I2>50%为存在明显异质性。对同质者用固定效应模型分析,异质者用随机效应模型分析,并分析异质来源。使用RevMan 5.1及Stata 12.0统计软件进行数据处理和分析。对发表偏倚采用RevMan绘制漏斗图及Egger、Begg检验进行评价。
2 结果
2.1 文献检索共检索到130篇文献,通过文献摘要并对部分文献全文的阅读,剔除动物实验91篇,综述10篇,病例报道10篇,无对照组5篇,SAHS诊断依据调查问卷1篇,诊断NAFLD前给予间断气道正压通气治疗SAHS 2篇,最终选定11篇[6-16],发表时间为2005—2014年,纳入的研究中观察的对象来自多个国家、多个种族,包括病理性肥胖的人群、非肥胖人群、儿童及老年人,见表1。
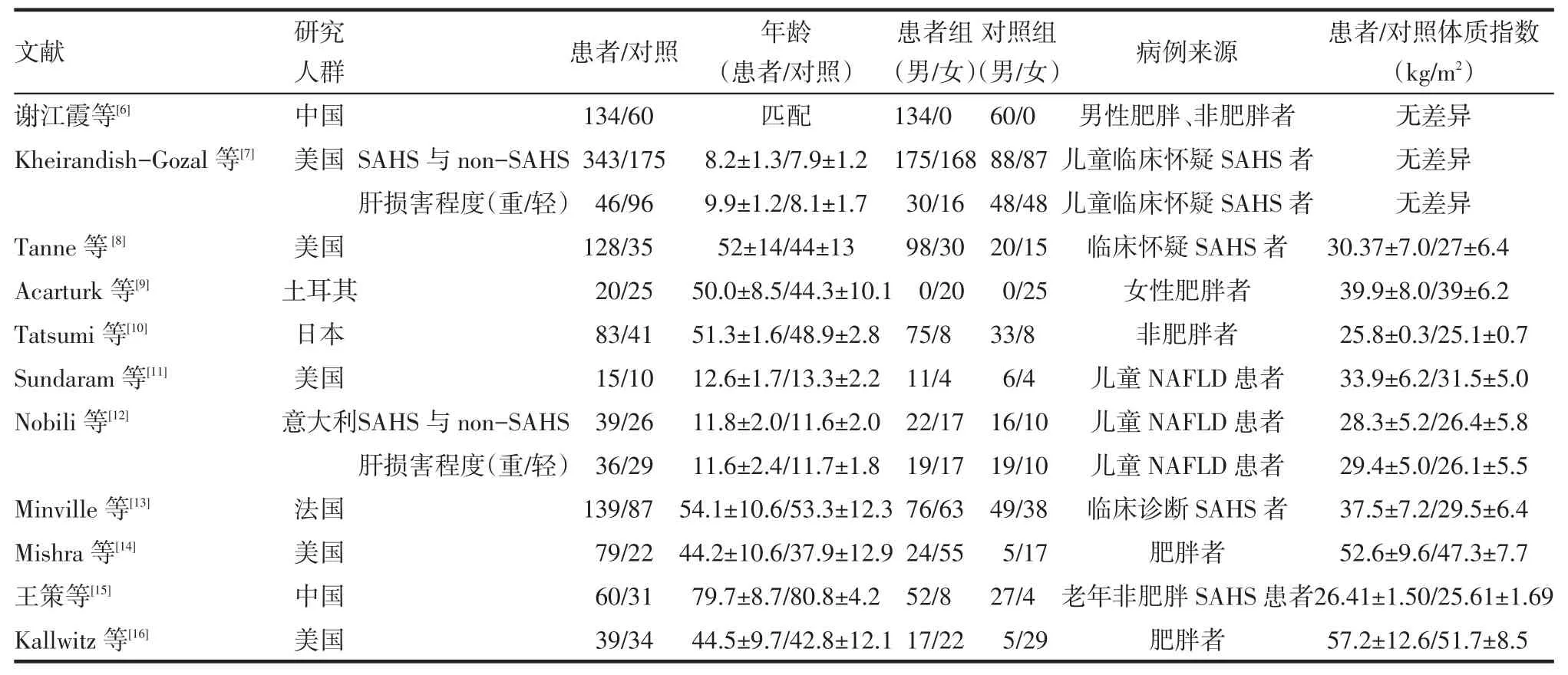
Tab.1 Characteristics of included literature表1 纳入文献的基本情况
2.2 Meta分析结果
2.2.1 SAHS患者同时存在NAFLD的RR纳入5项研究[6-8,15-16],包括1 039例患者,其中SAHS组704例,非SAHS组335例。各研究间无统计学异质性(I2=0%),采用固定效应模型进行合并分析。结果显示SAHS组NAFLD发生率高于非SAHS组(RR= 2.82,95%CI:2.03~3.92,P<0.01),见图1。
2.2.2 SAHS与非SAHS患者间血ALT、AST的差异纳入7项研究[6-7,9-12,15],包括1 062例患者,其中SAHS组694例,非SAHS组368例。ALT、AST分别进行异质性检验,异质性较大(I2分别为91%、93%),故采用随机效应模型进行合并分析。结果显示SAHS组ALT升高(SMD=0.53,95%CI:0.02~1.05,P<0.05),见图2。AST变化无统计学意义(SMD=0.24,95%CI:-0.31~0.78,P>0.05),见图3。异质性来源可能为所纳入的研究选取的研究人群不同。
2.2.3 SAHS患者肝损伤严重程度与AHI间的关系纳入4项研究[7,12-14],共534例患者,均经过肝活检,根据病理结果分为重度和轻度肝损伤,重度肝损伤患者300例,轻度肝损伤者234例。进行异质性检验,异质性较大(I2=97%),故采用随机效应模型进行合并分析,肝损伤较重者AHI偏高(SMD=1.42,95%CI:0.12~2.72,P<0.05),见图4。异质性来源可能为所纳入的研究选取的研究人群不同。
2.3 发表偏倚评估在Revman中漏斗图基本对称。Begg检验Z值分别为0.73、0、0、1.02(均P>0.05)。Egger检验重复测试t值分别为1.30、0.16、0.21、1.38(均P>0.05)。均提示无显著发表偏倚。
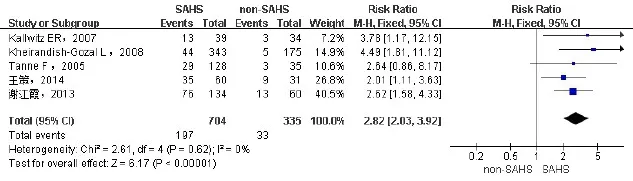
Fig.1 Forest plot of the relative risk of NAFLD in SAHS patients图1 SAHS患者合并NAFLD的相对危险度
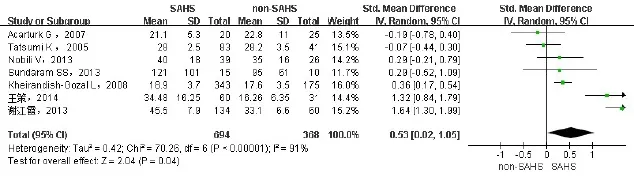
Fig.2 Comparison of forest plot of ALT between SAHS and non-SAHS groups图2 SAHS与非SAHS患者血ALT水平比较
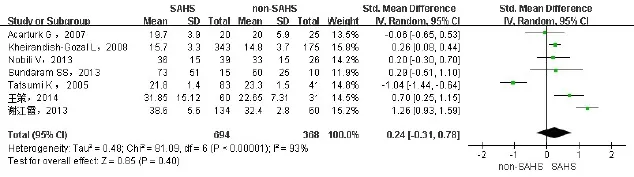
Fig.3 Comparison of forest plot of AST between SAHS and non-SAHS groups图3 SAHS与非SAHS患者血AST水平比较
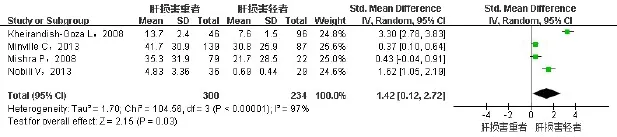
Fig.4 Comparison of forest plot of AHI between severe NAFLD and mild NAFLD groups图4 轻度NAFLD患者与重度NAFLD患者AHI比较
3 讨论
近年来人们逐渐认识到SAHS与NAFLD之间可能存在着联系,一方面,SAHS与NAFLD之间存在许多共同危险因素,与肥胖、增龄、糖代谢紊乱、脂代谢紊乱、高血压等因素关系密切,两者有着共同的病理生理学基础——胰岛素抵抗[5,17-19];另一方面,目前越来越多的临床和基础研究显示,SAHS及其特征性的慢性间歇低氧可以促进NAFLD的发生、发展,而且这种促进作用并不依赖于肥胖[10,20]。然而,正是由于SAHS与NAFLD之间存在许多共同危险因素,两者之间的因果关系受到质疑。目前已发表的关于SAHS患者NAFLD患病情况的研究多是小样本的临床病例对照研究,尚缺乏大规模流行病学调查。
肝酶异常也与SAHS有关,但目前还颇具争议,主要是因为其与肝脏酶的这种相关性只出现在部分个体而不是所有的研究对象中,有些研究中SAHS患者肝酶增高[6-7],但有些研究中SAHS与非SAHS之间肝酶无差异[8-10,21]。有研究显示SAHS是肝酶增高的危险因素,肝酶增高与SAHS严重程度、夜间低氧程度密切相关,且与体质量指数无关[8,20]。细胞和动物实验也证实慢性间歇低氧增加肝脏三酰甘油的聚积、坏死性炎症和纤维化[18]。Savransky等[20]的动物实验提示无论是否有肝病基础存在,慢性间歇低氧均可导致实验鼠的血清转氨酶水平升高,慢性间歇低氧是促使非肥胖模型鼠从肝脂肪变性向脂肪性肝炎进展的因素。
本研究存在一定的局限性,入选的研究多为肥胖需要手术的患者,这些患者中NAFLD、SAHS的患病率及严重程度可能会较高,应增加对非肥胖人群的研究。本研究中纳入了肥胖患者、非肥胖的人群、老年人和儿童、单纯对于肥胖女性人群的研究,这可能增加了研究的异质性。此外,还需要收集更详细的组织病理学资料,这对SAHS或者非SAHS的患者均非常重要。SAHS患者肝酶的升高能否作为肝损伤或肝代谢异常的指标仍有待研究。
[1]Chen BY,He QY.Obstructive sleep apnea syndrome and multiple systems consequences[J].Chinese Medical Journal,2012,92(18):1225-1227.[陈宝元,何权瀛.阻塞性睡眠呼吸暂停综合征的系统性损害[J].中华医学杂志,2012,92(18):1225-1227].doi:10.3760/ cma.j.issn.0376-2491.2012.18.001.
[2]Lurie A.Cardiovascular disorders associated with obstructive sleep apnea[J].Adv Cardiol,2011,46:197-266.doi:10.1159/000325110.
[3]Musso G,Cassader M,Olivetti C,et al.Association of obstructive sleep apnoea with the presence and severity of non-alcoholic fatty liver disease.A systematic review and meta-analysis[J].Obes Rev,2013,14(5):417-431.doi:10.1111/obr.12020.
[4]Feng SZ,Tian JL,Zhang Q,et al.An experimental research on chronic intermittent hypoxia leading to liver injury[J].Sleep Breath,2011,15(3):493-502.doi:10.1007/s11325-010-0370-3.
[5]Tian JL,Zhang Y,Chen BY.Sleep apnea hypopnea syndrome and liver injury[J].Chin Med J(Engl),2010,123(1):89-94.
[6]Xie JX,Cen H,Yang SK,et al.Analysis of liver injury in patients with sleep apnea hypopnea syndrome and its related factors[J].Jour⁃nal of Internal Intensive Medicine,2013,19(2):85-87.[谢江霞,岑慧,阳书坤,等.睡眠呼吸暂停低通气综合征的肝损害及相关因素分析[J].内科急危重症杂志,2013,19(2):85-87].doi:10.11768/nkjw⁃zzzz20130207.
[7]Kheirandish-Gozal L,Sans Capdevila O,Kheirandish E,et al.Elevated serum aminotransferase levels in children at risk for obstructive sleep apnea[J].Chest,2008,133(1):92-99.doi:10.1378/chest.07-0773.
[8]Tanne F,Gagnadoux F,Chazouilleres O,et al.Chronic liver injury during obstructive sleep apnea[J].Hepatology,2005,41(6):1290-1296.
[9]Acarturk G,Unlu M,Yuksel S,et al.Obstructive sleep apnoea,glucose tolerance and liver steatosis in obese women[J].J Int Med Res,2007,35(4):458-466.
[10]Tatsumi K,Saibara T.Effects of obstructive sleep apnea syndrome on hepatic steatosis and nonalcoholic steatohepatitis[J].Hepatol Res,2005,33(2):100-104.
[11]Sundaram SS,Sokol RJ,Capocelli KE,et al.Obstructive sleep ap⁃nea and hypoxemia are associated with advanced liver histology in pediatric nonalcoholic fatty liver disease[J].J Pediatr,2014,164(4):699-706.doi:10.1016/j.jpeds.2013.10.072.
[12]Nobili V,Cutrera R,Liccardo D,et al.Obstructive sleep apnea syn⁃drome affects liver histology and inflammatory cell activation in pe⁃diatric nonalcoholic fatty liver disease,regardless of obesity/insulin resistance[J].Am J Respir Crit Care Med,2014,189(1):66-76.doi:10.1164/rccm.201307-1339OC.
[13]Minville C,Hilleret MN,Tamisier R,et al.Nonalcoholic fatty liver disease,nocturnal hypoxia and endothelial function in sleep apnea patients[J].Chest,2014,145(3):525-533.doi:10.1378/chest.13-0938.
[14]Mishra P,Nugent C,Afendy A,et al.Apnoeic-hypopnoeic episodes during obstructive sleep apnoea are associated with histological non⁃alcoholic steatohepatitis[J].Liver Int,2008,28(8):1080-1086.doi:10.11 11/j.1478-3231.2008.01822.x.
[15]Wang C,Tian JL,Zhang Y.The effect of sleep apnea hypopnea syn⁃drome on nonalcoholic fatty liver disease in the non-obese elderly[J].Chinese Journal of Geriatrics,2014,33(4):372-375.[王策,田建立,张蕴.阻塞性睡眠呼吸暂停低通气综合征对非肥胖老年人非酒精性脂肪性肝病的影响[J].中华老年医学杂志,2014,33(4):372-375].doi:10.3760/cma.j.issn.0254-9026.2014.04.010.
[16]Kallwitz ER,Herdegen J,Madura J,et al.Liver enzymes and histol⁃ogy in obese patients with obstructive sleep apnea[J].J Clin Gastro⁃enterol,2007,41(10):918-921.
[17]Ip MS,Lam B,Ng MM,et al.Obstructive sleep apnea is indepen⁃dently associated with insulin resistance[J].Am J Respir Crit Care Med,2002,165(5):670-676.
[18]Musso G,Olivetti C,Cassader M,et al.Obstructive sleep apnea-hy popnea syndrome and nonalcoholic fatty liver disease:emerging evi⁃dence and mechanisms[J].Semin Liver Dis,2012,32(1):49-64.doi:10.1055/s-0032-1306426.
[19]Liu R,Lu JM,Liu JF,et al.Influence of obstructive sleep apnea syn⁃drome on blood glucose control and occurrence of chronic diabetic complications in type 2 diabetes patients[J].Med J Chin PLA,2012,37(12):1130-1134.[刘然,陆菊明,刘剑锋,等.阻塞性睡眠呼吸暂停综合征对2型糖尿病患者血糖控制及相关慢性并发症的影响[J].解放军医学杂志,2012,37(12):1130-1134].
[20]Savransky V,Bevans S,Nanayakkara A,et al.Chronic intermittent hypoxia causes hepatitis in a mouse model of diet-induced fatty liver[J].Am J Physiol Gastrointest Liver Physiol,2007,293(4):G871-G877.
[21]Aron-Wisnewsky J,Minville C,Tordjman J,et al.Chronic intermit⁃tent hypoxia is a major trigger for non-alcoholic fatty liver disease in morbid obese[J].J Hepatol,2012,56(1):225-233.doi:10.1016/j. jhep.2011.04.022.
(2015-01-15收稿2015-05-06修回)
(本文编辑李国琪)
Meta-analysis on the relationship between sleep apnea-hypopnea syndrome and liver injury
WANG Lin,TIAN Jianli△,LI Dai,FENG Shuzhi,REN Meishu
Department of Geriatrics,Tianjin Medical University General Hospital,Tianjin Geriatrics Institute,Tianjin 300052,China△
ObjectiveTo provide an comprehensive evaluation of the correlation between sleep apnea hypopnea syn⁃drome(SAHS)and nonalcoholic fatty liver disease(NAFLD).MethodsThe various case-control studies on the relation⁃ship between SAHS and NAFLD were retrieved from all kinds of large-scale databases at home and abroad(including Web of science,EMbase,Pubmed,Springer Link,EBSCO Databases,CNKI,CQVIP,Wanfang Data).The quality evaluation of in⁃cluded studies was made by two independent researchers.RevMan 5.1 and stata 12.0 software were used for meta-analysis. ResultsA total of 11 qualified documents were included in this study.Meta analysis showed that the relative risk of NAFLD was increased in SAHS patients than non-SAHS patients(RR=2.82,95%CI:2.03-3.92,P<0.01).The serum ala⁃nine aminotransferase(ALT)increased in SAHS patients(SMD=0.53,95%CI:0.02-1.05,P<0.05).Compared with non-SAHS patients,the apnea-hypopnea index(AHI)was significantly higher in SAHS patients combined with severe NAFLD than those combined with mild NAFLD(SMD=1.42,95%CI:0.12-2.72,P<0.05).ConclusionThe risk of NAFLD in⁃creases in SAHS patients.The severity of NAFLD is relatively higher with the severity of intermittent hypoxia.
sleep apnea syndromes;fatty liver;transaminases;meta-analysis;nonalcoholic fatty liver diseas;alanine transaminase;aspartate aminotransferase;sleep apnea hypopnea syndrome
R563
A
10.11958/j.issn.0253-9896.2015.09.032
天津市自然科学基金资助项目(11JCYBJC28300);天津市卫生局科技基金(2014KZ119);卫计委国家临床重点专科建设项目
天津医科大学总医院保健医疗部,天津市老年病学研究所(邮编300052)
王琳(1980),女,主治医师,硕士,主要从事老年病的研究
△通讯作者E-mail:tjltianjianli@126.com
