蜱RNA干扰的不同方法与应用*
2015-11-10周金林
崔 杰 周金林
(中国农业科学院上海兽医研究所,上海 200241)
蜱属于节肢动物门(Arthropoda)、蛛形纲(Arachnida)、蜱螨目(Acarina)、蜱总科(Ixodoidea),是常见的动物体表寄生虫之一,具有复杂的生活史和高繁殖率,是一种重要的疾病传播媒介,侵袭包括人在内多种宿主,广泛分布于世界各地(周金林, 2004)。现代蜱研究已从蜱生物学性状观察发展到分子生物学领域,其中,RNA干扰技术得到广泛应用。RNA干扰技术首先从秀丽线虫研究中发现,Fire等(1998)用纯化的双链RNA特异性降解目的基因转录序列,在对目的基因沉默表达分析过程中提出RNA干扰概念。自此,RNA干扰技术成为最有效基因功能研究工具之一,迅速拓展到虫媒研究领域。Aljamali等(2002)最早将RNA干扰技术应用于蜱研究,通过体外浸泡和体内注射双链RNA的方法,干扰美洲花蜱Amblyommaamericanum的组胺结合蛋白基因。蜱研究中实现RNA干扰的关键在于双链RNA的导入,已有多种RNA干扰方法得到成功应用,如显微注射法、浸泡法、饲喂法、病毒转染法和电转染法等。通过生物信息学技术结合蜱生理学指标变化对目的基因沉默效果进行评价与分析,人们发现了蜱体多种新型生物活性分子,这些物质在蜱抗凝血和免疫抑制等生理过程中发挥重要作用,在新医药生物制剂开发研制,蜱及蜱传疾病的防治等方面具有重要应用价值。本文就蜱RNA干扰方法及其适用性作一综述,为进一步研究提供参考。
1 蜱体RNA干扰机制
RNA干扰是在基因序列转录时产生特异性沉默表达的现象。在蜱体内,一段双链RNA进入蜱细胞后,经过一系列生化反应降解同源mRNA,调节相关编码基因不能表达(Kurscheidetal., 2009)。
RNA干扰的主要过程分为3个阶段:首先,双链RNA通过细胞表面进入蜱体细胞内,与双链RNA核酸内切酶(Dicer)特异性结合,被其中的RNase III成份切割成21~25 nt大小的小干扰RNA(siRNA)(Elbashiretal., 2001)。随后,形成的siRNA与一些酶蛋白家族成员结合,形成RNA诱导的沉默复合体(RISC),激活后的RISC核酸部分即siRNA,与目的mRNA同源,引导识别靶mRNA,蛋白部分从酶切位点开始对靶mRNA降解(Hannon, 2002)。同时,断裂的RNA小分子在核酸酶作用后经过核酸内切酶等作用又形成新的双链RNA,这些双链RNA又会被Dicer切割成siRNA,形成降解目的mRNA的循环(Yuetal., 2002)。
根据这一机制的理解,通过构建启动子的方法体外合成双链RNA,以实现RNA干扰实验(de la Fuenteetal., 2007)。值得注意的是,合成的双链RNA应具备一定的长度,研究表明,长链产生的干扰效果明显强于短链,有效干扰的长度范围应大于50~200 bp,现有文献中常用的双链RNA长度在134 ~1 842 bp之间(Scottetal., 2013)。
2 蜱研究中RNA干扰方法
在目前蜱研究中,RNA干扰方法主要分为5类,包括显微注射法、浸泡法、饲喂法、病毒转染法和电转染法等。这些方法均能够将体外双链RNA有效导入蜱体细胞中,但是根据不同的蜱种类与蜱体发育阶段这些方法效果不同,本文重点总结不同实验方法研究进展及其应用适用性,对各方法特点进行讨论。
2.1 显微注射法
指将蜱体外合成的双链RNA通过显微注射技术注入蜱体内的方法。使用的工具有汉密尔顿注射器、微量注射器及显微注射仪(de la Fuenteetal., 2006a; de la Fuenteetal., 2006b; de la Fuenteetal., 2007)。注射实验过程需要具备一定实验技能的人员在显微镜下操作。注射的部位可以是蜱特定器官组织,包括唾液腺、淋巴结、卵巢、肠道等,也可以直接从蜱腹侧右下第4基节处或蜱体气孔处注入(Nijhofetal., 2007)。注射剂量根据实验目的与实验对象的不同而改变。这种方法具有高通量特点,操作重复性好,可控制注入双链RNA剂量,成本较低,是实验前期探寻功能基因与相关分子的首选方法,广泛应用于蜱分子生物学研究。然而,实验人员的显微注射操作时间相对于其他方法较长,其中蜱的固定操作繁琐,须保证蜱的固定与活力,多方面的条件限制决定该方法应用于实验室分析阶段,难以满足应用于大量蜱的生产实践过程,使用的工具较为精密,需要专业人员操作。
目前,蜱相关功能基因分子研究中已对蜱成蜱阶段的显微注射进行了大量报道。该方法是探知目的基因功能的研究方法,Galay等(2013,2014)运用显微注射法对目的基因HIFER进行RNA干扰,发现目的基因蜱体储存铁质与保护蜱体铁蛋白功能。同时,此方法应用于对已知功能分子的功能验证与评测,Yu等(2013)发现镰形扇头蜱Rhipicephalushaemaphysaloides两种新的丝氨酸蛋白酶,运用显微注射法进行RNA干扰,测试抗凝血功能。值得注意的是,显微注射法在蜱疫苗靶抗原研究方面具有重要应用价值,Mulenga等(2013)通过该方法进行RNA干扰发现一组新的节肢动物蛋白AamAV422,作为普遍适用于多种类蜱多价疫苗候选分子。Bifano等(2014)对蜱胚胎细胞系BME26进行研究,在构建消减杂交文库后,针对蜱目的基因进行显微注射方法,实现RNA干扰,探究目的基因功能,分析得到功能基因组。
2.2 浸泡法
这种方法是在体外合成双链RNA,经过与一定的试剂相混合,直接浸泡蜱实验材料以实现RNA干扰。这些材料包括:蜱发育成熟前几个阶段的虫体(如蜱卵阶段、幼蜱阶段、若蜱阶段等),从蜱体分离处理得到的组织(如唾液腺)(Bowmanetal, 2004)以及体外培养而得的细胞系等(Barryetal., 2013)。与双链RNA相混合的试剂主要成分为转染试剂,其作用是包裹具有一定长度的双链RNA能够透过蜱角质板,从而使双链RNA渗透进入蜱体内发挥作用。
浸泡法操作简易,易于改变与控制浸泡变量,探索最佳实验条件,如蜱种类、浸泡时间、浸泡浓度等,以达到最佳干扰效果。能够应用于对大量虫体的浸泡过程,覆盖广泛,因其具有操作快捷便利特点而具有实践意义。但是,浸泡法消耗的双链RNA较多,材料成本高,浸泡之前试剂准备工作较为复杂。例如,将双链RNA导入虫体细胞时,需要测试选择不同的转染试剂,Whyard等(2009)将不同种类的的转染试剂应用于不同种类昆虫的RNA干扰浸泡实验,得出不同转染剂产生不同浸泡干扰效果的结论。这些已商品化应用于节肢动物的转染剂有Lipofectamine 2000、Cellfectin、DMRIE-C、Transfectin等,然而,这些转染试剂是否适用于蜱尚需进一步研究。
这种方法最早的报道是应用于蜱唾液腺体外浸泡实验,Aljamali等(2002,2003)等通过这种方法研究蜱体相关抗凝血蛋白分泌及相关功能基因。随后,浸泡法应用于蜱细胞系,de la Fuente等(2005,2006a)使用浸泡法浸泡蜱IDE8细胞,降低mRNA表达水平。如今,研究者们运用RNA干扰技术,通过对蜱体直接喷洒双链RNA,实现对虫体浸泡进行RNA干扰,以达到干扰蜱正常生活习性目的,即新型杀蜱剂。相对于传统杀蜱剂而言,这种以RNA干扰技术为原理的新型杀蜱剂更加具有生态环保意义,更加适宜于生态保护,避免虫体耐药问题。一方面,双链RNA做为有效成分可以直接对蜱体靶基因实现沉默,影响蜱正常生理指标,如抑制蜱对宿主的吸血能力,破坏对原有生活环境的适应能力等;另一方面,针对耐药基因进行干扰,结合传统化学杀蜱剂,在无毒或弱毒情况下实现最佳灭蜱效果。Duscher等(2014)将传统杀蜱剂氯菊酯成分与RNA干扰技术相结合,利用带有谷胱甘肽S-转移酶(GST)的双链RNA干扰方法研究菊酯杀蜱机制,浸泡后的蜱在犬体进行实验,结果显示,结合双链干扰后传统化学制剂用量大幅降低。
2.3 饲喂法
指将饲喂用导管工具从蜱口器部位插入或与口器部位紧密粘合,使双链RNA能够通过导管从蜱口器部位进入体内的方法。常用的导管工具包括3类:巴斯德管、毛细微管(Inokumaetal., 1998)、口器套管(Lew-Taboretal., 2014)。导管工具微管口大小应当与相应蜱种类的口器大小相当,使得蜱口器及触须与微管口紧密贴合,以保证体外双链RNA饲喂剂能够实现最大程度的导入。饲喂方法起初是针对于蜱体外吸血实验研究,即体外对蜱直接饲喂血液。如今,Lew-Tabor等(2014)通过在对蜱饲喂血液过程中加入双链RNA的方法,对蜱实现体外RNA干扰。当使用动物全血作为双链RNA载体时,需要加入抗凝剂,抗凝剂的不同产生的干扰效果也会出现不同,主要包括肝素、EDTA、柠檬酸钠等。饲喂法也可直接对虫体进行双链RNA饲喂,Soares等(2005)通过毛细小管对肩突硬蜱若蜱阶段直接进行双链RNA饲喂。
饲喂法的优点在于借助导管工具易于控制实验变量关系,例如双链RNA浓度,增添双链RNA剂量等,其操作灵活性较强,且成本相对较低,无需大量消耗双链RNA剂量。但是,运用饲喂法进行RNA干扰时,关键在于导管与蜱口器是否连接粘合完整以及体外环境下蜱饮食习性是否受到影响,并且目前饲喂方法的研究局限于单宿主半饱血蜱以及部分多宿主蜱的幼蜱若蜱阶段,成蜱阶段及不同种类的蜱有待于进一步研究。
这是目前一种较为理想的体外RNA干扰实验方法,运用饲喂法有助于研发新型的蜱疫苗和治疗药物,有效防控蜱传病。Inokuma等(1998)通过体外饲喂的方法研究蜱传巴贝斯虫传播机制。Soares等(2005)通过饲喂双链RNA,有效沉默ISAC目的基因,明显降低蜱吸血效果。通过饲喂法进行的RNA干扰实验的实验结果证明RNA干扰可以有效克服目前使用的化学杀蜱制剂污染环境缺陷。通过有效沉默功能基因、探寻保护性抗原等研究,能够加快研制出新型杀蜱制剂。Lew-Tabor等(2014)对微小扇头蜱使用含有双链RNA的血清进行饲喂,蜱产卵量与孵化率均有下降且宿主体内免疫球蛋白含量上升,运用饲喂法成功筛选和鉴定出蜱保护性抗原Bm86,为进一步疫苗研制打下基础。
2.4 病毒转染法
当某些病毒进入蜱体细胞时,会产生一定量的双链RNA,触发RNA干扰途径,根据这种现象而使用的RNA干扰方法称为病毒转染法。这种现象发现于多种虫媒性病毒中,主要包括登革热、黄热病毒、蜱传脑炎病毒等虫媒性病毒(Robyetal., 2014)。Garcia等(2006)使用重组森林脑炎病毒(SFV)诱导ISE6蜱细胞表达小干扰RNAs(siRNAs),从而实现基因沉默。这种方法更适用于探索发现新型蜱细胞生物分子,并以病毒转染过程为研究平台对分子机制过程加以研究,但因其病毒个体特异性差异,且无法控制和确定双链RNA剂量,实验重复性难以控制,因此不适用于实践应用。
在蜱研究中,利用能够感染蜱细胞的病毒作为载体侵染蜱体细胞,在细胞质中提供小干扰RNA成分以达到治疗目的(Usme-Ciroetal., 2013)。这种方法有助于构建蜱传病模型,通过病毒感染与转染,实现对疾病防控(Jaworskietal., 2013)。
2.5 电转染法
指使用电转技术,通过电压将蜱体外合成的双链RNA导入蜱体中,从而实现RNA干扰的方法。使用电转染方法时,对双链RNA提前使用荧光标记,导入后可从荧光显微镜中进行观察,直观、清晰展现出双链RNA导入后在细胞内降解mRNA变化过程。
这种方法是近几年新出现的方法,最早是由Karim等(2010)报道,将电转技术应用于蜱双链RNA传递过程。这种方法依赖于电转技术相关工具,如电转杯、电转缓冲液等,通过这些仪器的使用,使得实验过程电压强度与加压时间等变量条件的摸索变得简便。电转法具有高通量的特点,在电压作用下双链RNA导入耗费时间大大缩短,运用荧光素标记的方法对于RNA干扰机制的研究观察较为实用,具有较好的应用价值。然而,这种方法需要准备的双链RNA剂量较多,成本相对较高,研究者需要对电转技术有所了解。
目前这种方法的只应用于蜱卵、幼蜱和部分若蜱阶段,Karim等(2010)运用电转染的方法操作于蜱卵、幼虫、若虫阶段和成蜱唾液腺,有效抑制目的基因的表达。
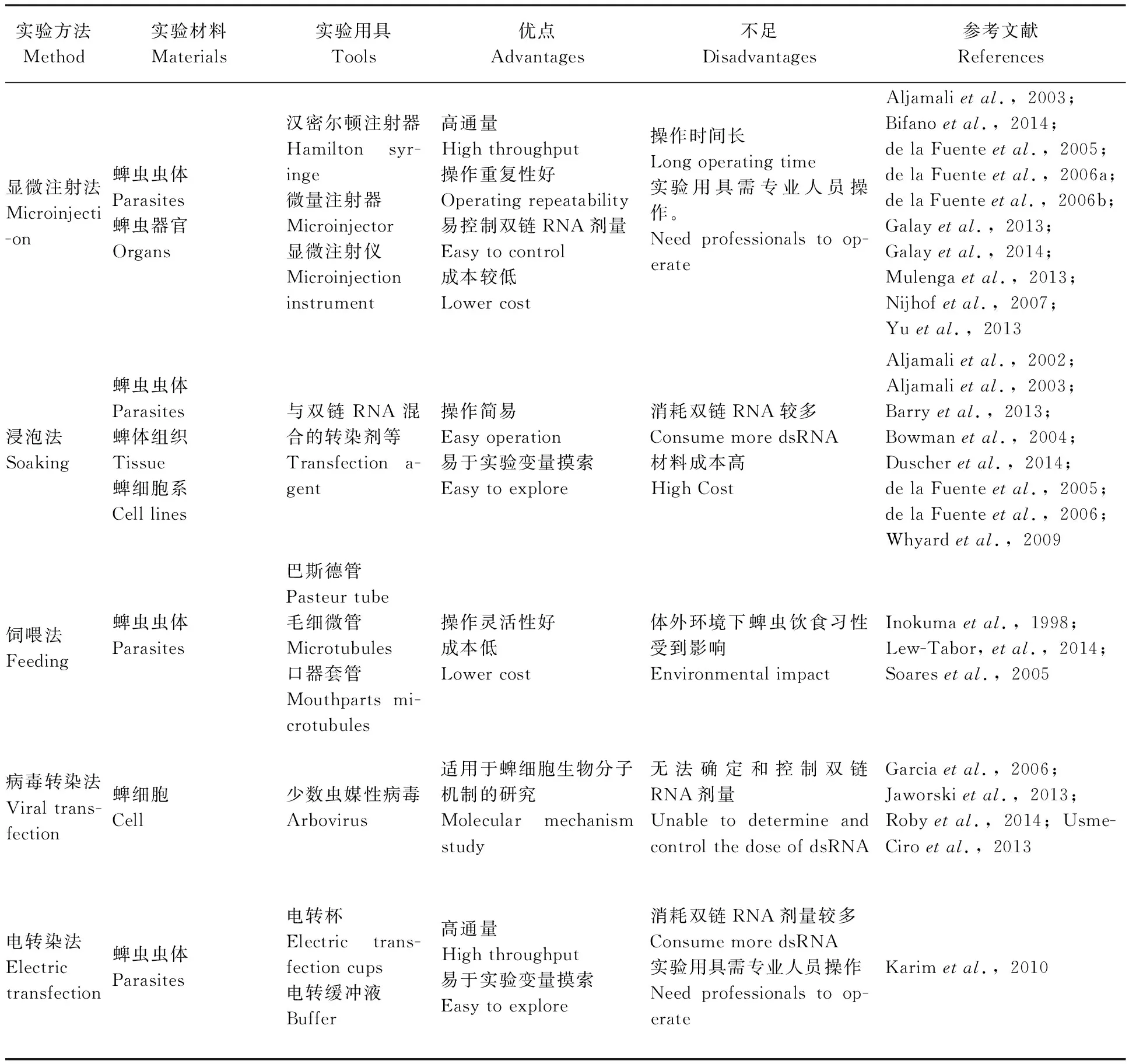
表1 目前蜱RNA干扰方法比较Tab.1 Methods to deliver dsRNA for RNA interference in ticks currently
3 结语
蜱作为重要的疫病传播媒介,越来越受到人们的关注,而RNA干扰技术无疑为蜱学研究提供了较为理想的途径,特别是在蜱基因功能研究、筛选和鉴定蜱的保护性抗原、蜱与蜱传病原相互作用和创制新型杀蜱剂等领域具有潜在应用价值(高晓等, 2010)。根据目前的研究成果,已证明多种RNA干扰方法能对蜱目的基因产生特异性沉默。但是,不同的RNA干扰方法有各自优点和缺点,应当根据实验设计合理选取,如浸泡法更适用于幼蜱若蜱阶段实验,转染更适用于蜱细胞系实验,显微注射法更适用于高通量实验等。RNA干扰技术应用日益成为蜱研究的热点,在干扰过程中,方法学的建立起到至关重要的作用,相信随着蜱RNA干扰研究的深入,现有的方法将会不断改善更加有助于RNA干扰实验研究,将会发现更多蜱功能分子,更详尽阐明蜱发育机制,更有效防控蜱传病,保护人畜健康,促进旅游业、畜牧业发展。
