黑龙江口岸斑点热群立克次体调查研究*
2015-11-10鞠文东付维明王延禄呼满霞梁慧杰王红霞
鞠文东 程 成** 付维明 王延禄 呼满霞 梁慧杰 王红霞 徐 宁 耿 聪
(1. 黑龙江国际旅行卫生保健中心,哈尔滨 150001;2. 绥芬河出入境检验检疫局,黑龙江绥芬河 157301;3.萝北出入境检验检疫局,黑龙江萝北 154201;4. 同江出入境检验检疫局,黑龙江同江 156401)
斑点热群立克次体(Spotted fever groupRickettsia, SFGR)是引起斑点热的一组病原体,可引起包括落矶山斑点热、钮扣热、北亚热、昆士兰斑点热、立克次体痘和日本红斑热在内的多种疾病(孙秀峰等,2007)。SFGR种类繁多,目前已确认10多种对人致病的立克次体(Steveetal., 2006),从最早发现的立氏立克次体,到后来逐渐发现的小蛛立克次体Rickettsiaakari、蒙他拿立克次体Rickettsiamontanensis和扇头蜱立克次体R.rhipicephali,目前已发现多种新型的病原体(范明远,2005),如日本立克次体R.japonica、黑龙江立克次体R.heilongjiangii、斯洛伐克立克次体R.slovaca、非洲立克次体R.africa、虎林立克次体R.hulinii以及最新发现的劳氏立克次体R.raoultii和新塔拉塞维奇立克次体CandidatusR.tarasevichiae。
现已证实SFGR是一组经蜱或螨叮咬传播的专性细胞内寄生菌,引起的斑点热属于自然疫源性特征的人兽共患疾病(Cameretal., 2003)。在野生动物、节肢动物与SFGR三者的生态循环中,蜱、螨既是重要的传播媒介又是立克次体的保菌宿主(叶晓东等,2008),尤其是黑龙江中俄口岸生物资源丰富,适合蜱类大量繁殖,具备蜱媒传染病的生态学与生物学基础(吴琼等,2012),所以能了解黑龙江口岸地区斑点热群立克次体在人群、鼠类、蜱类中的分布特征是有重要意义的。本研究针对黑龙江多个口岸,从口岸人群血液样本、鼠类样本、蜱类样本角度出发,在2014年4~7月份开展了针对斑点热群立克次体监测和实验室检测,现报告如下:
1 材料与方法
1.1 样本的采集
1.1.1人员样本的采集:(1)监测地区:东宁、牡丹江、同江、密山、萝北。(2)监测人群:从上述口岸入出境人员中选择如下重点人群:森林采伐、皮毛加工、畜牧业等行业从业人员;多次往返于中俄两国的劳务人员;有发热或其他疑似传染病症状者。以上人群填写流行病学调查表及知情同意书。(3)实验室处理:血液样本采用未使用抗生素的EDTA抗凝血,4 000 r/min离心5 min后,吸取血液白细胞层200 μL提取DNA(张丽娟,2005)。
1.1.2鼠类样本的采集:(1)监测地区:东宁、哈尔滨机场、嘉荫、虎林、密山。(2)实验室处理:选取鼠脾脏,低温研磨处理,吸取200 μL匀浆液备用。
1.1.3蜱类样本的采集:(1)监测地区:东宁、虎林、嘉荫、密山、绥芬河。(2)实验室处理:将蜱在液氮下研磨至粉末状,加入300 μL的生理盐水,吸取200 μL液体备用。
1.2 实验方法
1.2.1引物:引用斑点热群立克次体编码外膜蛋白 ompA 基因,引物名称为Rr190.70p,Rr190.602n,目前该引物因其扩增的基因序列片段具有良好的特异性,同时能够对其进行分类。该引物已较为广泛用于斑点热群立克次体感染的实验室诊断与调查研究(Regneryetal.,1991)。
1.2.2DNA提取:吸附柱法,将200 μL实验样本按照细菌基因组DNA提取试剂盒说明书进行操作。
1.2.3PCR扩增及测序:PCR反应体系:总体积为25 μL,去离子水18.5 μL,10×PCR缓冲液2.5 μL,2.5 mmol/L的dNTP 0.5 μL,Taq DNA聚合酶0.2 μL,10 mmol/L上下游引物各0.5 μL,样本DNA 2 μL;PCR扩增条件为95 ℃预变性5 min; 95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,38个循环; 最后72 ℃延伸7 min。取PCR产物5 μL,用1.5 %的琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像仪观察结果。鉴定确定后,经PCR产物进行回收与纯化,送与生物公司测序。所测序列与NCBI网上序列进行同源行比较,以确定所测菌液的种型。
2 结果
2.1 监测结果
2.1.1人群监测结果:将此次口岸重点监测人群针对年龄、性别、职业进行了细化(表1)。从年龄上看,以中年人群为主,其中年龄在41~60岁的人群比例最高,为67.44 %;性别上以男性为主,占比90.69 %;职业上,农民群体占比为92.55 %。其中部分人群有蜱叮咬史。

表1 不同口岸的人群分布特征
续表1Tab.lContinued
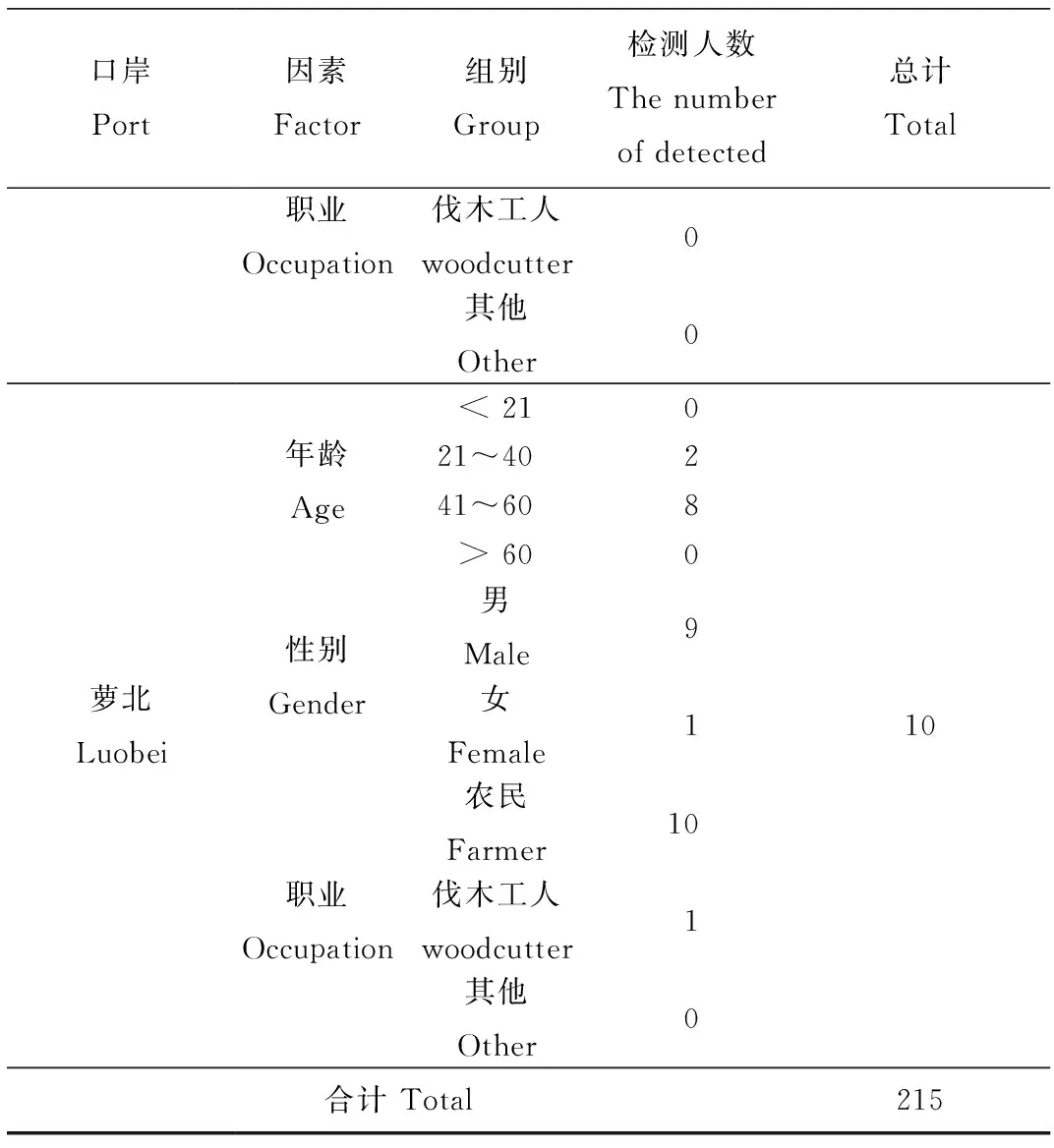
口岸Port因素Factor组别Group检测人数The number of detected总计Total职业Occupation伐木工人woodcutter0其他Other0萝北Luobei年龄Age性别Gender职业Occupation< 21021~40241~608> 600男Male9女Female1农民Farmer10伐木工人woodcutter1其他Other010合计 Total215
2.1.2鼠类监测结果:本次调查各口岸共捕获鼠类动物204只,经鉴定隶属于3科8属10种,名录如下:
鼠科 Muridae
鼠属RattusFischer,1803
褐家鼠Rattusnorvegicus(Berkenhout,1769)
小家鼠属MusLinnaeus,1758
小家鼠MusmusculusLinnaeus,1758
姬鼠属ApodemusKaup,1829
黑线姬鼠Apodemusagrarius(Pallas,1771)
大林姬鼠Apodemusspeciosus(Temminck,1845)
仓鼠科 Cricetidae
仓鼠属CricetulusMine-Edwards,1867
大仓鼠Cricetulustriton(de Winton,1899)
田鼠属Microtus(Schrant,1798)
东方田鼠Microtusfortis(Buchner,1889)
松鼠科 Sciuridae
花鼠属Eutamias(Trouessont,1880)
花鼠Eutamiassibiricus(Laxmann,1769)
黄鼠属Citellus(Curier,1825)
达乌尔黄鼠Citellusdauricus(Brand,1844)
从各口岸鼠的监测结果可以看出,黑线姬鼠为优势鼠种,其次为褐家鼠,其中除哈尔滨机场,黑线姬鼠在各口岸的监测比例均超过50%,占捕鼠总数的52.94%。(表2)
2.1.3蜱类监测结果:本次调查各口岸共捕获蜱188只,共4种,分别是森林革蜱Dermacentorsilvarum、全沟硬蜱Ixodespersulcatus、嗜群血蜱Haemaphysalisconcinna、日本血蜱Hae.japonica。从表3可以看出,每个口岸的优势蜱种并不相同,这可能与地区分布和时间有关。
2.2 SFGR检测结果
2.2.1人群中SFGR检测结果:经实验室检测,在所调查的口岸出入境人员中,并未检出斑点热群立克次体感染者。
2.2.2鼠类中SFGR检测结果:在哈尔滨太平国际机场、嘉荫两个口岸捕获的鼠脾脏样本中分别检出斑点热群立克次体,经测序鉴定比对后发现,两例阳性样本与劳氏立克次体MDJ4株(GenBank;JX885458)同源性最高(99.16 %~ 99.79%),动物宿主分别是大仓鼠和小家鼠。这是首次在黑龙江口岸鼠类中检测出R.raoultii。(表4)
2.2.3蜱类中SFGR检测结果:本研究在所检测的188份样本中,共检测出斑点热群立克次体的阳性样本101例,感染率高达53.7 %,经测序鉴定比对后,与劳氏立克次体 Dsm2 株(KF003015)同源性最高(98.57 %~ 99.59 %),确定R.raoultii89例;与新塔拉塞维奇立克次体C3H3株(KF008252)同源性最高(96.65 %~ 99.79 %),确定C.R.tarasevichiae11例;与黑龙江立克次体 054株(CP002912)同源性最高达99.79 %,确定R.heilongjiangii1例。森林革蜱是感染劳氏立克次体的优势蜱种,而在全沟硬蜱中检测出的C.R.tarasevichiae,这也是在黑龙江口岸地区首次在全沟硬蜱中检测出C.R.tarasevichiae。(表4、5)
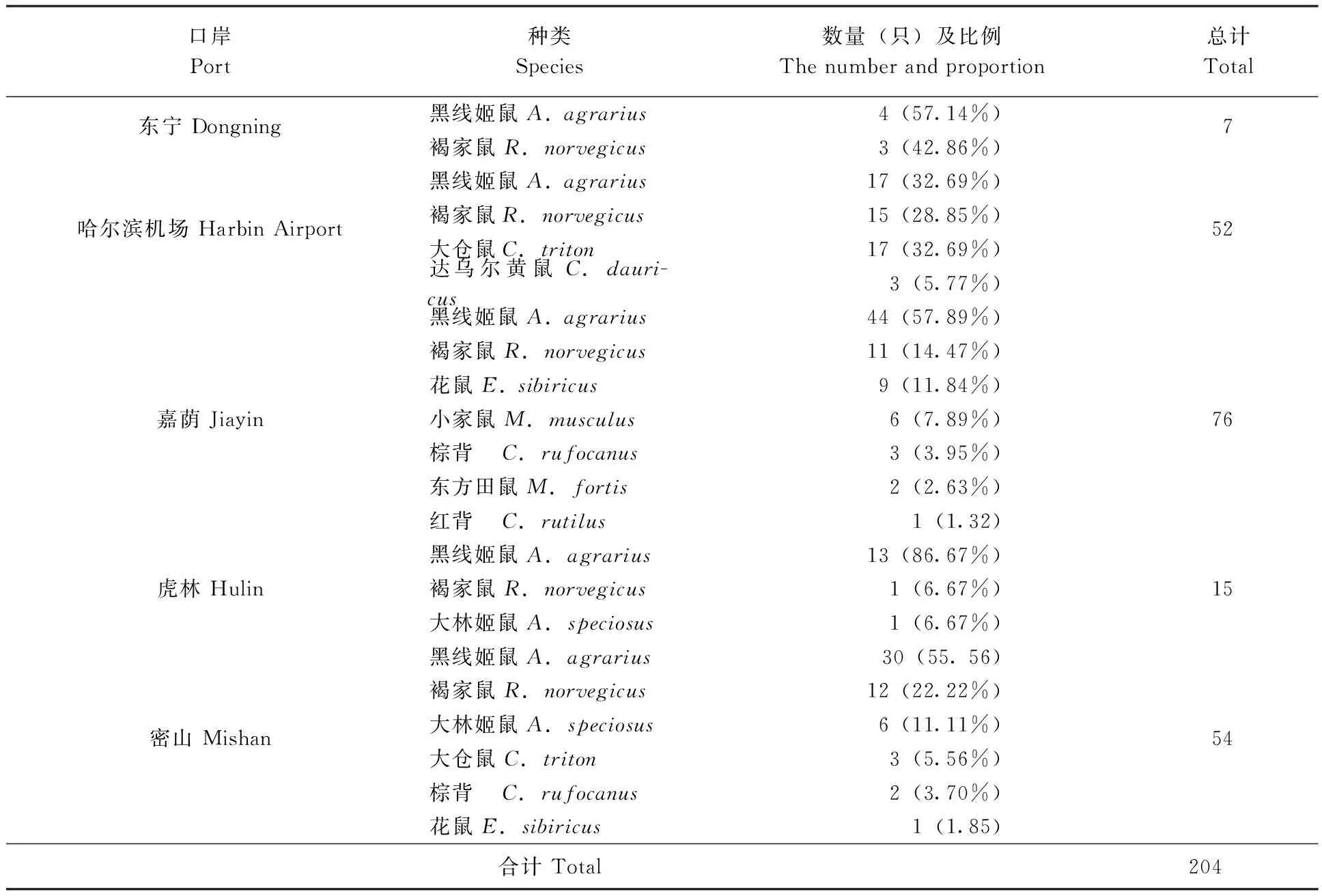
表2 不同口岸鼠分布特征Tab.2 Rodents collected in different ports
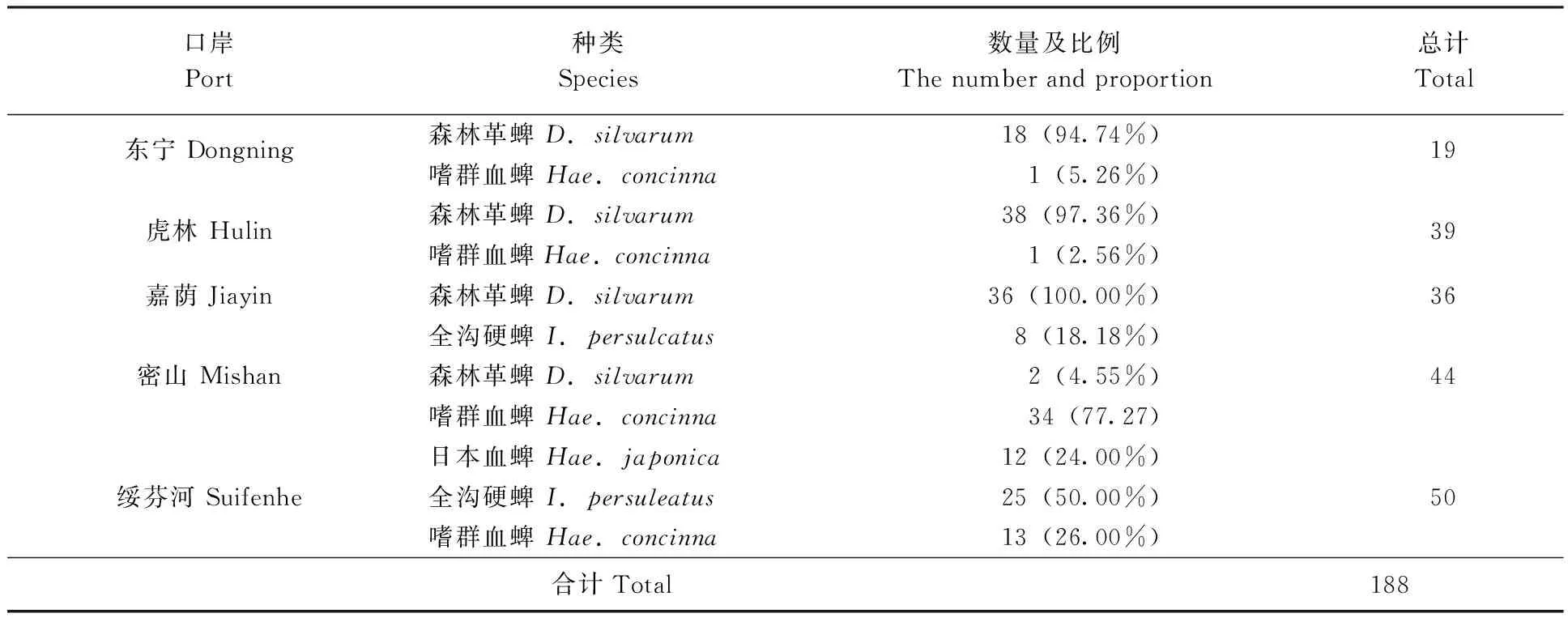
表3 不同口岸蜱分布特征Tab.3 Ticks distribution of different ports
3 结论
人感染SFGR的典型的临床症状出现在蜱叮咬后的6~10 d,并伴有发热、头痛、肌肉酸痛等临床症状(Brouquietal., 2004),但人感染SFGR的报道并不多见,2013年10月,曹务春等在中国东北地区251例因蜱虫叮咬患者中检测到新型立克次体C.R.tarasevichiae,引起了黑龙江口岸一线人员对出入境人员可能存在SFGR感染的高度关注(Jiaetal., 2013)。此次在215份出入境人群血液样本中未检出SFGR感染阳性样本,分析原因,其一为样本绝对数目较少;其二为本实验未应用血清样本检测,对于无临床症状的人群采用全血检测可能敏感性不高,下一步应完善血清检测结果,与全血检测结果形成对比,对人群感染性分析更为准确;其三为按照预设目标获得的样本多数为农民劳务群体,大多无发热、皮疹等临床症状,该类人群虽然存在蜱叮咬可能,但几率较低。对于林业从业人员等暴露风险较大的重点出入境人群,由于受到俄罗斯近年来相关政策原因,造成近期经黑龙江各口岸出入境的相关人群数量锐减,本次研究获得该类人群的数量更少。
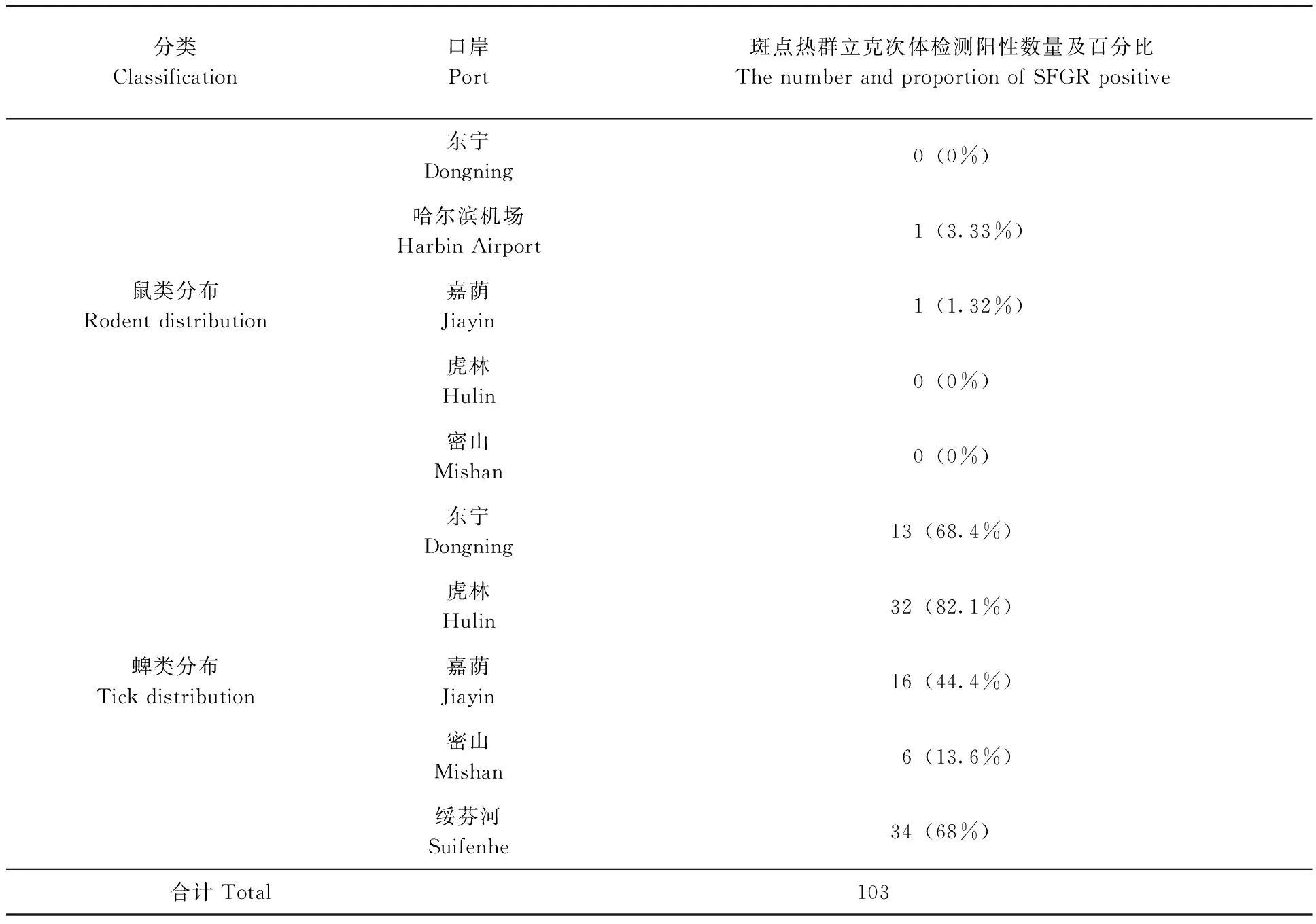
表4 斑点热群立克次体检测结果Tab.4 Detection results of spotted fever group rickettsia
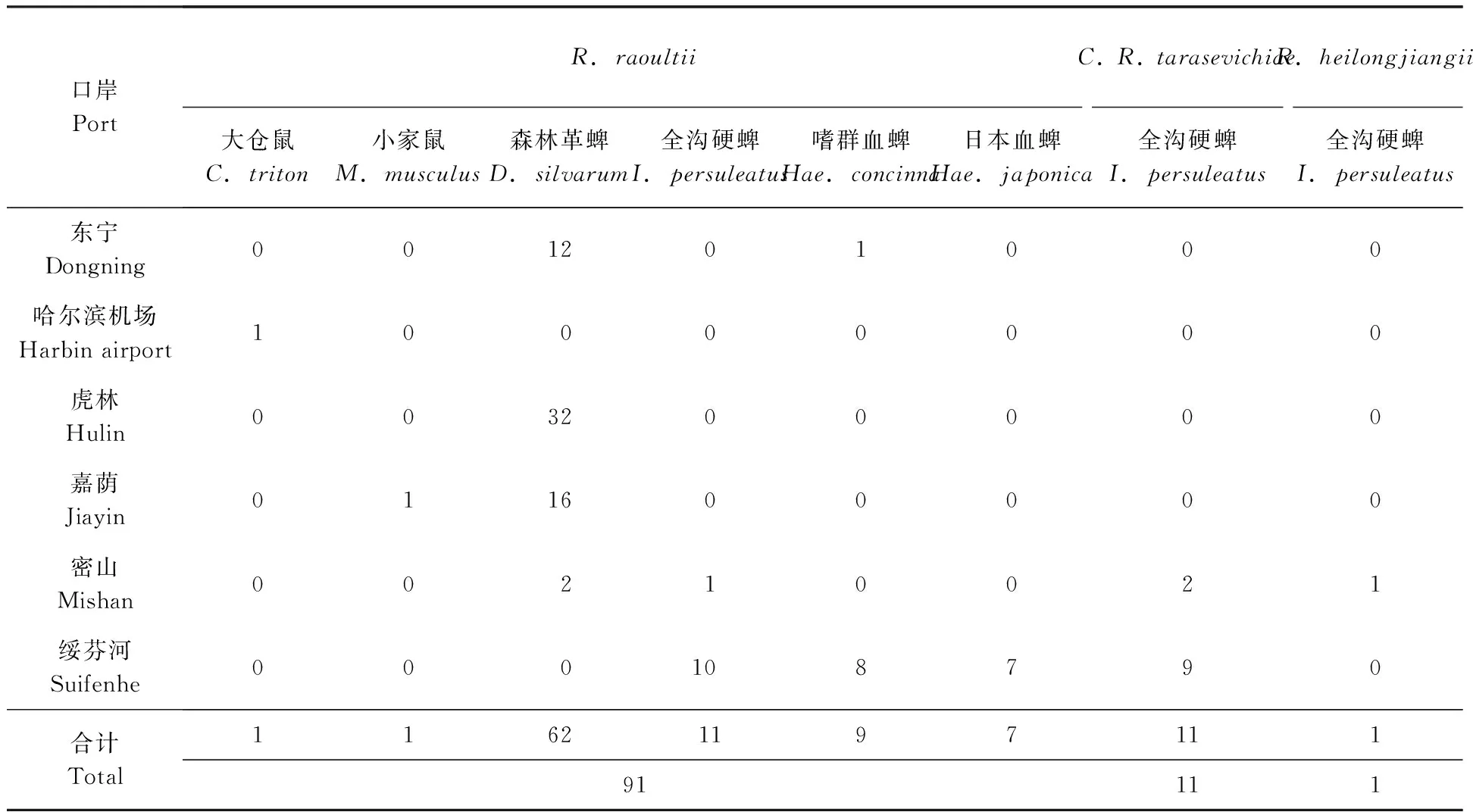
表5 斑点热群立克次体分型结果Tab.5 Genotyping results of spotted fever group rickettsia
2007年黑龙江口岸对SFGR感染调查时发现北亚蜱疹伤寒R.sibirica在蜱中感染率最高,其次是黑龙江立克次体R.heilongjiangii和虎林立克次体R.hulinii(孙秀锋等,2007),相对于2007年的调查,本年度的调查发生了巨大变化,劳氏立克次体作为新型SFGR的普遍存在于蜱中,根据此次调查,劳氏立克次体总感染率达到47.34 %(89/188),新塔拉塞维奇立克次体感染率为5.85 %(11/188),而黑龙江立克次体感染率仅为0.53 %(1/188)。这种明显的的变化和劳氏立克次体的高感染率值得口岸一线人员的重点关注。
调查数据显示,森林革蜱感染劳氏立克次体的感染率为65.96 %、全沟硬蜱感染率为33.3 %、嗜群血蜱感染率为18.4 %、日本血蜱感染率为58.3 %,学者在对黑河地区劳氏立克次体检测时发现,森林革蜱感染率最高可达97 %(Wenetal., 2014),并可通过经卵和经期传播,在体内可维持4~7代(Samoylenkoetal., 2009)。结合本次黑龙江中俄其他口岸,我们分析可能是森林革蜱对劳氏立克次体有较高的感染性和病原保存性。
本研究首次在黑龙江口岸地区鼠类的脾脏中检出劳氏立克次体,分别是在大仓鼠和小家鼠的脾脏中检出,感染率为1.00 %(2/204)。1999年,劳氏立克次体首次在西伯利亚的草原革蜱中分离(Rydkinaetal., 1999),2002年,劳氏立克次体又在一名被蜱虫叮咬的法国患者中分离(Mediannikovetal., 2008),劳氏立克次体作为一种新型SFGR逐渐受到研究者的关注。蜱虫在生长发育的过程中,其作为一种SFGR的传播媒介,每一次蜕化通常需要饱血于啮齿动物、野兔或鼠兔(Wenetal., 2014),因此鼠作为易感宿主,同样参与了SFGR的生态循环,本文印证了这一推论。
本研究在黑龙江口岸地区全沟硬蜱中首次检测到新塔拉塞维奇立克次体。据报道新塔拉塞维奇立克次体对人群存在致病性,而且临床症状与其他斑点热群立克次体感染者有所不同,感染患者不会出现任何皮肤斑点,但蜱虫叮咬处会出现焦痂和淋巴结肿痛等临床表现,更严重者会出现严重的中枢神经系统症状和脑膜刺激征,最终死于肾功能衰竭和呼吸性酸中毒(Jiaetal., 2013),提示该种新病原体可引起与已知蜱传斑点热不同的临床症状。劳氏立克次体和塔氏立克次体在黑龙江口岸地区的发现是蜱媒病的防治和口岸卫生监测检验的新挑战。建立敏感的检测技术形成有效的监测体系对于维护口岸生物安全,保障人民健康具有重要的作用。
