柱前衍生-高效液相色谱法检测食品中的黄曲霉毒素B1、B2、G1、G2
2015-11-05胡晓科孙丹红
胡晓科,孙丹红,文 君
(成都市疾病预防控制中心,四川成都610041)
柱前衍生-高效液相色谱法检测食品中的黄曲霉毒素B1、B2、G1、G2
胡晓科,孙丹红,文君
(成都市疾病预防控制中心,四川成都610041)
目的:改进柱前衍生-高效液相色谱法测定食品中的黄曲霉毒素B1、B2、G1、G2。方法:分别用甲醇-水(8∶2,v∶v)或二氯甲烷提取食品中的黄曲霉毒素。提取液经免疫亲和柱净化后,采用三氟乙酸(或甲酸)进行衍生,并利用高效液相色谱仪进行测定。结果:黄曲霉毒素B1、B2、G1、G2的检出限分别为0.2、0.2、0.2、0.2μg/kg;在低、中、高加标浓度下的回收率分别为81.0%~94.1%、75.6%~92.0%、75.0%~92.4%、77.6%~91.3%。结论:改进后的柱前衍生-高效液相色谱法克服了样品基质的干扰,测定结果更准确。
食品,黄曲霉毒素,免疫亲和柱,柱前衍生,高效液相色谱法
黄曲霉毒素(AFT)具有较强的毒性和致癌性,世界卫生组织(WHO)推荐食品、饲料中AFT的最高允许量标准为15μg/kg。我国目前只有B1的允许量标准颁布实施,其中玉米、花生及其制品中最高允许量为20μg/kg;豆类、调味品及婴幼儿食品等为0.5~5μg/kg[1]。
目前,我国食品中黄曲霉毒素B1、B2、G1、G2的国家标准检测方法主要有薄层色谱法[2]和高效液相色谱法(HPLC)[3-5]。其中,HPLC法准确、灵敏,被广泛采用,而薄层色谱法灵敏度差、精确度低。液相色谱串联质谱法也有较多研究[6-8],但所需设备价格昂贵,不易普及。其他检测黄曲霉毒素的方法,如酶联免疫吸附法[9-10]、荧光光度法[4,11],只能测定其总量。
HPLC法检测B1和G1时,需衍生提高其荧光强度。三氟乙酸柱前衍生法的准确性和重现性通过了确证[12-13]。碘衍生、光化学衍生等柱后衍生[14-15]法虽然可以实现衍生和检测同步,但需要另外配备衍生设备;另外,衍生池增加了柱后死体积,容易造成色谱峰展宽[16]。Waltking等也发现,在检测玉米中的B1、G1时,不同的柱后衍生结果偏差较大[17]。
柱前衍生-HPLC法检测食品中的黄曲霉毒素B1、B2、G1、G2对仪器硬件的要求较低、测定结果偏差小,但往往存在较大的基体干扰,尤其是花椒、茶叶等。为了进一步提高方法的准确性,扩大样品适用性,本文改进了样品前处理方法,包括提取溶剂、净化方法等,克服了基质干扰,获得了更为准确、可靠的检测结果。发现甲酸与三氟乙酸的衍生效果相当,可避免使用强挥发性试剂。通过各项技术指标的检验,证明本方法灵敏度高、准确性好、重现性强。
1 材料与方法
1.1材料与仪器
乙腈、甲醇色谱纯;黄曲霉毒素总量免疫亲和柱ROMER,AflaStarTMR;真菌毒素多功能净化柱ROMER,MycosepTM226;黄曲霉毒素B1、B2、G1、G2标准中国农业部环境保护科研监督所;花生中黄曲霉毒素B1、B2、G1、G2质控样FAPAS T04233QC。
Agilent 1200高效液相色谱仪美国;SUPELCO固相萃取装置美国;PCJ超纯水仪成都品成科技公司;MTN-5800氮吹仪天津奥特赛恩斯公司。
1.2标准溶液的配制
准确吸取黄曲霉毒素标准贮备液(B1:2.0μg/mL;G1:2.0μg/mL;B2:2.0μg/mL;G2:2.0μg/mL)各0、10、15、20、25、50、100、150、250μL,用乙腈稀释定容至5.0mL。
准确移取标准系列浓度的溶液各0.3mL,60℃氮气吹干后,加入100μL三氟乙酸、200μL正己烷,封口后于烘箱中40℃衍生30min,40℃氮气吹干,准确加入0.3mL乙腈-水溶液(2∶8,v∶v)溶解,过0.45μm滤膜后供HPLC测定。
1.3色谱条件
色谱柱:AgilentZORBAXEclipseXDB-C18(4.6mm×250mm,5μm)column;荧光检测器:激发波长360nm、发射波长460nm;柱温35℃;进样量:20μL;流动相:A:水,B:乙腈,流速为1.0mL/min,梯度洗脱变化见表1。
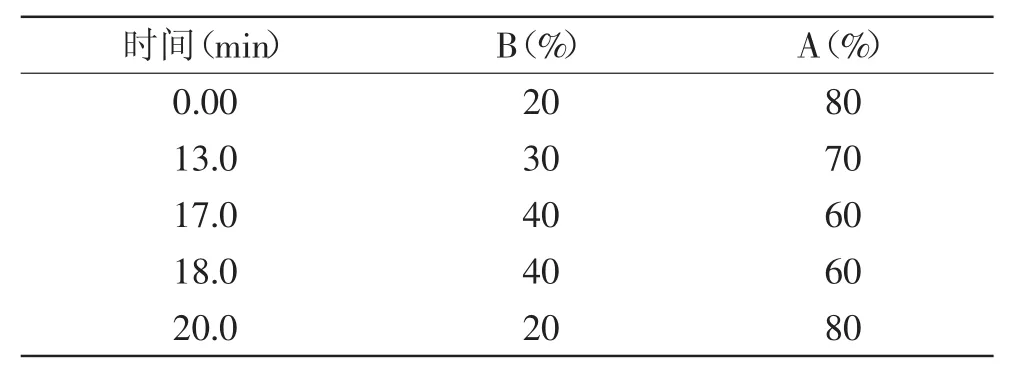
表1 流动相的梯度洗脱表Table 1 Gradient timetable
1.4样品预处理
1.4.1花生、玉米、黄豆等固体样品磨细(粒度小于2mm)、混匀,在105℃烘干至恒重;液体样品则摇匀后直接取用。称取20.0g样品于250mL具塞锥形瓶中,加入5.0g氯化钠及100mL甲醇-水溶液(8∶2,v∶v),震摇萃取30min。过滤,准确移取10mL滤液,加入30mL水稀释,用玻璃纤维滤纸过滤至滤液澄清,备用。
1.4.2茶叶、花椒等准确称取10.0g经磨细和烘干的样品(粒度小于2mm),加入50mL二氯甲烷萃取,准确移取5mL萃取液,挥干溶剂后,剩余物用5mL甲醇溶解,再加入15mL水稀释,备用。
将免疫亲和柱(IAC)连接注射器及带真空系统的固相萃取装置。调节压力使上述滤液以约6mL/min流速缓慢通过免疫亲和柱,用10mL水淋洗柱子2次,弃去淋洗液,直至2~3mL空气通过柱体。用2mL甲醇分两次洗脱,收集洗脱液60℃氮气吹干。加入100μL三氟乙酸及200μL正己烷,封口后于烘箱中40℃衍生30min,40℃氮气吹干,准确加入0.3mL乙腈-水溶液(2∶8,v∶v)溶解,过0.45μm滤膜后供HPLC测定。
2 结果与分析
2.1方法线性及检出限
按1.2中所配制的黄曲霉毒素B1、B2、G1、G2标准浓度系列,分别进样,其中每个浓度点至少测定三次,检测结果取其平均值。测定结果表明,各标准物质的浓度与色谱峰峰面积呈良好的线性关系,相关系数大于0.998。以基线噪声的3倍所相当的标准物浓度为仪器检出限,并根据样品前处理过程分别计算各物质的最低检测浓度,结果为B10.2μg/kg、G10.2μg/kg、B20.2μg/kg、G20.2μg/kg。
2.2准确度和重复性实验
取同一批花生中黄曲霉毒素B1、B2、G1、G2的质控样品(FAPAS T04233QC)6份进行测定,考察方法的准确性和重复性。如表2所示,B1、B2、G1、G2的测定结果均在定值的范围内,可见本方法具有良好的准确性。6次重复实验的相对标准偏差(RSD)为11.8%,说明虽然经过了提取、净化、衍生、氮吹等较复杂的前处理过程,本方法仍然具有良好的重复性。
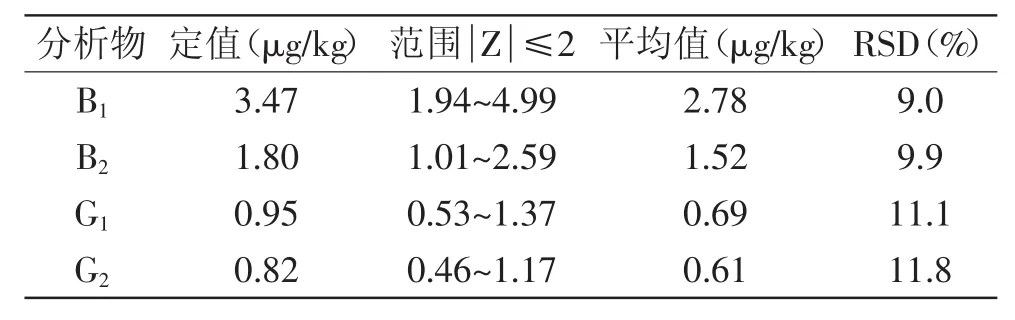
表2 质控样品重复测定结果(n=6)Table 2 Reproducibility of the measured results for QC(n=6)
2.3加样回收实验和精密度测定结果
取花生、花椒等不同类食品,分别按低、中、高浓度加入黄曲霉毒素B1、B2、G1、G2标准,按照1.4中样品预处理方法对待测物进行提取、净化和衍生,经高效液相色谱仪分析、定量,计算出各食品中黄曲霉毒素B1、B2、G1、G2的加样回收率,结果见表3。尽管在所测样品中均未检出相应的待测物,但加标浓度在0.5~5.0μg/kg时,B1、B2、G1、G2的回收率分别为81.0%~94.1%、75.6%~92.0%、75.0%~92.4%、77.6%~91.3%。说明本方法在检测不同类食品中的黄曲霉毒素B1、B2、G1、G2时具有良好的准确性。连续6次的测定结果显示,B1、B2、G1、G2的相对标准偏差(RSD)分别为3.2%~5.1%、3.2%~5.8%、3.5%~5.7%、3.2%~5.8%。
2.4前处理方法对检测结果的影响
2.4.1净化方法的对比在分析食品中的黄曲霉毒素B1、B2、G1、G2时,专用黄曲霉毒素分离纯化的多功能净化柱(MFC)、免疫亲和柱(IAC)被广泛应用。其中,MFC能吸附蛋白质、脂肪等大分子杂质,已被GB/T 5009.23-2006和AOAC 994.08采用,适用基质为玉米、花生、坚果等;IAC与目标毒素形成抗原-抗体,能够特异性吸附提取液中的AFT,同时实现样品的富集和净化。目前市场化的IAC仅适合乙腈-水或甲醇-水提取溶液净化,且有机相的比例不能过高,否则会抑制抗体的特异反应性。
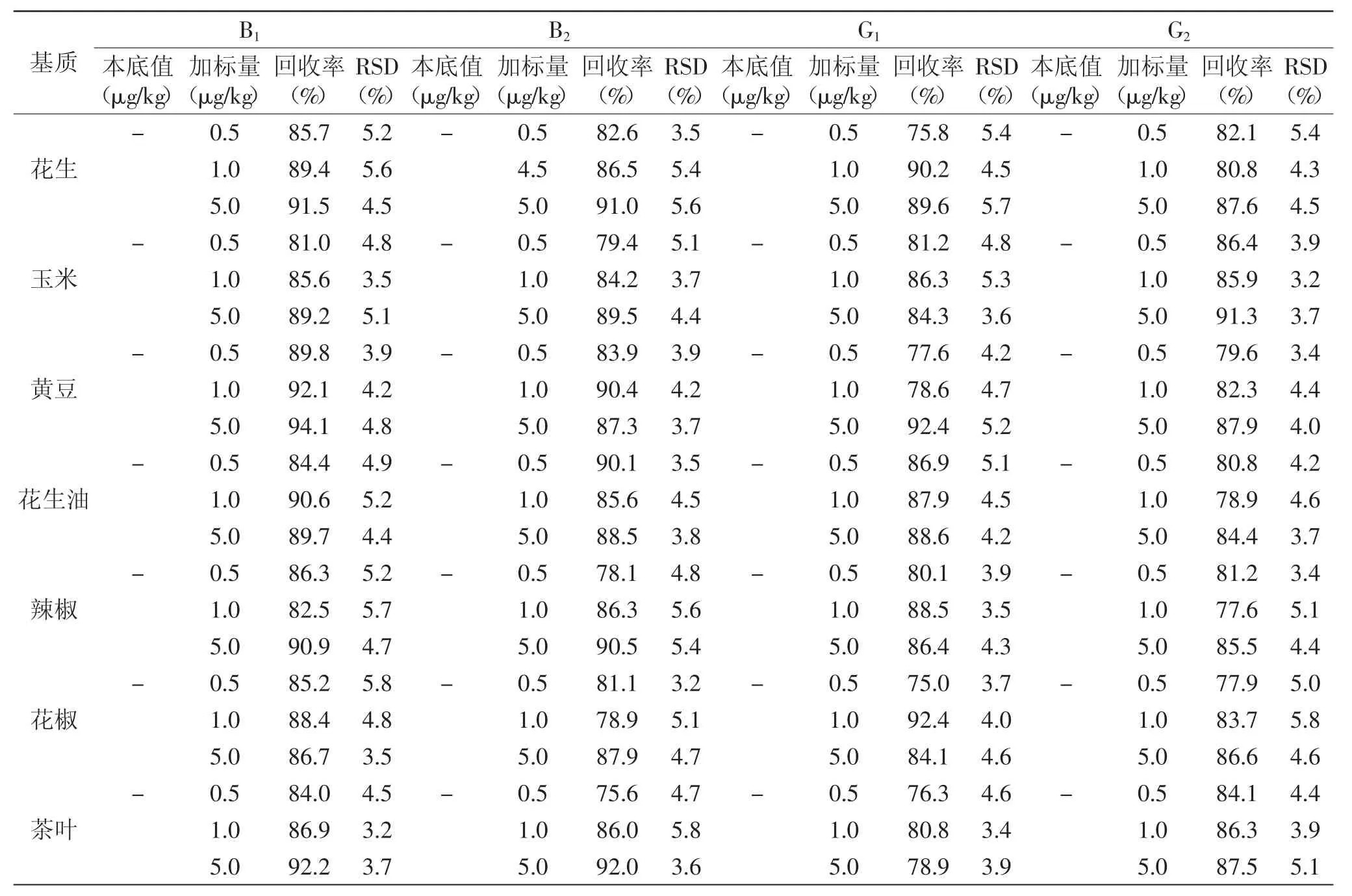
表3 黄曲霉毒素B1、B2、G1、G2的加标回收率和精密度测定结果(n=6)Table 3 Recovery factors and relative standard deviation of aflatoxin B1、B2、G1、G2(RSD,n=6)
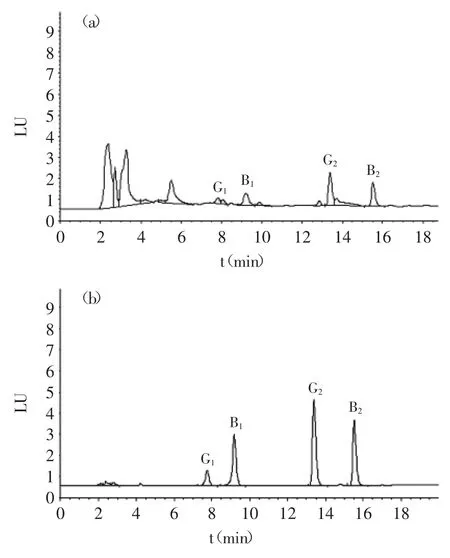
图1 加标花生样品中黄曲霉毒素B1,B2,G1,G2的液相色谱图Fig.1 Chromatograms of peanut sample with aflatoxin standards
通过比较MFC和IAC的净化效果发现:两者对玉米、黄豆、花生等坚果、花生油均能起到净化的作用,但后者的净化效果更好。以花生为例,图1(a)、图1(b)分别是经MFC、IAC净化的加标样品色谱图。比较二者可以看出,经MFC净化的样品仍含有一定量的杂质,造成色谱图的基线抬高;而经IAC净化的样品则很干净。从回收率来看,经IAC净化的B1、B2、G1、G2回收率也更高。另一方面,对于茶叶、花椒等样品,MFC几乎起不到净化的效果。
杂质净化不彻底一方面会对色谱柱、检测器造成污染,降低检测灵敏度和精密度;另一方面还会影响检测结果的定性,造成假阳性并最终影响结果的准确性。因此,净化样品提取液,适宜用净化效果更佳的免疫亲和柱(IAC)。
2.4.2提取溶剂的比较由于黄曲霉毒素难溶于水,而易溶于甲醇、乙腈、氯仿等有机溶剂,因此,一般用含高浓度有机相的水溶液,如乙腈或甲醇-水溶液来提取样品中的黄曲霉毒素[18-20]。在实际检测过程中,用甲醇(或乙腈)-水溶液(v∶v=8∶2)提取玉米、黄豆、花生类坚果、植物油、辣椒等食品中的黄曲霉毒素,提取液经过免疫亲和柱的净化后,基本能够消除共提物中基质的干扰。但是,用上述提取液处理茶叶、花椒时,却存在较大的基质干扰。以加标的茶叶为例,如图2(a)所示,存在较多与待测物保留时间接近的杂质,即使改变色谱条件也很难将其分开。同时,杂质也极大地影响了对待测物的回收,B1、B2、G1、G2的回收率均降至40%以下。如果改用二氯甲烷(CH2Cl2)提取,则能很好地消除基质的干扰。如图2(b)所示,即使不用免疫亲和柱净化提取液,也只在G1的色谱峰附近有杂质干扰。如果要完全去除,则需要在前处理过程中进一步增加净化步骤。具体方法为:蒸干提取液中的CH2Cl2,用甲醇溶解残渣,加水稀释后,再通过免疫亲和柱净化。用该方法测定茶叶、花椒等食品中的黄曲霉毒素B1、B2、G1、G2,回收率均在75%以上。
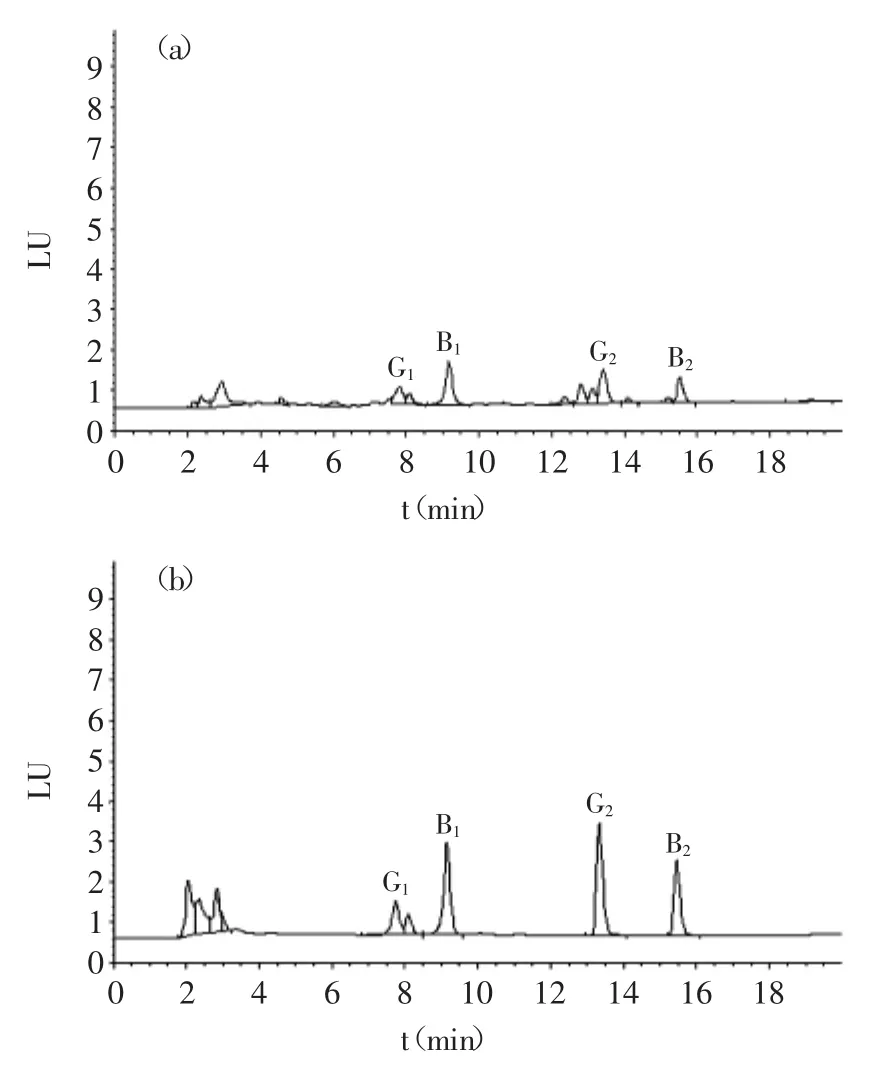
图2 加标茶叶中黄曲霉毒素B1,B2,G1,G2的液相色谱图Fig.2 Chromatograms of tea sample with aflatoxin B1,B2,G1,G2standards
2.4.3衍生条件对检测结果的影响取黄曲霉毒素B1、B2、G1、G2浓度均为20ng/mL的混合标准溶液,按照三氟乙酸衍生过程,分别在25(室温)、40、50、60℃下衍生15、30min。结果见表4,表明:衍生温度为25(室温)、40℃时,B1、B2、G1、G2的定量结果一致;同时,衍生15min和30min没有明显的区别。但是,当衍生温度为50℃或更高时,B1、B2、G1、G2的定量结果反而降低。推测原因是温度高于50℃时,三氟乙酸和正己烷携带待测物挥发造成损失。
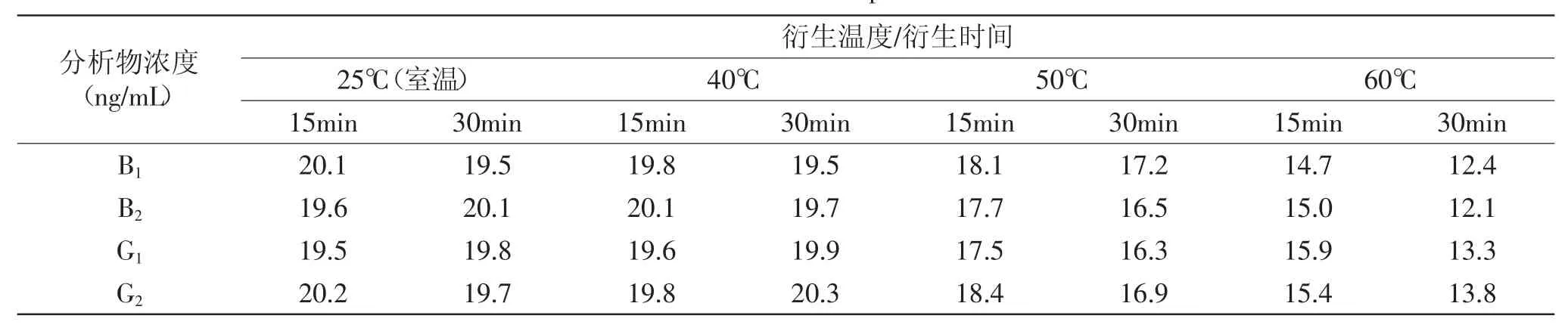
表4 衍生温度和时间的影响Table 4 Derivation results at different temperature in 15 or 30 minutes
三氟乙酸是一种强挥发性的酸,在使用过程中可能对操作者造成身体的损伤,同时对环境也不利,可以考虑用其他相对安全的有机酸,如甲酸、乙酸代替。实验结果表明,当保持其他衍生条件不变时,等量的甲酸与三氟乙酸的衍生效果相当;相反,乙酸并不能有效地增强B1、G1的荧光强度。
3 结论
柱前衍生-高效液相色谱(HPLC)法测定食品中的黄曲霉毒素B1、B2、G1、G2时,容易受到复杂样品基质的干扰。免疫亲和柱(IAC)对提取液的净化效果优于多功能净化柱(MFC)。用二氯甲烷提取茶叶、花椒类食品中的黄曲霉毒素B1、B2、G1、G2,共提物中的干扰杂质大大减少。在相同的衍生条件下,甲酸可以代替三氟乙酸起到同样的衍生效果。改进后的柱前衍生-HPLC法根据样品特点,采用不同的前处理方法,既克服了样品基质的干扰,保证了检测结果的准确性,又能减少有毒、有害试剂的使用。该方法灵敏度高,准确性、重现性好,实用性强。
[1]食品中真菌霉毒素限量.GB 2761-2011[S].北京:中国标准出版社,2011.
[2]中国预防医学科学院营养与食品卫生研究所.GB/T 5009.23-2006食品中黄曲霉毒素B1、B2、G1、G2的测定第一法薄层色谱法[S].北京:中国标准出版社,2012.
[3]中国疾病预防控制中心营养与食品安全所.GB/T 5009.23-2006食品中黄曲霉毒素B1、B2、G1、G2的测定第三法高效液相色谱法[S].北京:中国标准出版社,2012.
[4]北京市产品质量监督检验所.GB/T 18979-2003食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法和荧光光度法[S].北京:中国标准出版社,2003.
[5]中华人民共和国秦皇岛出入境检验检疫局.GB/T 23212-2008牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2的测定液相色谱-荧光检测法[S].北京:中国标准出版社,2009.
[6]宫小明,任一平,董静,等.超高效液相色谱串联质谱法测定花生、粮油中18种真菌毒素[J].分析测试学报,2011,30(1):6-12.
[7]曹娅,孙利,王明林,等.粮谷中8种痕量真菌毒素的定量分析方法[J].分析测试学报,2013,32(2):150-155.
[8]朱聪英,应永飞,韦敏钰.液相色谱-串联质谱法测定饲料中黄曲霉毒素的研究[J].质谱学报,2010,31(4):240-246.
[9]卫生部食品卫生监督检验所、北京市营养源研究所.GB/T 5009.22-2003食品中黄曲霉毒素B1的测定第二法[S].北京:中国标准出版社,2012.
[10]李军,于一茫,田苗,等.免疫亲和柱净化-柱后光化学衍生-高效液相色谱法同时检测粮谷中的黄曲霉毒素、玉米赤霉烯酮和赭曲霉毒素A[J].色谱,2006,24(6):581-584.
[11]褚庆华,徐超一,刘岩,等.免疫亲和柱-荧光分析法测定鲜乳和乳粉中的AFM1[J].检验检疫科学,2003,13(2):41-43.
[12]王阳,曹忠波.柱前衍生高效液相色谱法测定食品中黄曲霉毒素B1、B2、G1、G2[J].中国卫生检验杂志,2011,21(2):344-345.
[13]KOLOSOVA A Y,SHIM W B,YANG Z Y,et al.Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B1.Stabilization of ELISA kit components and application to grain samples[J].Anal Bioanal Chem,2006,384(1):286-294.
[14]毕瑞锋,赫秀萍.高效液相色谱法检测食品中黄曲霉毒素研究进展[J].粮食与油脂,2012(3):1-4.
[15]吴燕,朱怡平,汪国权.多功能柱净化-光化学柱后衍生测定食品中黄曲霉毒素[J].中国卫生检验杂志,2011,21(8):1865-1869.
[16]陈瑞春,段文仲,吕红英,等.免疫亲和层析净化-高效液相色谱法同时测定牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2[J].食品科技,2011,36(8):300-304.
[17]WALTKING A E,WILSON D.Liquid chromatographic analysisofaflatoxinusingpost-columnphotochemical derivatization:collaborative study[J].J AO AC Int,2006,89(3):678-692.
[18]谢刚,王松雪,张艳.超高效液相色谱法快速检测粮食中黄曲霉毒素的含量[J].分析化学研究报告,2013,41(2):223-228.
[19]彭志兵,章烜,蒋建云.液液萃取-高效液相色谱法测定粮食中黄曲霉毒素的研究[J].粮食科技与经济,2013,38(1):26-29.
[20]赵浩军,王坤,杨卫花,等.高效液相色谱柱后光化学反应-荧光检测茶叶中黄曲霉毒素B1[J].茶叶科学,2013,33(3):237-241.
Determination of aflatoxins B1,B2,G1,and G2in foods by high performance liquid chromatography with pre-column derivation
HU Xiao-ke,SUN Dan-hong,WEN Jun
(Chengdu Center for Disease Control and Prevention,Chengdu 610041,China)
The method was improved to determine aflatoxins B1,B2,G1,G2in foods by high performance liquid chromatograph with pre-column derivation.Samples were extracted by methanol-water solution(8∶2,v∶v)or dichloromethane according to the different food types.The extracts were cleaned up by immunoaffinity column. After derivation by CF3COOH or HCOOH,the determination of aflatoxins was performed by high performance liquid chromatography with a fluorescence detector.The detection limits of aflatoxins B1,B2,G1,G2were 0.2,0.2,0.2 and 0.2μg/kg respectively.The recoveries at different level spiked ranged from 75.0%to 94.1%. The improved method was more accurate for different foods by overcoming the matrix disturbance.
foods;aflatoxins;immunoaffinity column;pre-column derivatization;high performance liquid chromatography
TS207.3
A
1002-0306(2015)12-0049-05
10.13386/j.issn1002-0306.2015.12.001
2014-09-11
胡晓科(1976-),女,博士,主管技师,研究方向:食品卫生理化检验。
