新疆双峰驼乳清蛋白组分对人宫颈癌HeLa细胞增殖的抑制作用∗
2015-11-02杨洁王红娟豆智华李冠
杨洁,王红娟,豆智华,李冠
(新疆大学 生命科学与技术学院,新疆 乌鲁木齐830046)
双峰驼是新疆特色产乳家畜之一,已经形成一定的养殖规模,其乳制品的品种与产量逐年增加.中国是世界双峰驼主要分布国家之一,存栏量约50万峰以上,主要分布在新疆、内蒙古、甘肃、青海等省区约110万平方公里的干旱荒漠草原上;从分布的数量来看,新疆占全国总数的52%左右.中国的双峰驼主要有新疆驼(XinJiang camel)、内蒙古阿拉善驼(Alxa camel)和内蒙古苏尼特驼(Sunite camel)三个优良种群.与牛乳相比,骆驼乳及其发酵制品是最有营养价值的乳品之一,具有独特的营养成分,骆驼乳的氨基酸质量水平高于FAO/WHO/UNU对氨基酸的要求,并富含多不饱和脂肪酸,可广泛用于治疗包括胃溃疡、腹泻、糖尿病、肺结核、贫血、营养不良、慢性肝炎等在内的许多疾病[1−3].
骆驼乳白色,不透明,有甜味或者咸味,是由于骆驼在沙漠中摄食的植物不同而造成的.新鲜骆驼乳的pH值为6.5∼6.7,总固形物含量略低于牛乳.主要成分为:蛋白质3.1±0.5%,脂肪3.5±1.0%,乳糖4.4±0.7%,灰分0.79±0.07%,总固形物11.9±1.5%[4].蛋白质是骆驼乳中重要的营养物质,主要包括酪蛋白和乳清蛋白两大类.乳清蛋白中含有大量生物活性蛋白,如免疫球蛋白、α-乳白蛋白、乳过氧化物酶、溶菌酶和乳铁蛋白等,还有一些其他与生物功能相关的蛋白质.与牛乳相比,骆驼乳中乳清蛋白含量高,乳糖含量低,缺少β-乳球蛋白,营养成分非常接近人乳[5,6].因此,骆驼乳可以作为对牛乳蛋白质过敏婴幼儿,以及乳糖不耐症患者的食物蛋白质来源[7,8].有研究显示,骆驼乳对酒精诱导的肝损伤小鼠具有治疗或保护作用;可抑制模型鼠血清脂质过氧化,诱导肝损伤细胞的凋亡;对慢性肾功能衰竭大鼠的病情有缓解作用,对糖尿病大鼠具有辅助治疗的效果[9−12].近几年,关于驼乳的防癌抗癌作用也有了初步研究,王初一、郭建功等发现苏尼特双峰驼鲜驼乳与其自然发酵乳对小鼠H22肝癌肿瘤细胞的生长有一定的抑制作用,对小鼠H22肝癌肿瘤组织的PCNA表达有下调作用,并具有增强肿瘤小鼠免疫功能的作用[13,14].
目前,国内外对驼乳辅助治疗肿瘤方面的研究极为有限,对驼乳抗肿瘤的分子机制研究未见报道.前期研究中我们发现,驼乳对食管癌及其他多种肿瘤细胞的增殖有明显的抑制作用;利用蛋白质分离手段结合抑癌活性追踪筛选的方法,我们从驼乳清蛋白中分离出具有抑癌活性的蛋白质组分TR35.为此,本实验旨在观察驼乳抑癌活性的组分TR35对人宫颈癌HeLa细胞的增殖、凋亡的影响,探讨其作用机制,为驼乳资源的合理利用提供理论基础.
1 材料和方法
1.1 样品与试剂
驼乳样品采自新疆乌鲁木齐市鸿雁池、乌拉泊等地牧民在半荒漠草地散养的新疆双峰驼.样品采集后立即置于冰盒中带回实验室,分离得TR35组分,冻干,-20◦C储藏备用.
人宫颈癌Hela细胞株(由新疆大学新疆生物资源基因工程重点实验室提供).DMEM的培养基(Gibco公司),胎牛血清(Gibco公司),噻唑蓝(MTT)和二甲基甲砜(DMSO)为Sigma公司产品,胰蛋白酶(Trypsin),(NH4)2SO4,NaCl,NaH2PO4,Na2HPO4,HCl,NaOH等均为国产分析纯.Hochest33258,Annexin VFITC细胞凋亡检测试剂盒,碘化丙啶染色液(PI)检测试剂盒购自江苏碧云天试剂有限公司.
1.2 仪器
FACS Calibur流式细胞分析仪(美国BD公司);Benchmark Plus酶标仪(中国上海);H-600透射电子显微镜(日本日立公司);LEO1430VP扫描电子显微镜(德国LEO公司);Heal Force Neofuge 13R台式高速冷冻离心机(香港力康发展有限公司).
1.3 细胞培养
人宫颈癌HeLa细胞用含10%胎牛血清的DMEM培养基培养.培养环境为37◦C、CO2体积分数为5%的饱和湿度培养箱,每2~3 d传代1次,取对数生长期的细胞进行实验.
1.4 MTT法测定驼乳清蛋白TR35对肿瘤细胞增殖的抑制作用
取对数生长期的Hela细胞,胰酶消化后,计数,使悬液细胞数达到5×104/mL,接种于96孔培养板,每孔100µL细胞悬液,置CO2培养箱中过夜培养.待细胞完全贴壁后,每孔加入200µL终浓度为8、4、2、1、0.5 mg/mL的TR35,阳性对照药物5-氟尿嘧啶20µg/mL,于37◦C、5%CO2饱和湿度分别培养24、48和72 h.然后每孔加入MTT溶液(5 mg/mL)20µL,继续温育4 h,终止培养,弃孔内上清液,每孔加入150µL DMSO,震荡10 min,使结晶充分溶解.酶标仪测定490 nm波长吸光度值(OD),计算细胞增殖抑制率,按公式:
抑制率%=[1-(实验组OD值-空白组OD值)/(阴性对照细胞OD值-空白组)]×100%
半数抑制浓度IC50的测定:IC50的测定方法同MTT实验相同,将样品连续倍比稀释后,测定每个浓度对细胞的抑制率,根据样品浓度与抑制率的反应曲线,用作图法求出半数抑制浓度(IC50).
1.5 细胞形态的显微观察
1.5.1 细胞显微形态观察
取对数生长期的Hela细胞,胰酶消化后,计数,使悬液细胞数达到5×104/mL,接种于96孔培养板,每孔100µL细胞悬液,置CO2培养箱中过夜培养.待细胞完全贴壁后,每孔加入200µL终浓度为2、1、0.5 mg/mL的TR35,阳性对照药物为5-氟尿嘧啶20µg/mL,于37◦C、5%CO2饱和湿度培养24 h后在倒置差相显微镜下观察细胞显微形态.
1.5.2 Hoechst33258染色观察细胞凋亡形态
收集处理24 h后Hela细胞,吸尽培养液,加入0.5 mL的固定液(甲醇:冰乙酸=3:1)固定15 min.去固定液,用PBS洗两遍(每次3 min)去除液体,加入0.5 mL Hochest 33258染色液,避光染色5 min,晃动数次,荧光显微镜下观察.
1.6 细胞超显微形态观察
1.6.1 扫描电镜观察细胞外部形态
收集处理24 h后Hela细胞放入2.5%戊二醛中,CO2临界点干燥,粘贴样品,离子溅射镀膜,扫描电子显微镜下观察.
1.6.2 透射电镜观察细胞亚显微结构
收集处理24 h后Hela细胞放入2.5%戊二醛中,用1%的锇酸固定,常规乙醇脱水包埋,超薄切片,醋酸钠和柠檬酸铅双重染色后透射电镜观察.
1.7 Annenxin V/PI双染色法检测细胞凋亡
将Hela细胞接种于六孔板内.细胞数量1×105/mL,每孔2 mL.置于CO2培养箱中过夜培养.待细胞完全贴壁后,每孔加入不同浓度的TR35.每个梯度设三个复孔,每孔终体积为2 mL.作用24 h后,PBS洗涤2次,收集细胞约1×106/mL,1 000×g离心2 min,PBS 3 mL,洗涤2次,1 000 r/min离心2 min,弃上清,3 mL PBS混匀,400目尼龙网过滤,1 000 r/min离心2 min,弃上清.将细胞悬于500µL Binding buffer中,混匀后加入5µL Annenxin V-FITC和10µL PI,混匀后室温避光15 min,转入流式管后上流式细胞仪(FCM)检测,计数2∼3万个细胞.
1.8 PI单染测定细胞周期
收集处理24 h后Hela细胞,加入冰预冷无水乙醇固定,4◦C过夜.离心弃去固定液,1 mL PBS重悬,1 000 r/min离心5 min,弃上清.用1 mL PI染液染色,室温避光孵育30 min,流式细胞仪检测.
1.9 线粒体膜电位检测
收集处理24 h后的Hela细胞,PBS洗涤,重悬于0.5 mL细胞培养液中.加入0.5 mL JC-1染色工作液混匀.37◦C孵育20 min.离心弃上清,用JC-1染色缓冲液(1×)洗涤2次:弃上清.再用适量JC-1染色缓冲液(1×)重悬后,细胞用流式细胞仪分析.
1.10 统计学处理
采用GraphPad Prism 4.0统计软件对数据进行分析.所有实验重复3次,统计数据以x±s表示,计量资料进行t检验,计数资料进行方差分析,P<0.01为差异有显著的统计学意义.
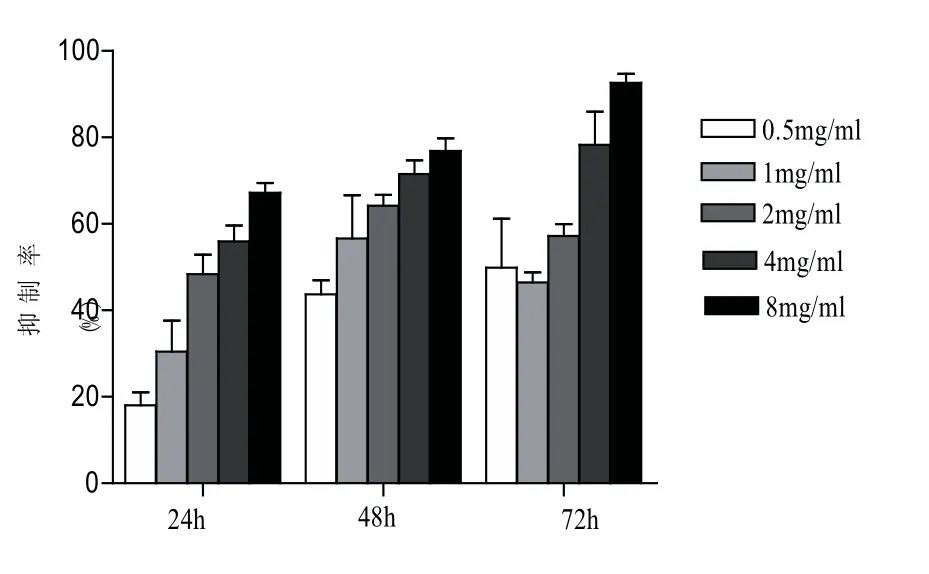
图1 驼乳清蛋白组分TR35对Hela细胞的抑制作用(24 h)(p<0.01)
2 结果
2.1 驼乳清蛋白组分TR35对Hela细胞增殖的抑制作用
分别以不同浓度的驼乳清蛋白组分TR35处理HeLa细胞,分别于24、48和72 h后用MTT实验检测其对细胞增殖作用的影响.结果显示,TR35对Hela细胞的增殖有抑制作用,其半数抑制浓度IC50为0.064 mg/mL;随着作用时间的延长和浓度的增加,TR35对HeLa细胞增殖的抑制作用明显增加,且呈时间和剂量依赖关系,结果见图1.
2.2 驼乳清蛋白组分TR35对Hela细胞形态的影响
2.2.1 倒置显微镜观察细胞形态
驼乳清蛋白组分TR35处理Hela细胞24 h后,采用倒置相差显微镜观察其显微.阴性对照组中,Hela细胞贴壁生长,呈梭形或多边形,融合成片,细胞透亮,胞体肥厚,细胞间相互连接,边界清晰.在0.5 mg/mL的TR35作用下,细胞密度略有减少,细胞形态也有微小变化;随着蛋白浓度增加至1 mg/mL,细胞体积渐缩小,细胞形态发生明显变化,细胞表面渐凸起小膜泡,边界不清晰,折光性增强,脱壁细胞逐渐增多;当浓度达到2 mg/mL时,大部分细胞漂浮在培养基中,贴壁的细胞形态明显变化,基本已看不清细胞原来的形态.由图2可以看出,驼乳清蛋白TR35对Hela细胞显微形态有显著的影响.
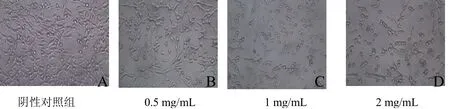
图2 驼乳清蛋白组分TR35对Hela细胞形态的影响24h(×200)
2.2.2 TR35-50诱导Hela细胞凋亡形态观察
用Hoechst 33258对经驼乳清有效蛋白组分对Hela细胞作用24 h后染色观察,正常细胞呈正常形态,可以看到细胞质的延伸,细胞均匀分布,经驼乳清组分TR35诱导后,细胞聚集成团,染色质高度凝集,有凋亡小体出现,显示出细胞凋亡的特征,见图3.
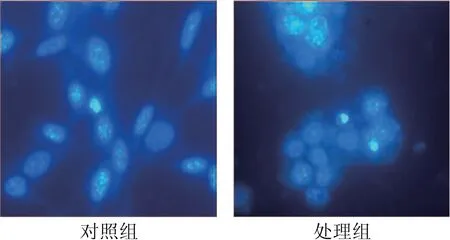
图3 驼乳清蛋白组分TR35诱导Hela细胞凋亡形态(×200)
2.3 驼乳清组分TR35对Hela细胞外部形态的影响
扫描电镜观察TR35组分对Hela细胞外部形态的影响.由图4可知,阴性对照组细胞表面有丰富的微绒毛,规则排列,细胞间镶嵌连接,细胞膜完整,且细胞体积较大.当TR35组分处理时,细胞微绒逐渐消失,细胞间连接逐渐疏松,细胞胞体固缩,甚至裂解开有内容物溢出.
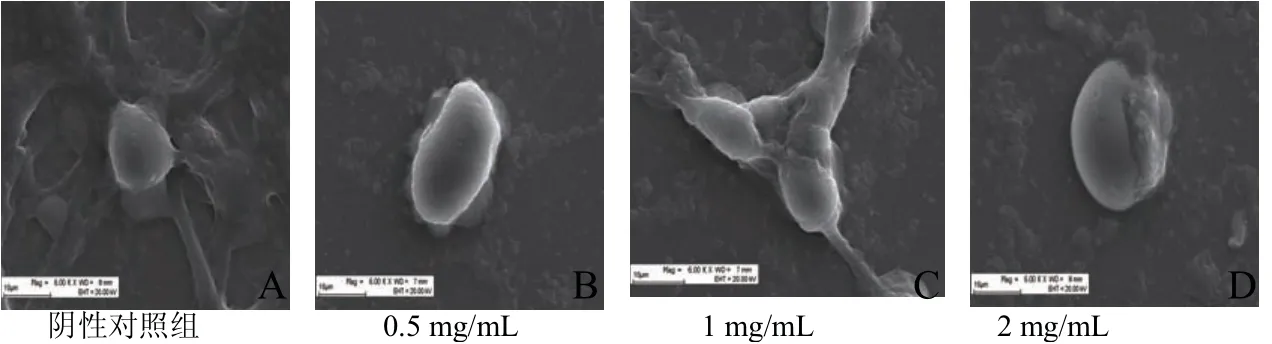
图4 扫描电镜观察驼乳清蛋白组分TR35对Hela细胞外部形态的影响
2.4 驼乳清组分TR35对Hela细胞亚显微结构的影响
透射电镜观察TR35组分对细胞亚显微结构形态的影响,由图5可以看出,阴性对照组细胞呈圆形,细胞质均匀,细胞器形态完整,体积较大,细胞核异染色质呈斑点状均匀分布,线粒体嵴清晰;随着驼乳清有效组分TR35浓度的增加,细胞的细胞质均变得疏松,细胞核内染色质出现边聚现象,细胞核碎裂,核固缩,线粒体空泡化,嵴脱落或消失,并有次级溶酶体出现,细胞膜局部破损,细胞内容物泄出的现象.
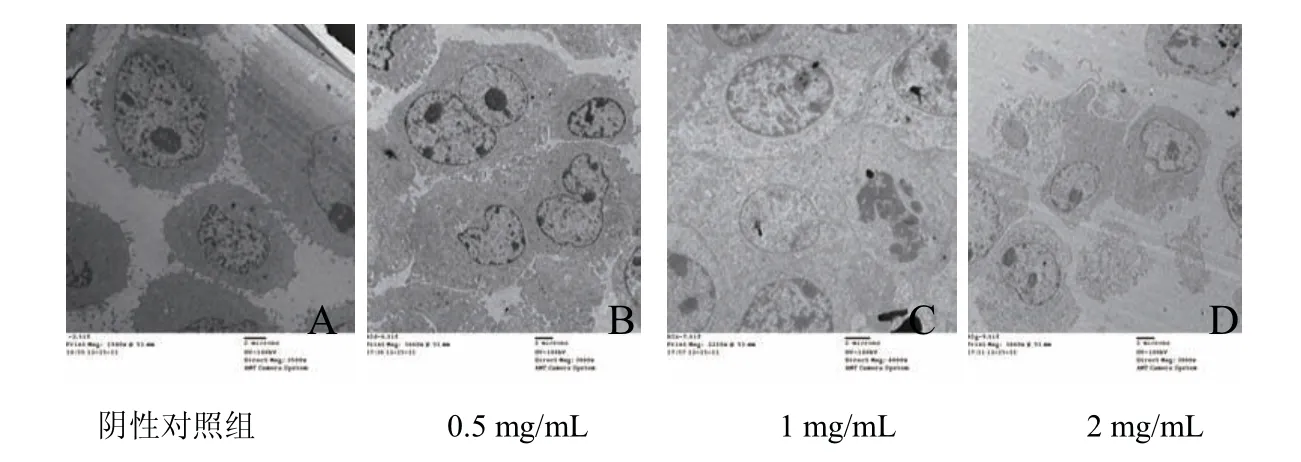
图5 透射电镜观察驼乳清有效蛋白组分作用Hela细胞后细胞凋亡形态
通过光镜和电镜形态学观察可见用TR35处理组有较多的肿瘤细胞凋亡的现象.电镜下肿瘤细胞形态呈典型的凋亡细胞特征表现,如细胞核染色质浓缩边聚、胞质浓缩、核碎裂以及凋亡小体形成,目前电镜形态学观察被认为是证实凋亡的最可靠方法,且与Hoechst33258荧光染色观察结果一致.
2.5 Annenxin V/PI双染色法检测细胞凋亡
不同浓度TR35组分处理Hela细胞24 h后,早期凋亡的细胞数相对对照组细胞数由2.7%分别增加到11.70%、32.1%和58.8%.正常细胞的细胞数相对于对照组细胞数96.0%分别减少到83.9%、63.5%和32.8%,结果见图6.
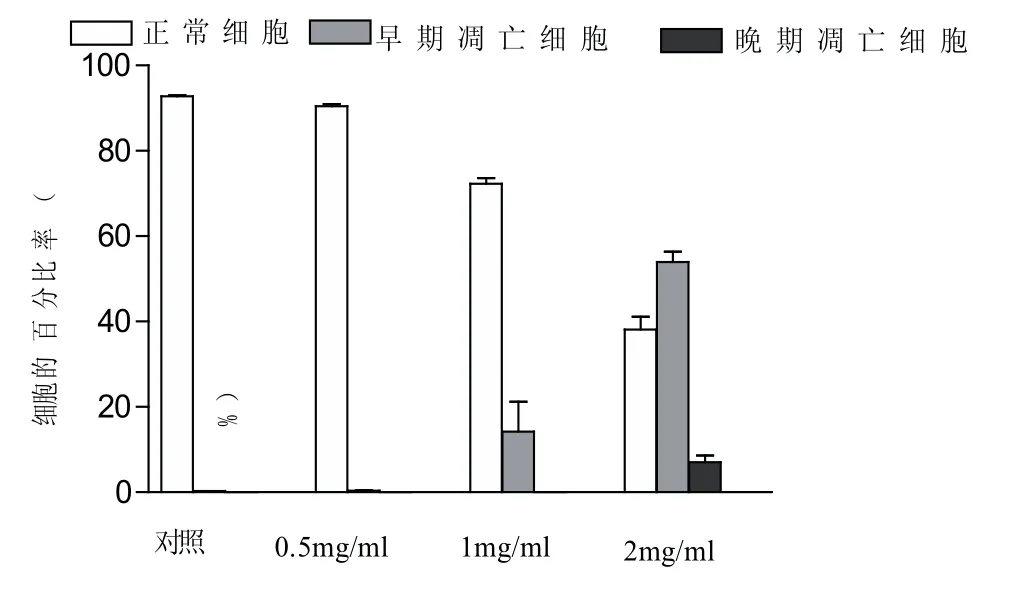
图6 流式细胞术检测驼乳清蛋白组分TR35对Hela细胞凋亡的影响(24 h)
晚期凋亡和坏死细胞的细胞数相对阴性对照组细胞数0.8%分别增加到2.4%、3.0%和7.7%,并且具有极显著差异,量效关系明显.
2.6 PI单染法检测细胞周期
细胞周期是指细胞从一次分裂结束到下一次分裂终了的过程,细胞周期分为G1期、S期、G2期和M期,其中最关键的是S期,此期细胞进行DNA倍增和染色体复制,是增殖的关键时期.驼乳清TR35组分作用Hela细胞24 h后,G0/G1期细胞随其浓度的增加而减少,S期细胞随着其浓度的增加而增加,而G2/M期细胞数没有发生变化,说明TR35处理Hela细胞后,细胞周期主要阻滞在S期,结果见图7.
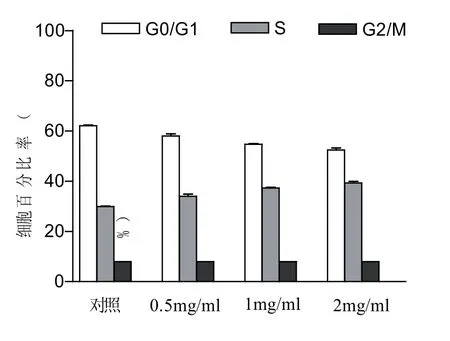
图7 驼乳清蛋白组分TR35对Hela细胞对细胞周期的影响(24 h)(p<0.01)
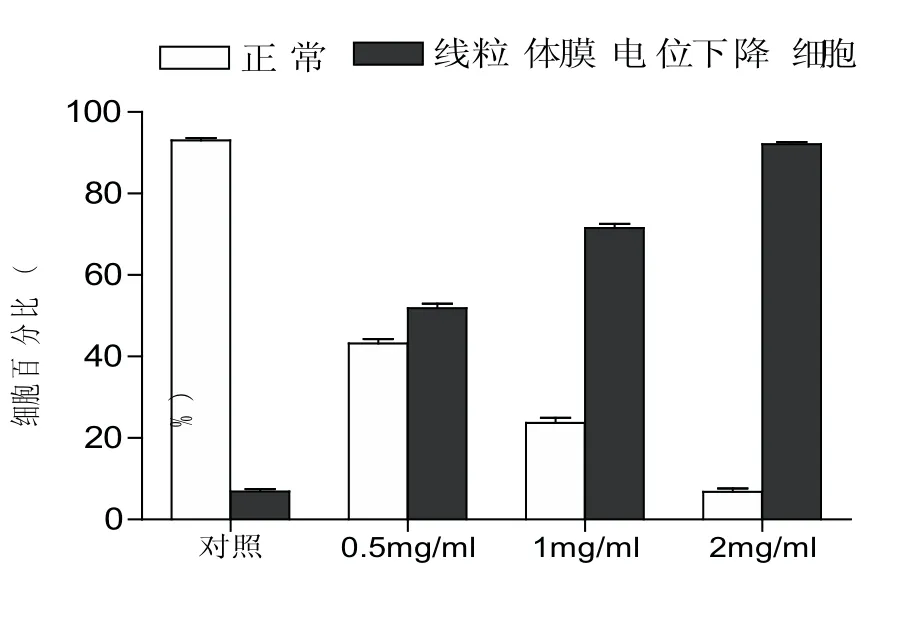
图8 TR35对Hela细胞线粒体膜电位的影响(24 h)(p<0.01)
2.7 TR35处理对Hela细胞线粒体膜电位的影响
线粒体是为细胞提供能量的细胞器,也是调控凋亡通路的细胞器,线粒体膜电位的迅速下降使电子传递和呼吸链解偶联,造成细胞凋亡[15].
不同浓度TR35处理Hela细胞24 h后,随着TR35浓度的增加,正常线粒体膜电位的细胞的细胞数逐渐减少,线粒体膜电位下降的细胞数逐渐增加,即Hela细胞线粒体膜电位逐渐降低.由图8可知,对照组中线粒体膜电位下降细胞占细胞总数的7.97%,而在处理组中分别占到53.2%、73.02%和93.08%,具有极显著差异(p<0.01),并呈量效关系.
3 结论
驼乳清抑癌组分TR35对人宫颈癌Hela细胞有明显的增殖抑制作用,抑制作用呈时间和剂量依赖性;细胞显微形态明显变化,出现典型的凋亡特征.同时观察到该组分可诱导Hela细胞线粒体膜电位去极化,并将细胞周期阻滞在S期,以此推测驼乳清抑癌组分TR35诱导HeLa细胞凋亡应与线粒体通路有关.
线粒体是真核细胞内重要的半自主性细胞器,唯一拥有独立于细胞核基因组外的遗传物质,在能量代谢、氧自由基的产生、维持钙稳态、细胞凋亡、衰老以及肿瘤中发挥着极为重要的作用.线粒体代谢抑制剂可用于癌症治疗,是目前抗肿瘤药研发的重要方向之一.
宫颈癌是最常见的妇科恶性肿瘤之一,根据流行病学调查显示,宫颈癌是新疆地区高发肿瘤,死亡率居女性恶性肿瘤之首.如何控制宫颈癌的生长及转移,进一步提高其治疗效果仍是宫颈癌研究的难题之一,寻找具有抗肿瘤活性的副作用小的新型药物是目前宫颈癌的研究热点之一.近年来,驼乳的抗癌作用受到广泛关注,在新疆少数民族传统医学中,很早就有采用骆驼乳作为抑制肿瘤细胞生长的辅助治疗手段的记载,但是对其抗肿瘤活性成分研究的报道尚不多见,作用机理尚不明确.本研究对新疆双峰驼乳抑癌活性组分体外抑制宫颈癌Hela细胞增殖作用进行初步研究,为深入探索其作用机理提供了实验基础.
猜你喜欢
杂志排行
新疆大学学报(自然科学版)(中英文)的其它文章
- Spin-filtered Edge States and Quantum Spin Hall Effect in Bilayer Graphene∗
- WSNs中基于Chebyshev多项式的可认证密钥协商方案∗
- 新疆加曼特金矿与斑岩型金矿的对比研究∗
- 具有非倍测度的参数型Marcinkiewicz积分交换子在Hardy空间的估计∗
- Periodic Solution of a Two-species Competitive Model with State-Dependent Impulsive Replenish the Endangered Species∗
- Permanence and Extinction for Nonautonomous SIRS Epidemic Model with Density Dependence∗
