混合菌发酵豆粕条件优化及功能性低聚糖水苏糖、棉子糖的测定
2015-10-28刘迎春等
刘迎春等


摘要:研究采用乳酸菌(Lactotacillus)、屎肠球菌(Enterococcus faecium)、枯草芽孢杆菌(Bacillus subtilis)和酵母菌(Saccharomyces),通过不同组合优化豆粕固态发酵,在接种量相同、发酵时间不同的条件下,以未发酵豆粕为对照,测定各组的蛋白质、脂肪、水分、灰分含量,选出最佳发酵方案。研究表明,不同组合的菌种及不同的发酵时间对发酵豆粕品质的影响存在交互作用。不同菌种组合营养成分增加量不同,其中乳酸菌∶屎肠球菌∶枯草芽孢杆菌=1∶1∶1组增长最为明显,随着发酵时间的增加,其蛋白质含量呈先上升后下降趋势,在发酵第五天时达到最高点,显著高于对照和其他组合,较0 d时提高了24.38%;灰分含量较低,较0 d时降低了8.89%,可作为豆粕发酵的适宜菌种组合。并利用HPLC同时测定未发酵豆粕和发酵最优豆粕中水苏糖和棉子糖含量。结果显示,发酵最优豆粕中水苏糖和棉子糖含量显著降低,可有效缓解动物食用后的消化不良、胀气等问题。
关键词:豆粕;混合菌发酵;水苏糖;棉子糖;HPLC
中图分类号:S816.42;TS214.2 文献标识码:A 文章编号:0439-8114(2015)16-4007-05
DOI:10.14088/j.cnki.issn0439-8114.2015.16.045
The Condition Optimization of Bacterial Combinations for Fermentation of Bean and Determination of the Content of Stachyose and Raffinose
LIU Ying-chun, CAO Yu, ZHANG Jian-xin, ZHANG Na, BI Lin-jie, LIU Tian, CHEN Jian-jun
(Life Science College, Henan Normal University,Xinxiang 453007,Henan,China)
Abstract: The bacterial combination for solid fermentation of bean pulp bran were optimized using lactobacillus ,Enterococcus faecalis,Bacillus subtilis,and saccharomycetes. The optimized fermentation combination was ascertained by the determination of the protein, moisture, ash, and fat contents in fermentated bean pulp.With the same inoculation quantity and different days,the unfermentated bean pulp was used as CK. The results showed that different combination of strains and different fermentation days had interaction effects on the quality of fermented bean pulp. Nutrients of fermented soybean meal by different combinations increased in different degrees compared to unfermented soybean meal. The increase of group B (lactobacillus: Enterococcus faecalis: Bacillus subtilis=1∶1∶1) was the most obvious. With the increase of fermentation time, the protein content went up and the went down.It reached the highest at day 5 of fermentation, which was signicantly higher than unfermented soybean meal and other combinations, increased by 25.45%. Ash content was lower and decreased by 9.89% than the unfermented bean pulp ,which can be regarded as the best combination of strains and fermentation time. High performance liquid chromatography was used to determine the content of stachyose and raffinose in unfermented bean pulp and fermented optimal. Strains of the optimal combination of stachyose and raffinose's content decreased significantly, which could effectively alleviate the digestion and flatulence of animals after eating it and improve the palatability of animals.
Key words:bean pulp; mixed strains fermentation; stachyose; raffinose; high performance liquid chromatography
中国是养殖大国之一,同时也是饲料原料特别是蛋白质原料的需求大国[1]。近年来,随着中国饲料工业的蓬勃发展,豆粕作为饲料工业中应用最为广泛的植物性蛋白质原料的供应量也在逐年增长[2],由于其兼具赖氨酸含量高、货源充足等优点,成为目前畜牧养殖业使用量很大的优质蛋白质源之一。然而,由于豆粕中抗营养因子的存在以及其适口性差等问题影响了豆粕的应用价值[3]。大豆低聚糖(Oligosaccharides of soybeans,SBOS)是一类存在于大豆中的低分子糖,其主要成分是蔗糖(Sucrose)、水苏糖(Stachyose)和棉子糖(Raffinose)。由于不能被胃和小肠中的消化酶消化,只能被结肠中的细菌发酵产生气体,引发动物胃肠胀气[4],使其在动物体内的消化率吸收率下降。
利用微生物发酵豆粕,成本低,对饲料营养成分的影响与破坏小,可以消除豆粕中胰蛋白酶抑制剂、低聚糖和植酸等的不利影响,有效缓解并消除动物食用后产生的消化不良、胀气等问题,提高各类物质的营养价值[5],同时还可以积累有益的代谢产物和益生菌[6]。此外,豆粕为微生物生长提供了天然的碳源及氮源,经过改造可配成适宜益生菌繁衍的培养基,将“废弃物”变成优质饲料产品,是解决中国饲料蛋白质不足的快捷、经济、有效的途径,对于当前饲料行业缓解鱼粉紧张的局面具有积极的意义。
本研究拟采用混合菌对豆粕进行发酵, 以降解豆粕中大分子蛋白质和降低抗营养因子的含量,最终得到一种有利于动物消化吸收和生长发育等功效的豆粕发酵蛋白饲料。并利用HPLC同时测定未发酵豆粕和发酵豆粕中水苏糖和棉子糖的含量,为发酵豆粕作为生物饲料的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
豆粕由焦作恒辉饲料厂提供;牛肉膏、蛋白胨、酵母浸出粉、葡萄糖、吐温80、磷酸二氢钾、三水乙酸钠、柠檬酸三铵、七水硫酸镁、一水硫酸镁、氯化钠、甘油磷酸钠、溴甲酚紫、叠氮钠、TTC等均由河南师范大学微生物实验室提供;凯氏定氮所需试剂:硫酸钾(分析纯)、硫酸铜(分析纯)、浓硫酸(98%)、硼酸(4%)、0.2 mol/L pH 7.4的磷酸缓冲液;三氯醋酸;10%三氯乙酸;混合指示剂(0.1%甲基红乙醇溶液和 0.5%溴甲酚绿乙醇溶液按1∶1混合);高效液相色谱所需试剂:水苏糖、棉子糖标准品为Sigma公司色谱纯产品;乙腈、95%乙醇、三蒸水均为色谱纯;其他试剂均为分析纯;0.45 μm有机滤膜。
1.2 仪器设备
分析天平(精度为0.000 1 g);高温电炉(可控温在1 600 ℃);高压灭菌锅;超净工作台;电热恒温培养箱(SGSP-020);摇床;FOSS全自动凯氏定氮仪;量筒;容量瓶;烧杯;移液管;电子天平等;真空抽滤泵;高效液相色谱仪;色谱柱:氨基柱Agilent Zorbax carbohydratc (4.6 mm×150 mm,5 μm);RID检测器;电烘箱;干燥器;铝盒;研钵或粉碎机等。
1.3 试验方法
1.3.1 菌种及培养基制备 乳酸菌(Lactobacillus)、枯草芽孢杆菌(Bacillus subtilis)、酵母菌(Saccharomyces)、屎肠球菌(Enterococcus faecium)均来自于河南师范大学微生物实验室。
斜面培养:将酵母菌、屎肠球菌、乳酸菌和枯草芽孢杆菌进行斜面活化,其中酵母菌在马铃薯葡萄糖琼脂培养基(PDA)活化,枯草芽孢杆菌在牛肉膏蛋白胨斜面进行活化,乳酸菌和屎肠球菌在MRS琼脂培养基斜面活化,在30 ℃恒温培养箱中培养72 h。
种子培养:挑取经过活化的菌种,制成菌悬液,酵母菌在100 mL PDA液体培养基扩大培养;枯草芽孢杆菌在50 mL牛肉膏蛋白胨中培养;乳酸菌和屎肠球菌在50 mL MRS液体培养基30 ℃恒温培养箱中扩大培养72 h。
固体发酵培养基:称取1 g硫酸铵、1 g尿素和1 g磷酸二氢钾置于100 mL烧杯中,加入40 mL去离子水溶解后,加入盛有47 g豆粕的发酵培养皿中混合均匀,121 ℃下湿热灭菌30 min。将不同种类的菌种接种到固体培养基中,培养96 h。
1.3.2 豆粕成分分析 粗蛋白质含量测定:半微量凯氏定氮法(GB/T6432-2006);灰分含量测定:550 ℃灼烧法(GB/T6438-2007/ISO 5984:2002);粗脂肪含量测定:索氏抽提法(GB/T6433-2006);水分含量测定:105 ℃恒重法(GB/T6435-2006);水苏糖、棉子糖含量测定:高效液相色谱法[7]
1.3.3 豆粕固态发酵 试验设置3个试验组,每组设置3个平行(表1),以未发酵为对照。根据表1的试验安排,每试验按照不同组合接种后,搅拌均匀,置于 30 ℃恒温培养箱中培养,分别在0、3、5、7 d取样测定其蛋白质、水分、灰分和脂肪含量,发酵时间共持续7 d。
1.3.4 蛋白质的测定 凯氏定氮法[8]测蛋白质含量。称取5.0 g粉碎后的样品,移入干燥的500 mL定氮瓶中,加入0.5 g硫酸铜、10 g硫酸钾稍摇匀后,置于FOSS全自动凯氏定氮仪的消化器中进行消化,待溶液消化至澄清且蓝绿色后自然冷却;然后将冷却后的定氮瓶移入FOSS全自动凯氏定氮仪的蒸馏器中,用盛有50 mL 4%的硼酸溶液和10滴混合指示剂的250 mL锥形瓶接收馏出物,收集约150 mL馏出物;最后用0.089 37 mol/L的盐酸溶液滴定收集液,至溶液的颜色恰好从蓝绿色变为酒红色为止。
空白试验:约0.5 g蔗糖,按上述操作方法做空白试验,消耗的 0.089 37 mol/L 的盐酸溶液为0.2 mL。
结果按下式计算:
粗蛋白质含量=■×100%
式中,C为盐酸标准溶液的浓度,mol/L;V1为空白试验滴定消耗的盐酸标准溶液体积,mL;V2为样品滴定消耗的盐酸标准溶液体积,mL;m为样品的质量,g;0.014为氮的摩尔质量,g/mmol;6.25为氮换算成粗蛋白质的系数。
1.3.5 脂肪的测定 将盛有滤纸包的培养皿移入(105±2) ℃烘箱中干燥2 h,取出,冷却,称重(记作a),然后装入3 g左右研细的样品,封好,(105±2)℃干燥3 h,冷却,称重(记作b)。抽提,称重:待乙醚挥发之后,将滤纸包置于(105±2) ℃烘箱中干燥2 h,放入干燥器冷却至恒重为止(记作c)。
粗脂肪含量=(b-c)/(b-a)×100%
式中,a为称量瓶加滤纸包重(g);b为称量瓶加滤纸包和烘干样重(g);c为称量瓶加滤纸包和抽提后烘干残渣重(g)。
1.3.6 水分的测定 称取5.0 g样品于已烘至恒重的铝盒中,将铝盒盒盖套在盒底下,在电烘箱温度升至105 ℃左右时放入样品并烘3 h,取出试样,立即盖好盒盖,放入干燥器内,冷却至室温称重,再复烘1 h,取出冷却称重,直至前后两次质量之差不超过0.005 g,即为恒重。如果后一次质量高于前一次质量,以前一次质量为准。
计算公式如下:
X=■×100%
式中,X为试样的水分含量,%;m1为干燥后试样的质量,g;m为试样的质量,g。
1.3.7 灰分的测定 称取3.0 g试样于已恒重的坩埚中,然后放在万用电炉上,把坩埚盖错开约0.5 cm,加热至试样完全炭化至无烟为止。将炭化好的试样送入高温电阻炉口片刻,再移入炉中,错开坩埚盖,关闭炉门,在500~550 ℃的电炉内灼烧2 h,灼烧中为使坩埚受热均匀,可将坩埚调换2次,灼烧至黑点消失为止,取出坩埚,冷却称重,然后再复灼烧,取出坩埚冷却称重。直至前后两次质量相差不超过0.2 mg为恒重。
湿物质的灰分按下式计算:
A1=■×100%
干物质的灰分按下式计算:
A2=■×100%
式中,A1为试样湿基灰分含量,%;A2为试样干基灰分含量,%;X为试样水分含量,%;m0为灰分质量,g;m为试样质量,g。
1.4 水苏糖、棉子糖的测定
1.4.1 色谱条件 色谱柱:Agilent Zorbax carbohydratc柱(4.6 mm×150 mm,5 μm);流动相为乙腈∶水(80∶20);柱温35 ℃;流速1.0 mL/min;进样量为20.0 μL;示差折光检测器[9],检测池温度35 ℃。
1.4.2 标准溶液配制 分别称取水苏糖、棉子糖标准品(含量≥98%)各0.02 g置于5 mL容量瓶中,用去离子水溶解并稀释至刻度,摇匀经0.45 μm滤膜过滤,滤液供HPLC分析用。
1.4.3 样品制备 精确称取5.00 g未发酵豆粕和发酵最优豆粕样品,粉碎后用石油醚回流除去脂肪,以料液比1∶9加入80%乙醇溶液,于60 ℃搅拌提取1 h,抽滤,滤渣用同样方法提取2次,合并滤液。滤液用10%的醋酸铅溶液沉淀蛋白,离心,重复2次至蛋白除尽,再用草酸除铅至无铅为止,滤液采用真空浓缩,转移至25 mL容量瓶,供HPLC分析用。
1.4.4 测定方法 分别取水苏糖、棉子糖标准溶液注入液相色谱仪,进行高效液相色谱分析,测定各组分色谱峰面积,以糖含量质量对相应的峰面积作标准曲线。在相同的色谱分析条件下,取20 μL试样溶液注入高效液相色谱仪分析,测定各组分色谱峰面积,与标准曲线比较确定进样液中水苏糖、棉子糖含量。
2 结果与分析
2.1 豆粕发酵后成分分析
2.1.1 发酵豆粕的蛋白质含量 由表2可知,在发酵0 d时,各组蛋白质含量相差不大;3 d时,各组蛋白质含量均有所增加,B组蛋白质含量最多,C组次之;5 d时,各组蛋白质含量持续增加,B组蛋白质含量仍然最多,A组次之,C组无明显变化;7 d时,蛋白质含量均有所下降,B组仍最高。由以上分析可知,当发酵到第五天时,B组菌种组合蛋白质含量提高最多,较0 d时提高了24.38%。
2.1.2 发酵豆粕的脂肪含量 由表3可知,在发酵0 d时,对照组脂肪含量略高;3 d时,A组、C组脂肪含量均有所下降,B组脂肪含量增加较为明显;5 d时,各组脂肪含量均有所增加,B组脂肪含量最高;7 d时,A组有所增加,B、C组变化不明显,B组含量最高。由以上分析可知,当发酵至第五天时,B组菌种组合脂肪的含量最高。
2.1.3 发酵豆粕的水分含量 由表4可知,在发酵0 d时,C组水分含量明显高于其他组;3、5 d时B组和对照组有所增加,C组略微下降,C组在第七天有所增加;B组在第0 d水分含量适中,第三天略微增加,第五天增加迅速,第七天略有下降。
2.1.4 发酵豆粕的灰分含量 由表5可知,在发酵0 d时,各组灰分含量相差不大;3 d时,各组灰分含量均有所下降,B组灰分含量最低,C组次之;5 d时,各组灰分含量持续下降,B组灰分含量仍然最低,A、C组次之;7 d时,各组灰分含量略微上升,排序为:B组 2.2 水苏糖、棉子糖的测定 2.2.1 水苏糖、棉子糖的标准曲线 由以上分析可知,B组(乳酸菌+屎肠球菌+枯草芽孢杆菌)发酵豆粕效果最好,利用HPLC同时测定未发酵豆粕和B组发酵豆粕水苏糖和棉子糖含量。所得水苏糖、棉子糖的标准曲线见图1。图1中,A为水苏糖的直线回归,方程为Y=264.010 74x+1 341.216 35,x为水苏糖的含量;y为水苏糖峰面积,R2=0.999 93;B为棉子糖的直线回归,方程为Y=269.159 52x+
2 172.028 43;x为棉子糖的含量;y为棉子糖峰面积,R2=0.999 96。水苏糖和棉子糖在1~10 mg/mL范围内线性均良好,相关系数分别为0.999 93、0.999 96。大豆中抗营养因子是影响大豆蛋白源在饲料中使用的主要因素,主要成分为低聚糖(包括棉子糖和水苏糖)。研究表明,当饲料中水苏糖含量为1.0%时,试验动物的生长受到显著抑制,由于人或动物缺乏α-半乳糖苷酶,所以不能水解、吸收棉子糖和水苏糖。它们进入大肠后,被肠道微生物发酵产气,引起消化不良、腹胀、肠鸣等症状[10]使干物质消化率显著下降。采用混合菌发酵可产生水解酶、发酵酶和呼吸酶,使大豆抗营养因子失活、钝化,消除了植物蛋白质原料中的抗营养物质,利于动物的消化吸收,有效提高了豆粕的利用率,增加了大豆蛋白质在饲料中的使用量。
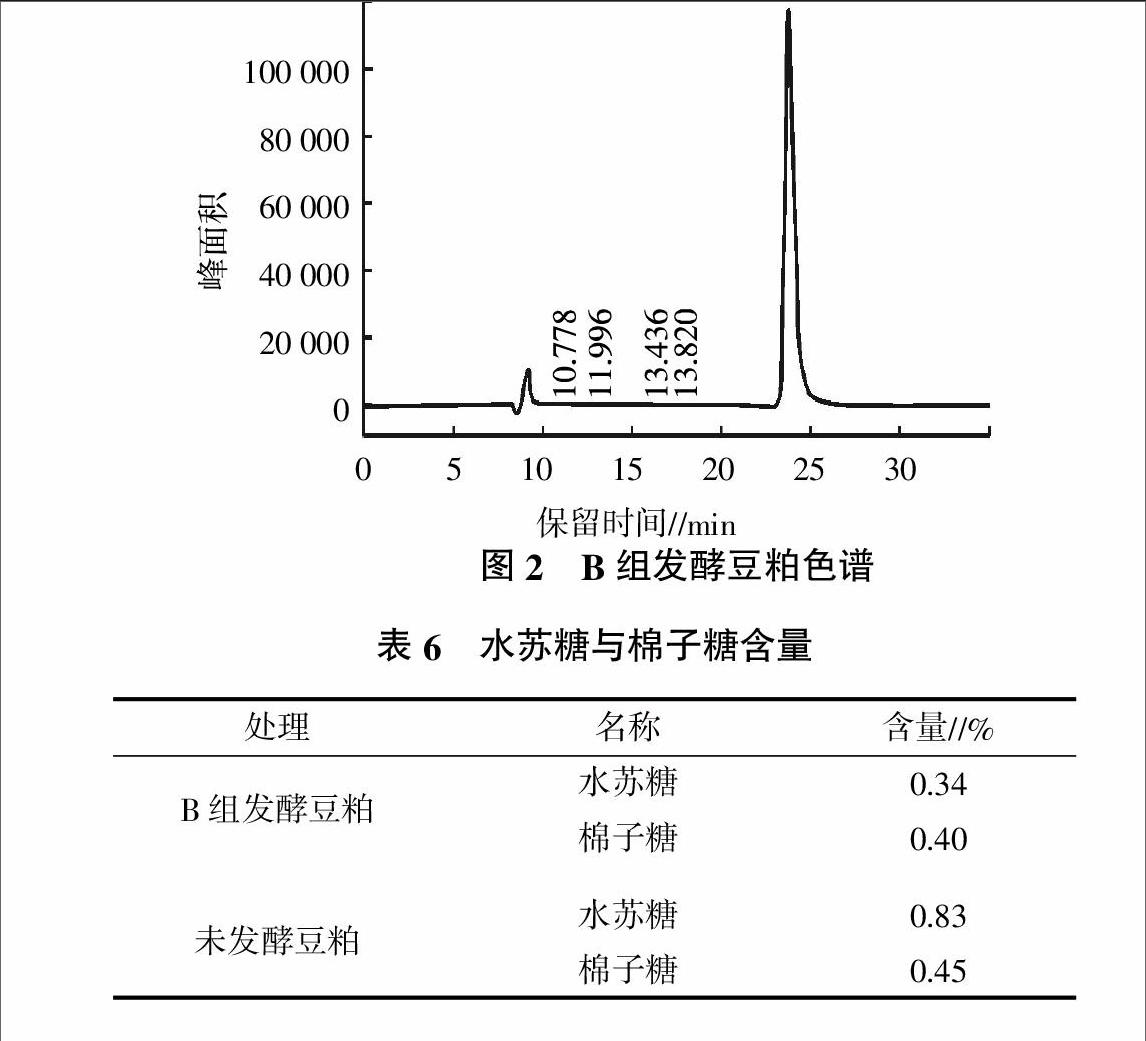
2.2.2 色谱分离 采用上述分析条件,柱温选定为30 ℃,棉子糖和水苏糖分离良好,两者的保留时间分别为10.778、11.996 min(图2)。利用HPLC同时测定未发酵豆粕和发酵最优豆粕中水苏糖和棉子糖含量(表6)。由表6可知,发酵最优豆粕中水苏糖和棉子糖含量显著降低,B组水苏糖含量较未发酵降低了59.04%,棉子糖降低了11.11%;发酵后的豆粕能有效消除抗营养因子的不利作用,提高豆粕质量。
3 小结与讨论
由3组混菌发酵结果可知,经过微生物发酵后的豆粕营养成分都有不同程度的提高,其中B组(乳酸菌+屎肠球菌+枯草芽孢杆菌)发酵豆粕效果最好,B组蛋白质含量较发酵之前提高最多,可达24.38%。豆粕经乳酸菌发酵后有酸甜芳香的气味,pH下降,能有效改善其适口性,促进畜禽的食欲,同时可以降低抗生素、酸化剂的添加量,提供营养物质,促进机体生长,还可提高矿物元素的生物活性,进而提高了豆粕的营养。屎肠球菌可把部分蛋白质分解成酰胺和氨基酸,把大部分碳水化合物的无氮浸出物转化为乳酸,使豆粕里的纤维变软,并且在屎肠球菌的生理作用下通过催化、水解等反应分泌出L-乳酸,它可以与钙质合成L-乳酸钙,促进动物对钙质的吸收。枯草芽孢杆菌是好氧菌,繁殖过程中产酸、酶和多种维生素,其中很多是动物本身不具有的酶,如降解豆粕中复杂糖类果胶酶、葡聚糖酶和纤维素酶等[11]。在初始培养条件下,枯草芽孢杆菌迅速生长,为之后厌氧菌乳酸菌提供良好的生长环境,3种菌种产生的代谢产物发生互补效应,产生了更丰富的酶系,利于微生物的增长,从而使可利用的蛋白质含量有较高的增长。
混菌发酵豆粕可降低水苏糖、棉子糖含量,水苏糖含量较未发酵降低了59.04%,棉子糖含量降低了11.11%。微生物是良好的单细胞蛋白质来源,可提高饲料中的蛋白质含量,采用独特的菌种和发酵工艺,利用菌种间交互作用,使豆粕本身的蛋白质含量进一步提高。饲料原料的营养价值不仅取决于营养成分的高低,而且取决于动物对营养成分的吸收和利用能力。利用微生物混合菌种发酵豆粕,微生物可以有效地利用豆粕中不易被动物消化吸收的水苏糖、棉子糖等抗营养因子来进行生长、繁殖,从而降低豆粕中的抗营养成分,提高了动物食用后的吸收利用率,打破了豆粕在饲料等领域应用的局限性,提高了豆粕的经济价值。目前,大豆低聚糖的检测方法主要有高效液相色谱法和高效气相色谱法,这两种方法都具有既可定性又可定量的优点。其中高效气相色谱法测定大豆低聚糖,使用的溶剂毒性较大,还需进行衍生化处理,且易造成溶剂拖尾,操作繁琐。高效液相色谱法测定大豆低聚糖采用常规溶剂,样品处理简单,分离效果好,准确可行,重现性及回收率均比GC法好[12]。
参考文献:
[1] 姚 琨,李富伟,李兆勇.发酵豆粕概述[J].饲料与畜牧,2011(12):32-38.
[2] 李 建.发酵豆粕研究进展[J].粮食与饲料工业,2009(6):31-35.
[3] 姚 琨,李兆勇.发酵豆粕生产工艺的最新研究进展[J].饲料工业,2011,32(23):65-70.
[4] 蔡英华.几种大豆抗营养因子对牙鲆(Paralichthys olivaceus)生长和消化生理的影响[D].山东青岛:中国海洋大学,2006.
[5] MIN B J, HONG J W, KWON O S, et al. The effect of feeding processed soy protein on the growth performance and apparent ileal digestibility in weanling pigs[J]. Asian Australas J Anim Sci,2004,17(9):1271-1276.
[6] 蔡国林,杨 旭,曹 钰,等.微生物发酵对豆粕营养价值的影响[J].中国油脂,2008(10):21-24.
[7] 付亭亭,李爱科,梁新晓,等.豆粕中抗营养因子检测技术研究进展[J].粮油食品科技,2014,22(1):85-90.
[8] 许家喜.蛋白质的检测方法与乳制品中蛋白含量测定[J].大学化学,2009(1):66-69.
[9] 邱建国,张汝学,贾正平,等.地黄中寡糖含量的HPLC法测定[J].中国实验方剂学杂志,2009,15(8):8-9.
[10] 王春林,陈喜斌.大豆中抗营养因子及其处理方法[J].饲料工业,2000,21(9):12-14.
[11] 周晓辉,李 彪.枯草芽孢杆菌的机制及应用研究[J].饲料研究,2009(10):26-28.
[12] 唐春江,邓放明,王乔隆,等.大豆低聚糖的研究进展[J].农产品加工·学刊,2008(2):33-37.
