鸭胚肾细胞用于鸭肝炎弱毒增殖的研究
2015-10-28卢顺等
卢顺等
摘要:为分析鸭胚肾细胞用于鸭肝炎病毒增殖的可能性,从鸭胚肾细胞的制备、体外培养、鸭肝炎弱毒在鸭胚肾细胞中的增殖等方面入手,初步分析了鸭胚肾细胞体外培养和用于鸭肝炎病毒增殖的可行性。结果表明,鸭胚肾细胞能够体外培养并形成良好的细胞单层,形态多为多边形或梭形;原代鸭胚肾细胞可以用于增殖鸭肝炎弱毒A66株,毒价(ELD50)达10-4.2/0.2 mL。说明鸭胚肾细胞适合用于鸭肝炎病毒的增殖,有望用于鸭肝炎病毒疫苗的生产。
关键词:鸭胚肾细胞;体外培养;鸭肝炎弱毒
中图分类号:S852.65;S858.32 文献标识码:A 文章编号:0439-8114(2015)16-3983-03
DOI:10.14088/j.cnki.issn0439-8114.2015.16.038
Proliferation of Attenuated Duck Hepatitis Virus in Duck Embryo Kidney Cells
LU Shun, GAO Qi-shuang,LIU Wu,CHEN Zhi-hua,ZHOU Li,ZHAN Cai-yao,TONG WEI-wen,
TAO Bi-fei,XIA Yu,WANG Lian-fang,HUA Juan
(Wuhan Institute of Animal and Veterinary Science, Wuhan 430208, China)
Abstruct:In this study the possibility of proliferation of duck hepatitis virus in duck embryo kidney cell were analyzed through the preparation of duck embryo kidney cell, cultured in vitro and the proliferation of duck hepatitis virus in the cell. The results showed that duck embryo kidney cell could be cultured in vitro; most of the cells were polygonal or fusiform. Duck embryo kidney cell could be used in proliferation of attenuated duck hepatitis virus A66, and the virus titer could reach 10-4.2/0.2 ml (ELD50). It indicated that duck embryo kidney cell was suitable for duck hepatitis virus proliferation and might be used to produce vaccines.
Key words:duck embryo kidney cell; in vitro cultivation; attenuated duck hepatitis virus
近年来,鸭病毒性肝炎在中国水禽养殖区广泛流行,给养鸭业带来了巨大的威胁。鸭病毒性肝炎由鸭肝炎病毒(DHV)引起,主要危害3周龄以内的雏鸭,病死率可达100%[1]。已报道的鸭肝炎病毒有3个血清型,即Ⅰ型、Ⅱ型和Ⅲ型。中国已发现Ⅰ型和Ⅲ型鸭肝炎病毒,其中流行的主要是Ⅰ型[2]。目前尚无治疗鸭病毒性肝炎的特效药物,接种鸭肝炎疫苗是预防和控制该病的最经济且行之有效的方法。
在国内,鸭肝炎疫苗的生产还主要依靠传统的鸡胚培养技术[3],使用细胞生产鸭肝炎病毒疫苗尚处在研究阶段,暂时还没有细胞源的鸭肝炎病毒疫苗上市销售。相比鸡胚培养技术,细胞培养病毒具有周期短、质量易控制和抗原纯度高等优点[4],因此使用细胞生产鸭肝炎病毒疫苗是未来的发展方向。这也使得寻找适合培养鸭肝炎病毒的细胞成为研究的热点。目前,已报道用于培养鸭肝炎病毒的细胞系主要是鸡胚或鸭胚成纤维细胞系,关于其他细胞的研究较少。因此,寻找新的适合于鸭肝炎病毒增殖的细胞,能为鸭肝炎病毒及其疫苗的研究工作提供新的细胞材料。本研究旨在探索鸭胚肾细胞用于鸭肝炎病毒增殖的可能性,为鸭肝炎病毒的研究和疫苗生产提供参考。
1 材料与方法
1.1 培养基及主要试剂
DMEM高糖培养基(粉剂)和胎牛血清购自GIBCO公司;双抗(青霉素、链霉素混合液,100×)、胰蛋白酶购自Sigma公司;其他化学试剂均为分析纯。
1.2 毒株、鸭胚和鸡胚
鸭肝炎病毒弱毒A66株(疫苗毒株)购自南京天邦生物科技有限公司;12日龄鸭胚(江汉鸭)购自武汉市春江禽业有限责任公司;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.3 方法
1.3.1 试剂配制 细胞培养基配制:DMEM培养基按说明书配制,0.22 μm滤膜过滤除菌,4 ℃保存备用。临用前加入15%胎牛血清和1%双抗配制成工作液。细胞消化液配制:取胰蛋白酶粉剂,用PBS配制成0.25%胰蛋白酶-0.02%EDTA的细胞消化液,0.22 μm过滤除菌,分装于10 mL小瓶,-20 ℃冻存备用。
1.3.2 鸭胚肾细胞的制备 取12日龄的鸭胚,在无菌环境中打开气室取出胚胎,立即放入盛有无菌PBS(含2%的双抗)的平皿中,漂洗数次。将胚胎放入新的平皿中,剪开腹部,取出肾,置于另一无菌平皿中,PBS漂洗2次。用眼科剪将肾组织剪成糜状,加入2 mL 细胞消化液于37 ℃消化15 min。加入细胞培养基终止消化反应,离心收集细胞。细胞用培养基重悬,反复吹打制备成细胞悬液,分装于100 mL规格的细胞瓶中,于37 ℃、5% CO2的培养箱中进行原代培养。
1.3.3 鸭胚肾细胞的传代培养 3 d后原代细胞贴满细胞瓶底,弃去培养上清液,更换新的培养液。再次培养3 d后,用细胞消化液消化细胞。将消化好的细胞用培养基重悬,轻轻吹打使之分散。重悬的细胞在原细胞瓶中静置培养。细胞长满瓶底后,再次用消化液消化细胞,按1∶2的比例(1瓶内的细胞分装到2个细胞瓶内)进行传代培养。之后每当细胞长满单层,即进行传代。
1.3.4 鸭肝炎弱毒在鸭胚肾细胞中的增殖 待鸭胚肾细胞长成单层,弃去培养液,用PBS清洗细胞1次,接种2 mL鸭肝炎病毒液(200 ELD50/mL),置培养箱37 ℃吸附1 h,弃去多余的病毒液,加入37 ℃ 预温的细胞维持液(含1%胎牛血清的DMEM),置37 ℃含5% CO2的培养箱中继续培养,逐日镜检,观察细胞变化。收获每次接毒的细胞培养物,反复冻融3次,离心收集上清液,弃去沉淀。按照常规方法进行连续传代,观察细胞接毒后是否发生病变。
1.3.5 鸭肝炎病毒毒价的测定 取接毒的细胞培养物,用Hank′s液10倍倍比稀释,每个稀释度经尿囊腔接种鸡胚4枚,0.2 mL/枚,记录鸡胚死亡情况,按Reed-Muench方法[5]计算鸡胚半数致死量(ELD50 )。
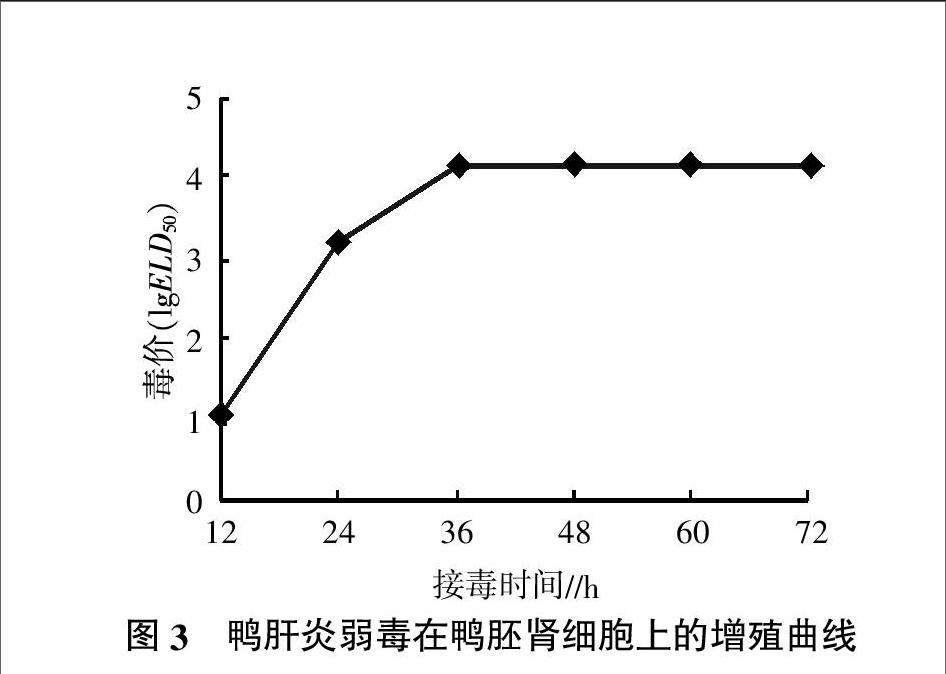
1.3.6 病毒在鸭胚肾细胞上的生长曲线 收集接毒后12、24、36、48、60、72 h的细胞培养物,冻融3次后,按上述方法接种SPF鸡胚,测定细胞培养物的ELD50,根据病毒滴度绘制生长曲线。
2 结果与分析
2.1 鸭胚肾细胞的生长情况
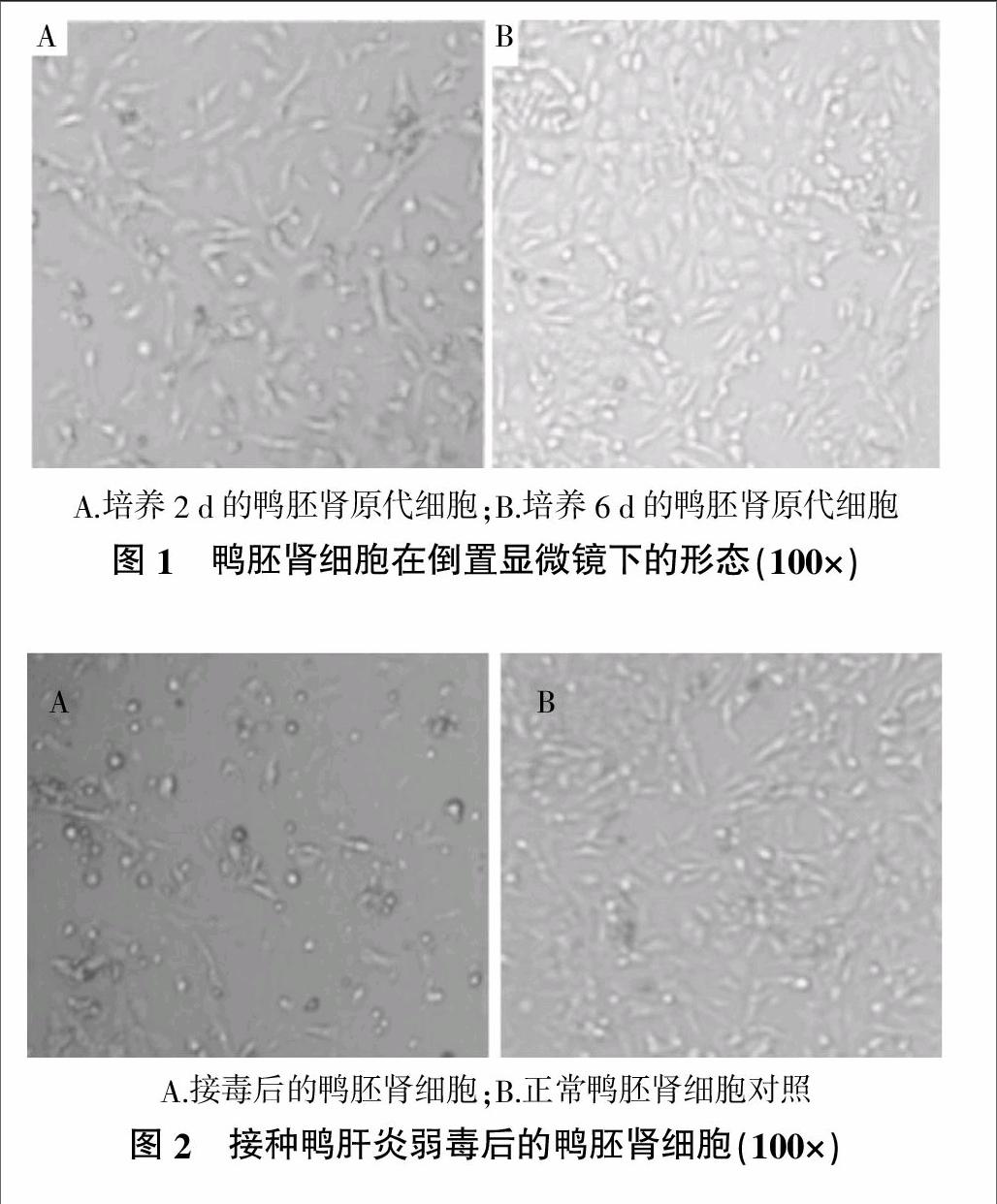
原代的鸭胚肾细胞静置培养到第二天时,可看到大部分细胞已贴壁生长,从形态上看主要是多边形和梭形。对细胞进行换液后继续培养至第六天,细胞形成单层,排列紧密,具有典型的上皮细胞特征(图1)。细胞传至第四代时,大部分细胞逐渐死亡。存活下来的细胞经数次传代后,生长速度逐渐变快,传代后3 d即可形成细胞单层。
2.2 DHV在鸭胚肾细胞上致细胞病变情况
将DHV弱毒接种在鸭胚肾细胞单层上,传至第三代时出现细胞病变,表现为细胞变圆、脱落(图2)。对照组细胞无明显病变。
2.3 DHV在鸭胚肾细胞培养物中的毒价
按Reed-Muench法计算收获的病毒培养物的毒价(ELD50),结果前3代病毒培养物的毒价分别为10-3.6/0.2 mL、10-4.2/0.2 mL和10-4.2/0.2 mL。
2.4 DHV在鸭胚肾细胞中的增殖曲线
鸭胚肾细胞接毒后,收集不同时间的细胞培养物,接种SPF级鸡胚测定ELD50。结果显示接毒36 h后毒价能达到峰值(图3)。
3 小结与讨论
目前,鸭肝炎病毒的培养主要采用SPF鸡胚接种,该方法需要耗用大量的优质鸡胚。SPF鸡胚的来源十分有限,不能随时获得,质量也难以控制[6],使用受到一定限制。此外,利用鸡胚生产鸭肝炎病毒疫苗,在处理废弃的鸡胚残体时只能采用焚烧或其他无害化的处理方法,对环境有一定的污染。相比之下,细胞培养病毒具有周期短、质量易控制、抗原性好和环保等优点。为此,本试验研究了鸭胚肾细胞用于增殖鸭肝炎病毒的可能性,为开展鸭肝炎病毒的相关基础研究提供了参考。
本研究制备了鸭胚肾细胞,研究了鸭肝炎病毒在该细胞中的增殖特性。结果表明,鸭肝炎病毒可以适应鸭胚肾细胞,3次传代后产生明显的细胞病变,培养物的病毒滴度可达10-4.2/0.2 mL(ELD50)。用鸭胚肾细胞增殖鸭肝炎病毒比使用鸡胚或鸭胚增殖病毒更便捷、易行,为开展鸭肝炎病毒分子生物学研究提供了便利。研究中还发现,原代鸭胚肾细胞在体外传3代后,大部分细胞逐渐死亡,这与许静等[7]报道的鸭胚成纤维细胞培养相似。少数存活的细胞能逐渐适应传代培养。如能将这些细胞建立成永生性的细胞系,则能为鸭肝炎病毒等病原的生物学研究及其细胞疫苗的研发提供细胞资源。
国内外的研究表明,Ⅰ型鸭肝炎病毒能在鸭胚成纤维细胞、鸡胚成纤维细胞和鸭胚肝细胞上增殖,且部分毒株经传代适应后能引起细胞病变。吴培福等[8]报道鸭肝炎病毒S株能引起鸭胚肝细胞病变,主要表现为细胞萎缩、变圆和细胞脱落,但不同毒株致细胞病变的能力有差异,这可能与毒株的毒力以及鸭的品种有关。张小飞等[9]报道鸭肝炎病毒A66株能在鸡胚成纤维细胞上增殖,且能产生细胞病变。付玉志等[10]报道鸭肝炎病毒野毒株ZJ-08能在鸭胚成纤维细胞中增殖,并导致典型的细胞病变。本试验中观察到鸭肝炎病毒在江汉鸭的肾细胞上能引起病变,但第一代病变不明显。鸡胚半数致死试验表明,鸭肝炎病毒在鸭胚肾细胞上传代后仍能致死SPF鸡胚。本研究证实,鸭肝炎病毒弱毒能在鸭胚肾细胞中增殖,这为鸭肝炎病毒及其细胞源疫苗的研究提供了理论基础。
参考文献:
[1] 张艳芳,罗 薇,刘内生,等.鸭肝炎病毒的研究进展[J].中国畜牧兽医,2011,38(7):171-175.
[2] 张大丙.鸭病毒性肝炎研究概况[J].中国家禽,2010,32(22):39.
[3] 孙庆歌,肖爱芳,朱 薇,等.鸭病毒性肝炎疫苗研究进展[J].中国兽药杂志,2013,47(11):54-57.
[4] 向 敏,高其双,陈志华,等.胎羊肾细胞用于增殖H1N1亚型流感病毒的初步研究[J].动物医学进展,2013,34(2):52-55.
[5] 殷 震,刘景华.动物病毒学[M].第二版.北京:科学出版社,1997.
[6] TREE J A,RICHARDSON C,FOOKS A R,et al.Comparison of large-scale mammalian cell culture systems with egg culture for the production of influenza virus A vaccine strains[J].Vaccine,2001,19(25-26):3444-3450.
[7] 许 静,李进军,熊 胜,等.鸭胚成纤维细胞培养、传代及保存方法的研究[J].中国家禽,2012,34(13):9-13.
[8] 吴培福,张国中,韩 博,等.应用鸭胚肝细胞扩增鸭肝炎病毒[J].中国兽医杂志,2009,45(6):33-35.
[9] 张小飞,解启发,潘孝成,等.鸭肝炎病毒A66弱毒株在鸡胚成纤维细胞上的培养[J].中国兽医学报,2000,20(1):19-21.
[10] 付玉志,张洪辉,李传峰,等.Ⅰ型鸭肝炎病毒在鸭胚成纤维细胞系中的增殖特性研究[J].中国预防兽医学报,2013,35(2):110-113.
