奥沙利铂联合热疗对胃癌耐药细胞基因表达及增殖的影响
2015-10-25王婧张沂
王婧,张沂
(中国人民解放军海军总医院,北京100048)
奥沙利铂联合热疗对胃癌耐药细胞基因表达及增殖的影响
王婧,张沂
(中国人民解放军海军总医院,北京100048)
目的观察奥沙利铂联合热疗对胃癌耐药细胞基因GST-π,survivin和P-gp表达及增殖的影响。方法体外培养人胃癌SGC7901/DDP细胞,取其生长对数时期待用。设置对照组、化学治疗(简称化疗)组、热疗组和热化疗组,并应用流式细胞术(FCM)检测每组中人胃癌细胞的增殖情况;采用FCM方法半定量检测各细胞中GST-π,survivin和P-gp基因蛋白表达变化。将热化疗组置于37~43℃不同的恒温箱中进行试验,72 h后使用酶标仪检测不同温度的吸光度。结果热化疗可抑制GST-π,survivin和P-gp基因的表达,且抑制效果与外界温度呈正相关;热疗和奥沙利铂联合热疗对人胃癌细胞SGC7901/DDP的增殖均有明显的抑制作用;奥沙利铂联合热疗下降效果最明显。结论热疗及奥沙利铂联合热疗均能抑制体外培养的人胃癌SGC7901/DDP细胞的增殖和表达,并能抑制该细胞的凋亡。肿瘤基因的表达与热疗温度在37~43℃内呈正相关。
热疗;奥沙利铂;胃癌;耐药细胞
随着多药耐药(MDR)现象的出现,影响了化学治疗(简称化疗)对恶性肿瘤的疗效。热疗又称熏蒸,是治疗癌症患者的一种新方法。有研究发现,热疗和化疗能协同作用于癌症患者,且比单一化疗效果更好,患者无瘤期更长[1]。本研究中通过对比奥沙利铂联合热疗对人胃癌耐药细胞株的作用,并分析细胞增殖对GST-π,survivin和P-gp基因表达的影响,探索解决胃癌化疗耐药的新途径,现报道如下。
1 材料与方法
1.1 材料
人胃腺癌耐药细胞株SGC7901/DDP(南京凯基生物有限公司),置RPMI1640培养液中,加入质量浓度为1μg/mL的奥沙利铂(江苏恒瑞医药股份有限公司,批号为8956542DC)用来维持耐药性。兔抗人GST-π多克隆抗体、兔抗人survivin多克隆抗体和兔抗人P-糖蛋白(上海蓝基生物科技有限公司)。
1.2 方法
分组:选择培养液中生长对数期的细胞,通过常规胰蛋白酶消化后,以5.0×105/瓶接种于25 mL培养瓶中,培养24 h至细胞贴壁后,用含奥沙利铂0.1μg/mL的RPMI1640培养基换液。注意先将热疗组和热化疗组在43℃恒温水浴箱中加热2 h后,再与对照组、化疗组一起在37℃、5%的二氧化碳培养箱中继续培养24 h。
流式细胞术(FCM)法检测细胞周期分布和细胞凋亡:选取人胃癌耐药株细胞对数生长期,应用磷酸盐缓冲液(PBS)洗涤2次,然后用生理盐水洗涤2次,除去上清液,加油溴化丙啶1mL染色,立刻冰浴30min,用铜网过滤得到单细胞悬液,用流式细胞仪对细胞的DNA进行定量分析,计算出细胞周期的时相分布和凋亡率,按相应的公式计算增殖指数(PI)[2]。
FCM法半定量检测细胞的耐药基因蛋白表达:选取对数生长期细胞,各组均重复3瓶取平均值。常规胰蛋白酶对细胞进行消化,用PBS液离心洗涤2次,用70%冷乙醇(4℃)固定。调整细胞浓度为1.0×106/mL,选取配好的单细胞悬液1mL,分别加入兔抗人GST-π多克隆抗体、兔抗人survivin多克隆抗体和兔抗人P-糖蛋白0.1mL(工作浓度1∶50),在室温下孵育30min,再用PBS液洗3次;分别加入100μL羊抗兔IgG二抗工作液,室温下避光孵育30 min,最后用PBS液洗3次后上机检测。上机设定PBS为阴性对照,只加二抗作为本底对照[3]。以荧光指数(FI)作为表达蛋白的指数。平均荧光强度(均道值)=lg(测量值)×340。FI=实际样品均道值/对照样品均道值。
1.3 统计学处理
2 结果
2.1 细胞增殖的比较
与对照组相比,化疗组各细胞周期无明显变化(P>0.05);热疗组和热化疗组在G0/G1期的细胞比例逐渐升高,而S期的细胞比例明显降低(P<0.05);热疗组G2/M的细胞比例比对照组和化疗组有所增加,但差异不具有显著性(P>0.05);热化疗组相比其他各组各时期的细胞都有非常显著的变化(P<0.05);化疗组和热化疗组的PI相对对照组有所降低,但无明显差异;热化疗组的PI明显低于其他各组(P<0.05)。详见表1。
2.2 细胞耐药基因的表达
结果见表2。
2.3 热化疗与孵育温度的关系
由表3可见,在对人胃癌细胞SGC7901/DDP热化疗72 h后,不同的热疗温度下,人胃癌细胞株表达的GST-π,survivin和P-gp的量也各不相同,由整体趋势可见,随着热疗温度的升高,耐药基因表达的量在不断减少,且不同温度组间的表达差异有统计学意义(P<0.05)。
表1 4组细胞周期及PI变化比较(±s,%,n=3)
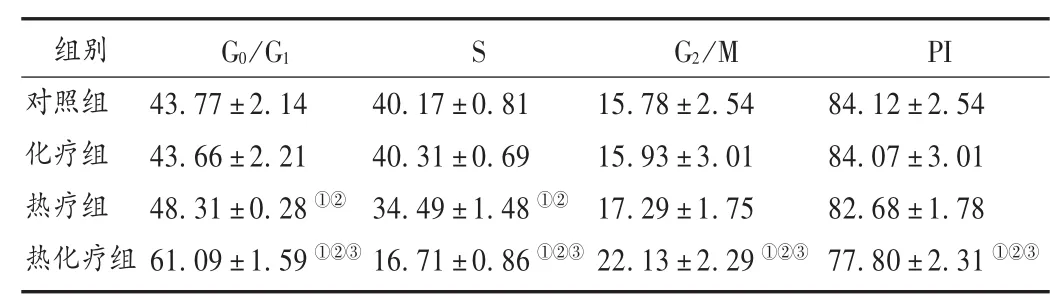
表1 4组细胞周期及PI变化比较(±s,%,n=3)
注:与对照组相比,①P<0.05;与化疗组相比,②P<0.05;与热疗组相比,③P<0.05。
组别对照组化疗组热疗组热化疗组G0/G143.77±2.14 43.66±2.21 48.31±0.28①②61.09±1.59①②③S 40.17±0.81 40.31±0.69 34.49±1.48①②16.71±0.86①②③G2/M 15.78±2.54 15.93±3.01 17.29±1.75 22.13±2.29①②③PI 84.12±2.54 84.07±3.01 82.68±1.78 77.80±2.31①②③
表2 4组细胞FI值比较(±s)
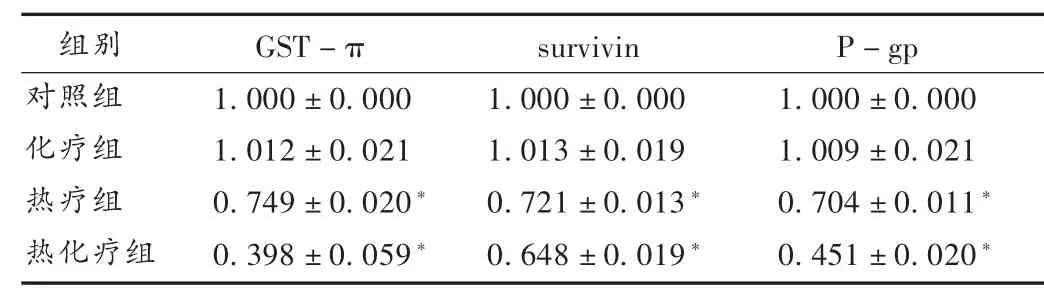
表2 4组细胞FI值比较(±s)
注:与对照组相比,*P<0.05。
组别对照组化疗组热疗组热化疗组GST-π 1.000±0.000 1.012±0.021 0.749±0.020*0.398±0.059*survivin 1.000±0.000 1.013±0.019 0.721±0.013*0.648±0.019*P-gp 1.000±0.000 1.009±0.021 0.704±0.011*0.451±0.020*
表3 奥沙利铂联合热疗对人胃癌细胞作用72 h后耐药基因表达的影响(±s)
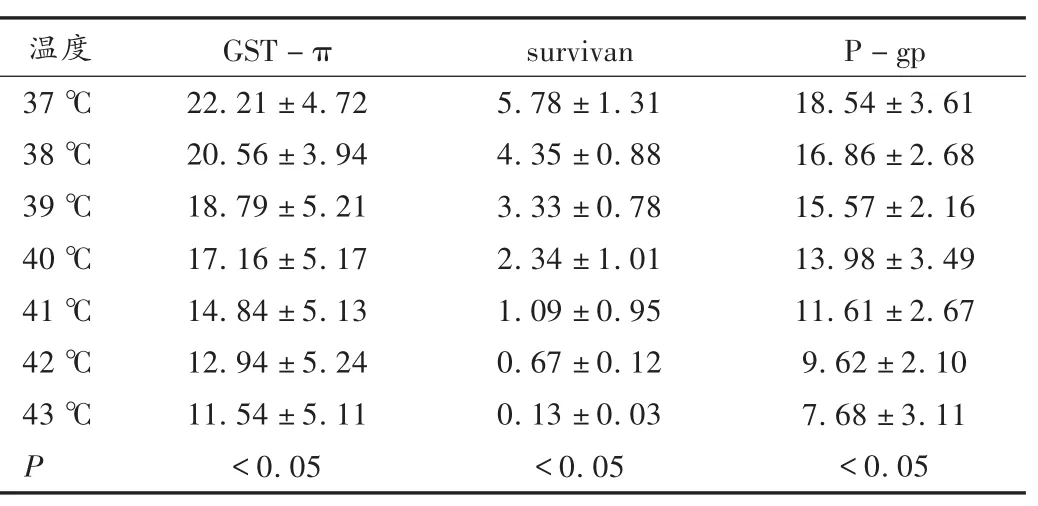
表3 奥沙利铂联合热疗对人胃癌细胞作用72 h后耐药基因表达的影响(±s)
温度37℃38℃39℃40℃41℃42℃43℃P GST-π 22.21±4.72 20.56±3.94 18.79±5.21 17.16±5.17 14.84±5.13 12.94±5.24 11.54±5.11<0.05 survivan 5.78±1.31 4.35±0.88 3.33±0.78 2.34±1.01 1.09±0.95 0.67±0.12 0.13±0.03<0.05 P-gp 18.54±3.61 16.86±2.68 15.57±2.16 13.98±3.49 11.61±2.67 9.62±2.10 7.68±3.11<0.05
3 讨论
化疗是手术外治疗胃癌患者最重要的方法,随着研究的深入,不同机制的MDR成为了肿瘤化疗的一大难题[4]。热疗的作用机制是热诱导细胞凋亡来杀伤肿瘤细胞,大量临床观察证实,热疗选择性杀死肿瘤细胞在临床治疗时有重要价值[5]。在此基础上,本研究中分析了热疗和热化疗对癌症患者的不同效果。热疗的作用机制:肿瘤内部血流速度慢、血流量低,在进行加热后,肿瘤组织的温度明显升高,同时正常组织变化不明显,可在不损伤正常组织细胞的前提下抑制肿瘤细胞;高热量使肿瘤组织热量聚集、pH降低、缺乏能量,直接损伤肿瘤细胞;高温同时不适合肿瘤细胞中DNA,RNA及蛋白的合成;高温可改变细胞结构,不可逆地破坏肿瘤细胞的细胞器;温度影响肿瘤细胞的生物膜,改变膜通透性;高温提高机体免疫系统活性[6]。本研究结果显示,热化疗比热疗效果更佳,作用机制为高温加速肿瘤组织附近血液循环,渗透性升高使得化疗药物更容易进入细胞[7];生物膜通透性随着温度升高而改变;高温破坏了DNA分子结构,减少癌细胞产生变异后代。
本研究结果显示,热疗和热化疗均会造成G0/G1期细胞增多,S期细胞减少,G2/M期细胞相对增多,同时热化疗作用效果最明显。温度在37~43℃时人胃癌细胞SGC7901/DDP的生长抑制作用随温度的升高而逐渐加强。与相关试验的结论热疗可导致肿瘤细胞中MDR1,MDP1,GST-π的耐药基因表达量大幅度减少[8-9]相符。
综上所述,奥沙利铂联合热疗能抑制体外培养的人胃癌SGC7901/DDP细胞的增殖和表达,并能抑制该细胞的凋亡,为临床热疗逆转胃癌耐药提供了试验依据。同时发现,肿瘤的表达基因与热疗温度在一定范围内呈正相关。但肿瘤耐药机制非常复杂,有很多的耐药机制,需更多的试验研究[10]。
[1]Zhang XL,Hu AB,Cui SZ,et al.Thermotherapy enhances oxaliplatin-induced cytotoxicity in human colon carcinoma cells[J].World JGastroenterol,2012,18(7):646-653.
[2]王琳,吴拥军,刘新奎.热化疗联合作用抑制人小细胞肺癌细胞增殖的机制[J].肿瘤防治研究,2011,38(1):1-4.
[3]赵大华,田东,于宁,等.胃癌组织中多药耐药基因产物LRP、GST-π、ToPoⅡ表达及临床意义[J].山东医药,2011,51(7):58-59.
[4]刘刚,欧阳德群,赵劲风,等.HSV-TK自杀基因联合热疗杀伤肝癌细胞系的实验研究[J].中国普通外科杂志,2013,12(8):717-719.
[5]胡梅洁,袁耀宗,孙颖,等.胃癌多药耐药相关蛋白表达的临床分析[J].胃肠病学,2011,16(5):293-297.
[6]阮新建,张侠,于忠和.奥沙利铂联合希罗达治疗老年晚期胃癌的疗效观察[J].中国药业,2010,19(1):41-42.
[7]于丽萍,李斌.多西他赛联合雷替曲塞治疗晚期胃癌的疗效观察[J].中国药房,2012,23(32):3 009-3 011.
[8]李琳琳,马锐,陈申,等.复方谷氨酰胺肠溶胶囊用于同步放化疗
晚期胃癌的疗效及安全性评价[J].中国药业,2014,23(24):56-58.
[9]麻周萍,徐燕舞,郑艳艳,等.护理干预对替吉奥联合奥沙利铂治疗胃癌术后患者的效果评价[J].中国药业,2013,22(5):80-81.
[10]李艳,章明放,郭雪西,等.胃腺癌中P-gp、ToPoⅡ、GST-π、MGMT和TS的表达及意义[J].临床与实验病理学杂志,2011,27(11):1 193-1 196.
R969.4;R979.1
A
1006-4931(2015)22-0078-03
王婧(1982-),女,大学本科,主管药师,研究方向为医院药学,(电话)010-66957612。
2015-02-05;
2015-05-08)
