不同运动负荷对大鼠骨骼肌MyoD蛋白表达及卫星细胞的影响
2015-10-22门杰孙茹
门杰 孙茹


摘要:目的:探讨大鼠MyoD和卫星细胞(SC)在骨骼肌再生和修复过程中的表达和变化,以及不同负荷运动和云南白药干预在骨骼肌损伤和修复中的作用机制。方法:104只雄性wister大鼠随机分为安静对照组(S)、无负荷组(N)、中等负荷组(M)和大负荷组(H),然后将不同负荷组随机分成治疗(T)组和非治疗(n)组。建立大鼠损伤模型1d后,模型大鼠左侧后肢为治疗侧,右侧为非治疗侧,损伤后0、1、4、7、10d取大鼠后肢腓肠肌做HE染色,观察SC数量及形态学变化,用RT-PCR法测定损伤后骨骼肌MyoD表达。结果:骨骼肌形态学变化在损伤后0d、1d最严重;所有分组MyoD表达除MT、Mn组和NT、Nn组在10d时与S组比较无统计学差异,其它各组与S组比较均有非常显著性差异。MyoD表达在不同组别T组与n组中,HT组较Hn组在4、7、10d均显著降低,MT组较Mn组无统计学差异,NT组与Nn组比较只有在4d时显著降低;所有分组SC数量在4、7、10d时与S组比较均有显著增加。SC数量在不同组别T组与n组中,4d时不同负荷T组与n组比较有所增加,7、10d时不同负荷T组与n组比较显著增加(P<0.01)。结论:云南白药在损伤过程中缩短炎症反应时间,加快了SC的激活与损伤修复,同时下调MyoD表达。MyoD和SC可以作为骨骼肌损伤后恢复程度的一个间接指标。
关键词:MyoD;卫星细胞;云南白药
中图分类号:G804;
文献标识码:A
文章编号:1008-2808(2015)04-0091-06
骨骼肌损伤是运动中最为常见的软组织损伤,在肌肉损伤中所占比例最大。骨骼肌损伤修复过程中肌肉质量和功能出现渐进性的下降,再损伤率上升,同时容易形成修复瘢痕,严重影响运动能力。不习惯的运动,特别是离心运动会导致肌节z盘加宽、模糊撕裂和肌节断裂等骨骼肌超微结构变化,这种变化也被称为运动性骨骼肌微损伤。骨骼肌卫星细胞激活数量与损伤修复密切相关,骨骼肌损伤后的再生和修复过程中的最重要的细胞是骨骼肌卫星细胞(satellite cell,SC)。SC和成肌调节因子(Myogenic Determinatio,MyoD)在骨骼肌的生长、发育、训练适应和损伤、移植中具有重要的作用,骨骼肌再生主要是由SC来完成的。肌肉损伤后损伤部位SC开始增殖、分化、形成新的肌纤维。BiSChoff在研究中指出,损伤或邻近损伤部位SC增殖明显,未损伤部位SC少量出现。骨骼肌SC激活、分化和再生过程与胚胎期肌肉的发育过程相似,MyoD是SC激活和增殖的标志。曾缨等探讨了成肌调节因子MyoD在骨骼肌损伤修复过程中的动态表达,结果MyoD在肌肉损伤后的再生修复过程中起着重要作用,可作为鉴定肌肉前体细胞和反映肌肉再生的指标。大量研究表明,MyoD参与骨骼肌损伤修复过程。但药物对不同负荷离心运动造成的大鼠骨骼肌微损伤过程中MyoD表达、卫星细胞在再生和修复过程中的动态变化及其与骨骼肌损伤和修复关系的研究还未见文献报道。
本研究通过对雄性wister大鼠8周不同强度运动干预的实验,观察运动导致的肌肉损伤后不同时程骨骼肌的SC、MyoD的变化,在修复过程中进行药物干预,为科学、准确地判断运动性骨骼肌损伤的研究和损伤修复机制的探索提供新的实验依据。
1实验对象与方法
1.1实验对象
104只雄性wister大鼠随机分为安静对照组(S)、无负荷组(N)、中等负荷组(M)和大负荷组(H),然后将不同负荷组随机分成治疗(T)组和非治疗(n)组。
1.2实验材料
6~8周雄性Wister大鼠104只,体质量(250±50)g,购自吉林大学动物实验中心。Wister大鼠实验前均未进行过跑台运动。动物饲养室符合国家二级动物饲养标准,每笼5只,自由饮食,分笼饲养,饲养笼为塑料制品,并配有不锈钢罩,玻璃吸水瓶以及不绣钢吸水管,饲养笼垫料为消毒碎木屑,每1~2天更换1次。动物饲养环境温度为(23.0±2.0)℃,相对湿度约为40%~60%,光照时间约为12h,云南白药气雾剂[国药准字Z53021107,规格:(50g+60g),倒置显微镜(OlymPus),图像处理仪(IBAS2000)]。
1.3动物分组及动物模型制备
本实验研究参照于新凯和Armstrong等专家的一次性跑台(下坡跑)行为学试验方法,构建骨骼肌损伤模型。在实验前2d,研究对象进行5~10min跑台运动,以便于熟悉动物跑台,速度5~10m·min-1,坡度为0。104只雄性wister大鼠随机分为大负荷组P(n=32)、中等负荷M(n=32)、无负荷组N(n=32)、安静对照组S(n=8)。然后将不同负荷组随机分成治疗组T(Treatment),非治疗组n(Non-theraPeutic)不同负荷组T组和n组大鼠各16只。正式训练8周,每周运动6天,周日休息。
正式训练方案:H组,第1周、第2周跑速为16m/min,坡度为-16°,训练时间为30min。第3,4周跑速增加到20m/min,坡度为-16°,训练时间为45min。第5周、第6周跑速增加到20m/min,坡度为-16°,训练时间为60min。第7,8周跑速增加到20m/min,坡度为-16°,训练时间为90min。M组,第1周、第2周跑速为15m/min,坡度为-16°,训练时间为15min。第3周至第8周跑速增加到20m/min,坡度为-16°,训练时间为30min。N组、S组不进行运动负荷干预。正式实验时,H组、M组、N组大鼠均进行持续性下坡跑,速度为16m·min-1,坡度为-16°,总运动时间200min。运动100min后,休息5min,然后再进行100min运动。
力竭标准:运动后期,大鼠下坡跑与运动前期明显吃力,大鼠未能坚持原速跑,跑的姿势由开始时的蹬地跑变为半卧位跑,腹部与跑道时有接触,甚至变为卧位跑,至运动末期,大鼠先后滞留跑道后1/3处,达3次以上,各种刺激驱赶均无效,停跑后体征表现为呼吸急促,神情倦怠,腹卧位,对刺激反应迟钝,捕捉时,逃避反应较运动前减弱,提前终止运动。研究人员记录运动时间。运动结束后,将各组大鼠放回笼内,同样条件饲养直至处死。endprint
1.4取材
S组在饲养8周后处死,其它各组的T组和n组在损伤模1d后,模型大鼠左侧后肢为治疗侧(喷洒云南白药)白天每隔6h喷1次药,右侧作为非治疗侧(喷洒生理盐水),分别在损伤后0d、1d、4d、7d、10d经腹腔注射戊巴比妥钠,以麻醉称重后的大鼠,用锡纸包好快速分离出腓肠肌,保存于液氮中,将标本保存至-80°的冰箱备用。另外在S组取8只没有损伤的大鼠后肢的腓肠肌作为对照组。观察腓肠肌损伤后形态学结构及SC的数量变化,SC的确认以活化的SC有中央核出现为参照标准。每组4张切片,每张切片的上、中、下随机选取5个视野进行分析,每一个小组得到20组数据。
1.5指标与测试方法
1.5.1骨骼肌HE染色方法固定后的组织块经70%的酒精冲洗至无黄色,然后修整,各级酒精脱水1~2h,透明、浸蜡、包埋、切片,常规HE染色。
1.5.2骨骼肌中MyoDmRNA的表达测定用RT-PCR法,测定MyoD的mRNA基因表达。PCR仪:为Biometra公司(德)生产的Thermocy-cler。先进行腓肠肌组织总RNA提取、逆转录(RT)(按试剂盒说明书),然后进行real-timePCR反应。
1.6统计学分析
各测试指标结果用SPSS17.0统计软件进行单因素方差分析统计。
2实验结果
2.1HE染色的形态学观察
S组的骨骼肌形态学结构正常,肌纤维排列有序,横纹整齐、清晰,肌核分布于肌膜下,呈扁椭圆形,不存在肌纤维变型、断裂、充血、坏死及炎症细胞(Inflammatory cell,FC)。跑台诱导大鼠骨骼肌损伤0d的HE染色图片表明,肌纤维断裂较为明显,血管开始充血,并有点片状红细胞聚集,无FC出现,运动后0d骨骼肌细胞疏松,肌膜开始模糊,肌纤维开始变形,细胞核出现聚集趋势,损伤1d后,肌细胞排列杂乱,损伤进一步加重,在断裂的肌纤维残端和邻近部位有活化的成肌细胞核聚集,但未损伤的部位成肌细胞核很少。FC开始大量出现,以中性粒细胞(neutroPhils)居多。运动后4d损伤部位FC依然可见,但肌纤维排列逐步变整齐。运动后7d损伤进一步恢复,肌纤维排列较为整齐,至10d炎症反应和FC逐步消失,损伤逐渐修复。H组、M组、N组变化趋势类似,M组损伤到修复过程较H组、N组快(见图1-3)。
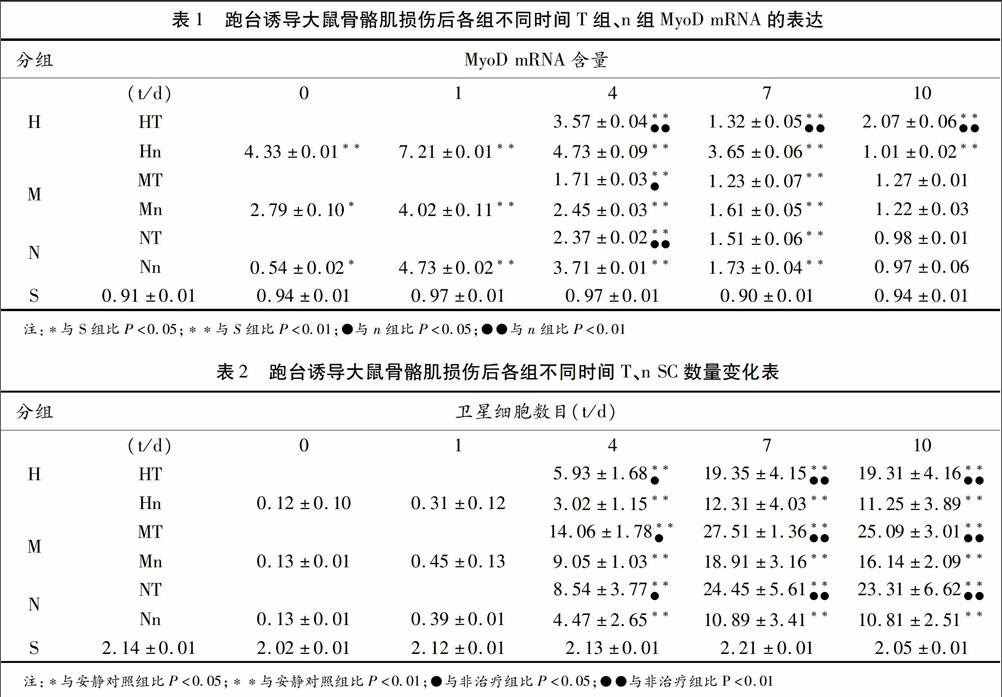
2.2不同负荷T组和n组骨骼肌中MyoD mRNA的动态变化
骨骼肌中MyoD的mRNA含量的变化从表1可以看出:不同负荷组运动后即刻至运动后1d大鼠MyoD mRNA的表达呈上升趋势,1d时表达出现峰值,运动后1d~10d MyoD的mRNA的表达呈下降趋势;MyoD的mRNA在不同负荷组中的1d、4d、7d表达均与S组有非常显著的差异(P<0.01),MyoD的mRNA在Hn组中第10d表达与S组比较有非常显著的差异(P<0.01);不同负荷组运动后,HT组MyoD mRNA第4d、7d、10d的表达与Hn组比较有非常显著的差异(P<0.01),MT组与Mn组MyoD mRNA第4d的表达与Mn组比较有显著的差异(P<0.05),第7d、10d MT组与Mn组比较无差异(P>0.05),NT组与Nn组MyoD mRNA第4d的表达与Nn组比较有非常显著的差异(P<0.01),第7d、10d NT组与Nn组比较无差异(P>0.05)。
2.3不同负荷组T组和n组损伤后不同时相SC激活数量变化
由表2所示:不同负荷组运动后0d~1d大鼠骨骼肌SC与S组比较无差异(P>0.05),运动后1d~7d骨骼肌SC数量逐渐增加到7d时达到峰值,SC数量7d~10d呈下降趋势;大鼠骨骼肌SC数量变化在不同负荷组中的1d、4d、7d、10d表达均与S组比较有非常显著的差异(P<0.01);不同负荷组运动后HT组SC数量第4d、7d、10d的数量与Hn组比较有显著性差异(P<0.05),第7d、10d的SC数量与Hn组比较有非常显著的差异(P<0.01);M组与N组中T组与n组数据变化与H组中T组和n组一致。
3讨论
1961年,Muaor首次从青蛙骨骼肌纤维中分离出来,由于这类细胞位置及排列方式好似肌纤维的卫星,因而得名卫星细胞。SC在骨骼肌生长、发育、损伤和修复等生理过程中起重要的作用,所以与SC相关的实验研究显得格外重要。骨骼肌的损伤和再生修复是一个连续的病理过程,研究显示,在经过不同负荷运动后,大鼠HE染色观察到骨骼肌形态学损伤在0d、1d最为显著,与张海平研究结果一致,表明,损伤的发生与形态学变化不一致,这种变化有明显的时相延迟性。孙茹等,在研究中指出卫星细胞的激活和分化与炎性细胞存在线性关系,即:一定数量的炎性细胞能促进SC的分化,过得的炎性细胞会抑制SC的激活分化,本次试验也发现MyoD的表达和SC的激活分化也存在同样的线性关系,这种线性关系是偶然现象还是必然有待进一步实验验证。
MyoD是生肌调节因子家族中的成员之一,在胚胎发育过程中,MyoD决定着干细胞向肌细胞方向定向分化,并参与SC的激活与分化。Grace等在论文中阐述,损伤后的骨骼肌再生与修复都受成肌调节因子MyoD影响,而MyoD参与SC的激活和分化。CooPer等通过实验证实小鼠骨骼肌再生修复时,SC被激活早期表达MyoD,随后所有增生的SC均表达MyoD。此次试验,不同负荷组MyoD表达峰值要早于SC激活数目的峰值。损伤修复过程中MyoD参与SC的激活和分化。MyoD在骨骼肌损伤后即刻表达,并先于SC到达峰值,本次研究中,n组:损伤之后MyoD即开始表达,在1d时表达达到高峰,M组MyoD的表达要低于N组及H组,说明M组骨骼肌具有较强抗损伤能力并对运动负荷产生适应,与门杰研究结果相符。在7d之后M组、N组myoD表达都趋于S组,而H组还是很高,说明H组存在肌肉反复损伤的可能。T组:具有和n组大体一致的趋势,7d以后基本都恢复到S组。不同负荷组的T组,n组相比较,T组的MyoD表达都要低于n组,说明药物治疗之后加速了SC的激活及肌纤维的修复与再生。
运动损伤修复主要是由SC激活、分化来完成的,本次研究中,不同负荷组运动后即刻至运动后1d大鼠骨骼肌SC与对S比较无差异(P>0.05),说明运动后0d、1dSC激活受到抑制,各组SC数量在7d达到峰值,然后呈下降趋势,此结果与孙茹研究结果相符,说明运动后SC激活存在时程延迟现象或者某些因素抑制了SC的激活,延迟激活或者抑制因素还有待实验验证。不同负荷组M组SC激活数量最多,说明M组具有很好的抗损伤能力。不同负荷组的T组,n组相比较,T组的SC表达都要高于n组,说明药物治疗之后加速了炎性反应的消除和肌纤维的修复。本实验结果提示,药物治疗骨骼肌损伤可以更快地激活SC,并加速其分化、增殖,这为骨骼肌损伤修复提供了重要的实验基础。
4结论
(1)不同负荷运动引起的骨骼肌损伤形态学表现在0d、1d较为严重,与MyoD表达变化趋势一致,但MyoD表达存在差异,SC的激活数量与形态学变化相反,即损伤最严重时SC表达受到抑制,MyoD和SC变化可能与运动负荷强度不同或激活机制有关。
(2)云南白药在损伤过程中缩短炎症反应时间,加快了SC的激活与损伤修复,同时影响MyoD表达,这种影响对于损伤修复有积极作用,MyoD表达和SC激活存在线性关系,即一定的MyoD表达促进SC的表达,过多的MyoD会抑制SC激活,MyoD和SC可以作为骨骼肌损伤后恢复程度的一个间接指标。
(3)中等负荷运动最适宜运动损伤后的修复,但中等强度运动与田径训练理论存在一定矛盾,不能取得预期的运动成绩。所以中等负荷运动只适合大众健身和指导康复性训练。endprint
