芹菜籽中黄酮的提取工艺
2015-10-21徐斌马洪波张岚葛红娟
徐斌,马洪波,张岚,葛红娟
(吉林医药学院公共卫生学院,吉林吉林132013)
芹菜籽中黄酮的提取工艺
徐斌,马洪波*,张岚,葛红娟
(吉林医药学院公共卫生学院,吉林吉林132013)
探讨芹菜籽黄酮类成分的最佳提取工艺,为芹菜籽的开发和利用提供理论依据。以甲醇为提取溶剂,采用索式提取法从芹菜籽中提取黄酮类物质成分,以芦丁为对照品,采用紫外分光光度法进行测定。通过单因素试验,影响黄酮提取率的因素主次顺序为:料液比>提取时间>甲醇浓度>提取温度。芹菜籽中黄酮的最佳提取工艺条件下芹菜籽黄酮粗品的提取率为13.54(%)。索式提取法提取芹菜籽中黄酮是中切实可行的方法。
芹菜籽;黄酮;索式提取法
黄酮类化合物是一类结构相似,功能相近的抗氧化剂,根据分子结构不同,主要分为四种,分别为:黄酮、黄烷酮、儿茶素、花色苷。其生理特性取决于其结构中含双键的芳香环,特别是与芳香环的失电子有关[1]。伞形科植物芹菜[2]在维吾尔医药中应用广泛并已颁布标准,已记载于《中华人民共和国卫生部〈药品标准〉维吾尔药分册》和《维吾尔药志》等书籍,是新疆资源丰富的药食兼用植物资源[3-4]。
芹菜,属伞形科植物。有水芹、旱芹两种,功能相近,药用以旱芹为佳。旱芹香气较浓,又名“香芹”,亦称“芹菜”。芹菜是高纤维食物,它经肠内消化作用产生一种木质素或肠内脂的物质,这类物质是一种抗氧化剂,常吃芹菜,对预防高血压、动脉硬化等都十分有益,并有辅助治疗作用。近年来国内外对芹菜的研究主要是对地上部分的挥发油和黄酮类成分抗肿瘤和心血管病等的研究上,体外和动物实验表明芹菜全草含有的黄酮类、丁基苯酞类、氨基酸、不饱和脂肪酸等多种成分都具有降血压、降血脂的生理功能[5]。新疆维医临床中以旱芹的根和籽入药,认为其性干热,具健脑安神、活血痛经、祛风除湿之功能;常用于头晕头痛,四肢麻木,高血压,清胃中浊夜和风湿病症,是多种护肝降压维成药制剂的主要药味[6]。
国内大多实验均针对芹菜的根、茎、叶中黄酮类化合物的提取或芹菜籽精油的提纯提出相关的研究报道,但是研究较少涉及对芹菜籽中黄酮类化合物的提取[7]。本实验以甲醇为提取溶剂,采用索式提取法从芹菜籽中提取黄酮类物质成分,以芦丁为对照品,采用紫外分光光度法进行测定,探讨芹菜籽黄酮类成分的最佳提取工艺,为芹菜籽的开发和利用提供理论参考。
1材料与方法
1.1 材料与试剂
芹菜籽:购于吉林市欣源食品有限公司,粉碎过40目筛;芦丁标准品:天津一方科技有限公司,甲醇、乙醚、硝酸铝、氢氧化钠、亚硝酸钠以上均为分析纯:天津市大茂化学试剂厂生产。
1.2 仪器与设备
旋转蒸发仪(RE-52AA):上海亚荣生化仪器厂;循环水式多用真空泵(SHB-ⅢA):上海豫康科教仪器设备有限公司;台式低温离心机(TD5A):湖南凯达科学仪器有限公司;中草药粉碎机(ZN-500A):长沙市岳麓区中南制药机械厂;电子分析天平(FA1104N):上海精密科学仪器有限公司;电热恒温水浴锅(HHS-21-4):上海博讯实业有限公司医疗设备厂;电热恒温干燥箱(202-1AB):天津市泰斯特仪器有限公司;紫外-可见分光光度计(UV1800):日本岛津公司。
1.3 方法
1.3.1 粗黄酮提取工艺
芹菜籽→脱脂→热水浸提→抽滤→浓缩→加甲醇溶液→静置过夜→离心10 min(3 000 r/min)→沉淀溶解定容→脱质蛋白质、脱色→测定。
将芹菜籽除杂,放入干燥箱中60℃干燥至恒重,用中药粉碎机粉碎成粉末,过40目筛。乙醚脱脂,样品至于干燥箱中60℃烘干至恒重,备用。
准确称取5份粉碎的芹菜籽样品各1.000 0 g置于250 mL圆底烧瓶中,以料液比1∶30向其中加入体积分数为40%的甲醇溶剂,设定提取温度为60℃,回流提取,冷至室温,过滤,滤液离心10 min,经旋转蒸发浓缩至干,并用相同体积的甲醇将其溶解,然后精密吸取1 mL至25 mL容量瓶中。依次加入显色剂后定容至刻度,在484 nm处进行吸光度测定。
1.3.2 单因素试验
用单因素实验方法对影响芹菜籽中黄酮提取率的4个因素即提取时间、提取温度、料液比、甲醇浓度进行考察。用分光光度计测定484 nm处吸光度值,作为黄酮提取率的指标。
1.3.2.1 提取时间的选择
料液比30 g/mL,体积分数为40%的甲醇溶剂,提取时间分别为1、1.5、2、2.5、3 h,重复3次,取平均值,确定提取的最佳时间。
1.3.2.2 提取温度的选择
料液比30 g/mL,体积分数为40%的甲醇溶剂,分别在40、50、60、70、80℃条件下,提取1 h,重复3次,取平均值,确定提取的最佳温度。
1.3.2.3 料液比的选择
料液比为20、25、30、35、40 g/mL,加入体积分数为40%的甲醇溶剂,提取温度为最佳提取温度,提取1 h,重复3次,取平均值,确定提取的最佳料液比。
1.3.2.4 甲醇体积分数的选择
以最佳的提取时间,最佳的提取温度,最佳的料液比,体积分数为20、40、60、80、100%的甲醇溶剂,重复3次,取平均值,确定提取的最佳甲醇体积分数。
1.3.3 正交试验设计
在单因素实验的基础上同,以提取时间、提取温度、料液比、甲醇体积分数4个条件为考察因素,采取三水平四因素L9(34)正交表正交试验,以吸光度为考察目标,筛选最佳提取条件。正交试验设计表见表1。
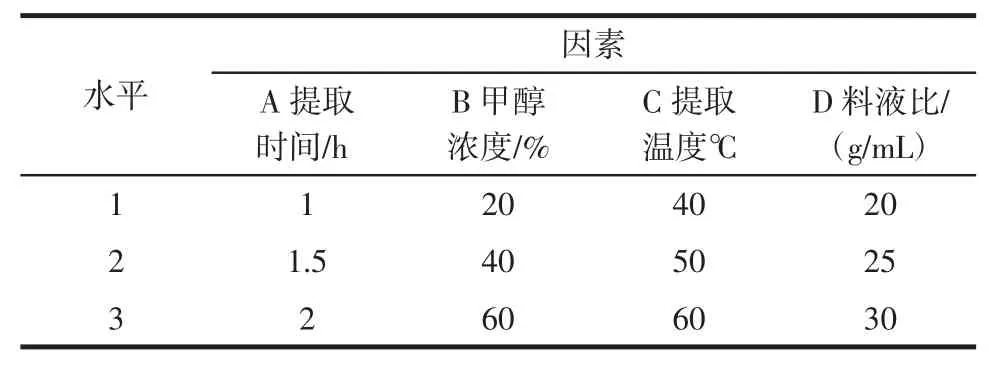
表1 正交试验设计表Table 1Design of orthogonal test
1.3.4 黃酮含量的测定
1.3.4.1 标准曲线的绘制
芦丁标准曲线的制备:精密称取干燥至恒重的芦丁对照品0.005 g,置于25 mL容量瓶中,加甲醇适量置水浴上微热使之溶解,放冷并稀释至刻度,摇匀,即得0.2mg/mL芦丁标准品。备用。移取芦丁溶液1.00 mL于25 mL容量瓶中,加入5 mL蒸馏水后摇匀,然后按顺序依次加入显色剂:1.00 mL质量分数5%的亚硝酸钠溶液,摇匀静置8 min;1.00 mL质量分数10%的硝酸铝溶液,摇匀静置6 min;加入10 mL质量分数4%的氢氧化钠溶液,再加水稀释至刻度,摇匀,放置15 min。用蒸馏水定容,以试剂空白为参比,用紫外分光光度计在200 nm~600 nm范围内进行吸光度扫描,2次扫描重复平均,最大特征吸收峰为484 nm。
标准曲线的制作:分别移取芦丁溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL置于25 mL容量瓶中,依次加入蒸馏水6.0、5.0、4.0、3.0、2.0、1.0、0.0 mL,摇匀后,按顺序依次加入显色剂:1.00 mL质量分数5%的亚硝酸钠溶液,摇匀静置8 min;1.00 mL质量分数10%的硝酸铝溶液,摇匀静置6 min;加入10 mL质量分数4%的氢氧化钠溶液,再加水稀释至刻度,摇匀,放置15 min。用蒸馏水定容,以试剂空白为参比,在484nm处测吸光度,以浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.4.2黃酮含量的测定
取0.6 mL上述过滤液后的样品溶液置于25 mL容量瓶中,按顺序依次加入显色剂:1.00 mL质量分数5%的亚硝酸钠溶液,摇匀静置8 min;1.00 mL质量分数10%的硝酸铝溶液,摇匀静置6 min;加入10 mL质量分数45的氢氧化钠溶液,再加水稀释至刻度,摇匀,放置15 min。用蒸馏水定容,以试剂空白为参比,在484 nm处测吸光度。
1.3.5 粗黄酮提取率计算
黄酮类物质提取率(%)=(n×C×V)/(m×1 000)× 100%
式中:C为样品中相当于标准芦丁浓度,(mg/ mL);V为提取物溶液体积,mL;n为稀释倍数;m为样品质量,mg。
2结果
2.1 单因素试验
2.1.1 提取时间的选择
提取时间对芹菜籽黄酮提取率的影响见图1。

图1 提取时间对提取率的影响Fig.1The influence of extraction time on extraction yield
由图1可知,随着提取时间的延长,提取率呈现逐渐增大的趋势,在2 h有一个明显高峰,过后提取率反而下降,故最佳摄取时间为2 h。
2.1.2 提取温度的选择
提取温度对芹菜籽黄酮提取率的影响见图2。

图2 提取温度对黄酮提取率的影响Fig.2The influence of extraction temperature on the extraction yield of flavonoids
由图2可知,随着提取温度的上升,芹菜籽中黄酮的提取率呈现逐渐增大的趋势,但当温度超过60℃后,提取率会有所下降,随着温度的继续升高会使溶剂少量挥发,杂质溶出量增加,会破坏黃酮生物活性,色泽加深,黏度增大,最佳提取温度为60℃。
2.1.3 料液比的选择
料液比对芹菜籽黄酮提取率的影响见图3。

图3 料液比对黄酮提取率的影响Fig.3The influence of ratio between material and extracting solutio on extraction yield of flavonoids
由图3可知,料液比30 g/mL时的黃酮的提取率与20、25 g/mL之间的差别较大。随着料液比的增加,黄酮的提取率不断地下降,选取料液比为30 g/mL。
2.1.4 甲醇体积分数的选择
甲醇体积分数对芹菜籽黄酮提取率的影响见图4。
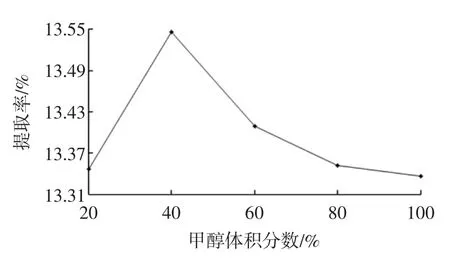
图4 甲醇体积分数对黄酮提取率的影响Fig.4The influence of methanol volume fraction on extraction yield of flavonoids
由图4可知,甲醇体积分数为40%时,有一个明显高峰,过后随着甲醇体积分数的增大提取率反而下降,选取甲醇体积分数为40%。
2.2 正交试验
三水平四因素正交试验结果见表2。方差分析见表3。
极差分析可以看出,RD>RB>RA>RC,即料液比是芹菜籽黄酮提取的最重要因素,料液比例改变对芹菜籽黄酮的提取率影响最大,其次是甲醇浓度,再者是提取时间,最后是提取温度。通过正交试验优化甲醇回流提取芹菜籽中黄酮最佳条件为A1B1C1D1,即20%甲醇为提取溶剂,料液比为30 g/mL时,40℃提取1 h,此时芹菜籽黄酮提取率最高,为14.635%。

表2 正交试验结果Table 2Result of orthogonal test

表3 正交试验结果方差分析表Table 3One-way ANOVA of orthogonal test
由方差分析可知除提取温度对芹菜籽黄酮的提取的影响差异不显著外,其余因素P值均小于0.05,差异显著,且方差分析结果与极差分析结果一致,对芹菜籽黄酮提取率影响从大到小的因素依次为D>B>A>C,说明在工艺生产中改变提取溶剂及用料的比例对芹菜籽黄酮提取率影响最大,其次为甲醇浓度、提取时间,而在工业生产中改变提取温度对结果影响不大,考虑到生产成本应选用较低的提取温度,降低能耗,节约成本。
3讨论
本实验选用芦丁作为对照品,一方面因为芦丁是黄酮类化合物中比较有代表性的一种,可以通过测定芦丁对照品的吸光度从而求算出样品中黄酮的含量,这是黄酮含量测定实验中比较经典的方法。另一方面,芦丁经紫外分光光度计在200 nm~600 nm范围内进行吸光度扫描,2次扫描重复平均,得最大特征吸收峰为484 nm,可作为定性和定量的依据。
对芹菜籽中黄酮进行提取时,分别从甲醇浓度、料液比、提取时间、提取温度等4个方面对提取率的影响来考察。在进行单因素试验时得出如下结论:甲醇浓度为40%、料液比为30 g/mL、提取时间2 h、提取温度为60℃,芹菜籽中黄酮的提取率分别达到最高。
在上述单因素试验的基础上选用甲醇浓度,料液比,提取时间,提取温度这4个主要因素作为考察变量,每个因素上选择3个考察水平,进行三水平四因素正交试验,每个提取工艺的组合进行3次实验,最终将实验结果取平均值。通过正交试验确定了芹菜籽中黄酮类化合物提取的最佳提取工艺条件为A1B1C1D1。
实验结果表明,甲醇回流提取芹菜籽中黄酮过程操作简便可行,可作为芹菜籽中黄酮含量测定的方法。黄酮类化合物提取溶剂最常用的是甲醇和乙醇,以渗漉法、浸渍法、回流法、连续回流法提取。90%左右的醇适宜于提取黄酮苷元;60%左右的醇适宜于提取黄酮苷类[8]。孔令明等[9]采用乙醇为浸提溶剂从枸杞中提取黄酮类化合物,通过单因素试验和正交试验确定枸杞中黄酮类化合物最佳提取条件下黄酮提取率可达0.946%。姜笑寒等[10]也用醇提取法提取去油后的芹菜籽中的黄酮成分的方法具有可行性,为芹菜籽中黄酮类化合物的开发利用提供技术支持,章宏慧等[11]认为芹菜黄酮中芹菜素、槲皮素、山奈酚、木犀草素等含量较高,经研究发现芹菜黃酮具有较高的生物活性,包括抗氧化活性,抗癌活性,抗心血管疾病以及在生殖系统方面可抑制性激素的分泌等功效。在国外,烘干的芹菜叶粉末可用于制造抗菌剂、除臭剂、洗涤剂肥皂、牙膏等因为它可以阻止脂质过氧化物的形成、抗炎症及抗衰老[11]。
总之,芹菜无论叶、径、籽都有药用价值,常食芹菜对孕妇、缺铁性贫血、高血压及肝病患者恢复健康有辅助治疗作用;黃酮类有效物质,对人类的健康更大有益处,并减少因用药物治疗带来的不良影响。从植物中提取黄酮类化合物也成为现代食品工业发展的主要趋势,从而推动种植业的大力发展发展,对于芹菜这种药食两用蔬菜,不因丰产而降价,保证了种植者的稳定收入,无论种植业还是加工业都有广阔的发展前景,会带来巨大的经济效益和社会效益。
[1]钟建青,李波,贾琦,等.天然黄酮类化合物及其衍生物的构效关系研究进展[J].药学学报,2011,46(6):622-630
[2]中华人民共和国卫生部药品标准.维吾尔药分册[S].乌鲁木齐:新疆科技卫生出版社,1990:136-138
[3]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品质量标准维吾尔药分册[M].北京:科技卫生出版社,1999:84-85
[4]刘勇民,沙吾提·伊克木.维吾尔药志[M].乌鲁木齐:新疆人民出版社,1986:78-80
[5]王海娣,刘艾林,杜冠华.芹菜素药理作用的研究进展[J].中国新药杂志,2008,17(18):1561-1565
[6]梁华,夏薇,苑林宏,等.芹菜提取物对自发性高血压大鼠血压及高脂模型大鼠血脂的影响[J].疾病控制杂志,2005,9(2):97-99
[7]吕金良,牟新力.维药芹菜籽化学成分研究[J].时珍国医国药,2006,17(1):6-7
[8]张桂,畅天狮.芹菜中提取黄酮类物质的研究[J].食品科学,2002,21(8):121-125
[9]孔令明,李芳,荣兴成.枸杞中黄酮类化合物的提取研究[J].食品研究与开发,2008,9(8):45-48
[10]姜笑寒,孟清,刘莉兰,等.芹菜籽中黄酮成分的提取纯化及LCMS检测[J].中国卫生产业,2013(22):8-9
[11]章宏慧,陈况况,陈健初.芹菜中黃酮类化合物及其生物活性研究进展[J].食品工业科技,2013,34(13):388-391
The Extraction Process of Flavonoids in Celery Seed
XU Bin,MA Hong-bo*,ZHANG Lan,GE Hong-juan
(Department of Public Health,Jilin Medical College,Jilin 132013,Jilin,China)
Investigate the best extraction technology of flavonoids ingredients in celery seed,to provide theoretical basis for the development and utilization of celery seeds.Using methanol as extraction solvent,adopting soxhlet extraction to extract flavonoids ingredients from celery seed,as rutin For comparison,using ultraviolet spectrophotometric method for determination.By means of single factor experiment the primary and secondary order of influencing factors of the extraction yield of flavonoids:ratio between material and extracting solutio>extraction time>methanol concentration>extraction temperature.Under the optimum extraction technology conditions flavonoids extraction yield in raw celery seed was 13.54(%).Soxhlet extraction to extract flavonoids in celery seed was feasible method.
celery seed;flavonoids;soxhlet extraction
10.3969/j.issn.1005-6521.2015.09.017
2014-01-06
徐斌(1972—),男(汉),副教授,硕士,主要从事慢性病的营养防治和保健品研发。
*通信作者:马洪波(1969—),男(汉),副教授,硕士,主要从事慢性病的营养防治研究。
