超声波辅助提取鲜枸杞色素
2015-10-21孙建霞吕昭伟文罗娜白卫滨宋烨和法涛赵岩朱风涛
孙建霞,吕昭伟,文罗娜,白卫滨,*,宋烨,和法涛,赵岩,朱风涛
(1.广东工业大学轻工化工学院,广东广州510090;2.暨南大学食品科学与工程系,广东广州510632;3.中华供销合作总社济南果品研究院,山东济南250014)
超声波辅助提取鲜枸杞色素
孙建霞1,吕昭伟1,文罗娜2,白卫滨2,*,宋烨3,和法涛3,赵岩3,朱风涛3
(1.广东工业大学轻工化工学院,广东广州510090;2.暨南大学食品科学与工程系,广东广州510632;3.中华供销合作总社济南果品研究院,山东济南250014)
以中宁鲜枸杞为原料,β-胡萝卜素提取液吸光度为衡量指标,研究超声波辅助提取枸杞色素的工艺,通过单因素-正交试验优化提取工艺参数。通过单因素试验研究了提取溶剂、温度、料液比、时间、功率和提取次数对色素提取率的影响,并确定了提取剂为正己烷,提取次数为1次。通过正交试验得出超声波辅助提取枸杞色素的最佳工艺为:超声波功率为200 W,提取时间40 min,提取温度50℃,料液比为1∶30(g/mL)。在最优工艺条件下,β-胡萝卜素得率为8.45%,色素粗提物得率为9.93%,色素粗提物纯度为85.00%。
枸杞;超声波;类胡萝卜素;正交试验
枸杞(Lycium Barbarum)是茄科枸杞属植物,分布广泛,以宁夏枸杞品质最好。类胡萝卜素是枸杞的主要色素,其中β-胡萝卜素最为突出。类胡萝卜在遇酸、遇氧、强光照及高温条件下不稳定,易降解或异构化,在碱性条件下一般较为稳定[1-2]。富含类胡萝卜素的食品具有防治维生素A缺乏症[3]、防自由基损害[4]、防癌抗癌[5-6]、提高免疫力[7]、预防心血管疾病[8]等功效[9]。
近年来,天然类胡萝卜素制品的需求量不断增加,类胡萝卜素的开发利用具有良好的市场前景[10]。枸杞是自然界中β-胡萝卜素含量最高的品种之一,对枸杞中β-胡萝卜素提取,进行产品综合利用开发具有重要意义。目前,类胡萝卜素的提取多以干枸杞为原料使用溶液加热浸提法,但浸提过程中的高温会使枸杞种活性成分的稳定性变差,在加工过程中易发生变性,形成大量絮状物和沉淀物,造成有效成分的大量损失,并且使其活性也有所降低,同时,溶剂浸提方法还存在着溶剂使用量大、溶剂残留、浸提时间过长等缺点[11]。而采用超声场强化有效成分的提取,具有降低提取温度、缩短时间和提高提取率等优点,日益受到人们的重视[12]。因此,有必要发展高效、节约资源的超声波辅助提取枸杞色素的方法。
本文应用超声波辅助提取技术提取鲜枸杞类胡萝卜素,以分光光度法测定其含量,并通过单因素-正交实验对影响提取率的多个因素进行优化选择,取得最佳提取参数,为枸杞的综合开发利用和植物体天然类胡萝卜素的提取提供了一定的理论参考。
1材料与方法
1.1 材料与试剂
中宁鲜枸杞:产于夏宁中宁县;正己烷(分析纯):天津大茂化学试剂厂;石油醚(分析纯)、三氯甲烷(分析纯):天津永大化学试剂有限公司;β-胡萝卜素(标准品,纯度≥95%):马拉丁化工有限公司。
1.2 仪器与设备
超声波细胞粉碎机JY92-IIN:宁波新芝生物科技股份有限公司;电子天平DENVER INSTRUMENT:北京赛多利斯仪器系统有限公司;722型可见分光光度计:上海舜宇恒平科学仪器有限公司;SHB-Ⅲ循环水式多用真空泵:上海比朗仪器有限公司;旋转蒸发器RE-52AA:上海振捷实验设备有限公司;密封型摇摆式高速粉碎机:CLF-10C浙江省温岭市创力药材器械厂;干燥箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 工艺流程
鲜枸杞→研磨成浆→加提取剂→超声波处理→离心→过滤→旋转增发浓缩→干燥(40℃)→色素粗提物
鲜枸杞洗净,沥干,放入粉碎机研磨均匀成浆。取一定量的枸杞浆,加入适量提取剂,置于超声波细胞粉碎机中进行超声波辅助提取一定时间,经旋转蒸发仪真空浓缩后,置于干燥箱充分干燥,得到色素粗提物,称其干重。加正己烷溶解色素粗提物并按一定倍数稀释,以正己烷为对照,在最大吸收波长下测其吸光度,通过标准曲线和回归方程可计算出样品的类胡萝卜素含量。
1.3.2 提取溶剂的选择
根据超声波辅助提取特性及提取剂毒性及成本,分别研究石油醚,三氯甲烷,正己烷和石油醚-三氯甲烷(1∶1,v/v)不同提取溶剂对β-胡萝卜素提取效果的影响。选择提取效果最好的正己烷作为溶剂。
1.3.3 最大吸收波长的确定
β-胡萝卜素标准品于40℃干燥至恒重,精密称取10.0 mg,以正己烷溶解并定容至25 mL,制成0.4 mg/mL的β-胡萝卜素标准溶液。精密吸取5 mL的标准品溶液以正己烷定容至10 mL容量瓶中,配制0.2 mg/mL的β-胡萝卜素标准溶液,以正己烷为空白对照,在200 nm~600 nm波长范围内进行扫描,得到最大吸收波长为450 nm。
1.3.4 标准曲线的绘制
分别取0.4 mg/mL的β-胡萝卜素标准溶液1、2、3、4、5、6 mL于25 mL容量瓶中,以正己烷定容,得到0.016、0.032、0.048、0.060、0.072、0.084、0.096 mg/mL一系列浓度的β-胡萝卜素的标准溶液。在450 nm处测其吸光度,以EXCEL绘制标准曲线,得回归方程为:y=3.673 2-0.021 2,R2=0.995 3。
1.3.5 粗提物β-胡萝卜素得率计算
通过标准曲线得到提取液中胡萝卜素浓度,计算得到枸杞样品中的粗提物β-胡萝卜素得率:
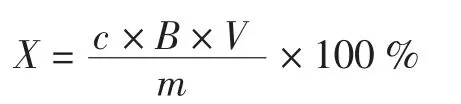
式中:X为鲜枸杞样品中的粗提物类胡萝卜素得率;c为标准曲线上对应浓度,(mg/mL);B为稀释倍数;V为提取液体积,mL;m为样品原料鲜重,mg。
1.3.6 色素粗提物提取率计算
色素粗提物提取率(%)=色素粗提物质量/鲜枸杞质量×100%
1.3.7 色素粗提物纯度计算

1.3.8 超声波提取条件优化
1.3.8.1 单因素试验
根据超声波辅助提取特性和相关文献报道[13],选取液料比、超声波温度、功率、提取时间及提取次数进行单因素试验。其中,液料比选取1∶10,1∶20,1∶30和1∶40(g/mL)共4个水平,超声波温度选取35、40、45、50℃共4个水平,超声波功率选取200、220、240、260 W共四个水平,提取时间选取10、20、30、40、50 min共5个水平,提取次数选取1、2、3、4次共4个水平。
1.3.8.2 正交试验
在单因素试验的基础上,选取温度、时间、功率和料液比4个主要影响因素,采用正交设计试验组合L9(34)正交试验,对多因子综合影响因素进行研究[17]。再由极差分析与方差分析进一步优化提取工艺参数,得到综合参数。
2结果与分析
2.1 提取溶剂的选择
精确称取粉碎的4份枸杞样品5.00 g于250 mL烧杯,按料液比1∶30分别加入有机溶剂石油醚,三氯甲烷,正己烷和石油醚-三氯甲烷(1∶1,体积比),在200 W的超声波功率下,40℃超声提取20 min,在最大吸收波长下,测定提取液的吸光度,结果见表1。

表1 不同提取剂对β-胡萝卜素提取率的影响Table 1Effect of extractant on extraction yield of β-carotene
正己烷对枸杞色素的溶解度最高,提取效果最好,三氯甲烷、石油醚-三氯甲烷次之,最后是石油醚,故本实验选择正己烷为提取剂。
2.2 单因素试验
2.2.1 料液比对类胡萝卜素提取效果的影响
准确称取4份10.00 g鲜枸杞浆,分别按料液比1∶10、1∶20、1∶30、1∶40(g/mL)加入正己烷,在温度40℃,超声波功率200 W条件下,提取30 min,1次。450 nm测定色素粗提物的正己烷溶液的吸光度,结果如图1。
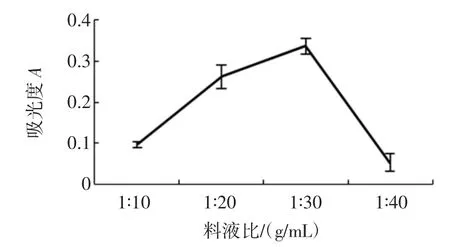
图1 料液比对β-胡萝卜素提取率的影响Fig.1Effect of the solvent:sample ratio on extraction yield of βcarotene
随着料液比增大,提取液吸光度先增大再减小,在1∶30时达到最大。料液比低于1∶30时,色素溶解度随液料比增大而增大,当料液比超过1∶30时,由于色素已全部溶出,而提取液的体积过大,导致色素溶液浓度降低,吸光度下降。
2.2.2 提取温度对类胡萝卜素提取效果的影响
准确称取4份5.00 g鲜枸杞浆,加入150 mL正己烷,超声波功率为200 W,分别在温度为35、40、45、50℃下提取30 min,1次。450 nm测定色素粗提物的正己烷溶液的吸光度,结果如图2。
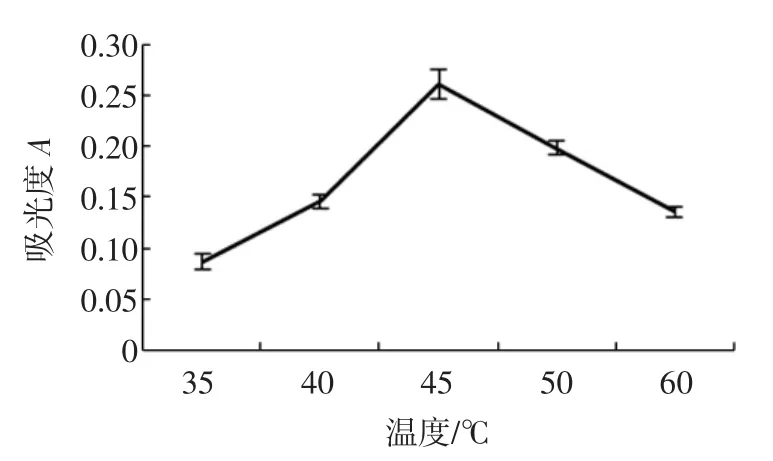
图2 提取温度对β-胡萝卜素提取率的影响Fig.2Effect of sonication temperature on extraction yield of βcarotene
随着温度升高,提取液吸光度先增大再减小,在45℃时达到最大。适宜的高温有利于增加色素溶解度,但过高的温度可能会引起枸杞色素的热降解,色素得率会受到影响[14]。
2.2.3 超声波功率对类胡萝卜素提取效果的影响
准确称取4份5.00 g鲜枸杞浆,加入150 mL正己烷,在40℃下,分别于超声波功率为200、220、240、260 W提取30 min,1次。450 nm测定色素粗提物的正己烷溶液的吸光度,结果如图3。
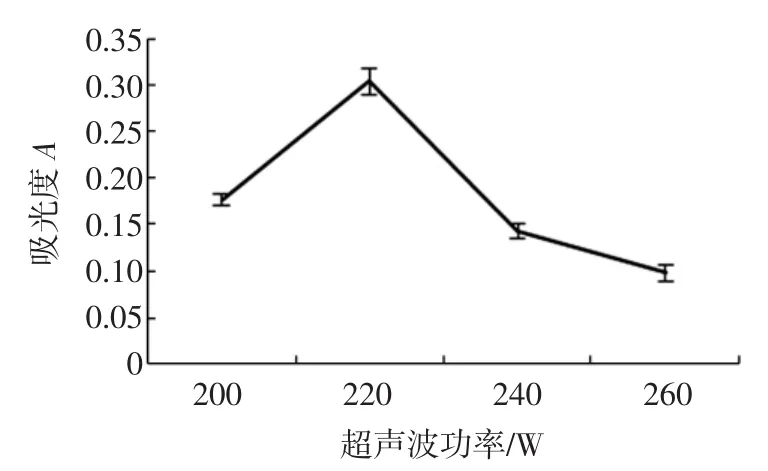
图3 超声波功率对β-胡萝卜素提取效率的影响Fig.3Effect of ultrasonic power waves on extraction yield of βcarotene
在超声波场中,声波产生的空穴效应可造成细胞壁和细胞膜破碎,促进色素溶出[10]。随着超声波功率增大,提取液吸光度线增大再减小,在220 W时达到最大。超声波功率较低时,可提高色素提取率,但在220 W~260 W之间提取率随功率增加而减少,可能是超声波作用过于强烈或超声波处理导致的温度升高造成了β-胡萝卜素氧化降解,类胡萝卜素提取效率降低。2.2.4提取时间对类胡萝卜素提取效果的影响
准确称取5份5.00 g鲜枸杞浆,加入150 mL正己烷,在40℃下,超声波功率为200 W,分别在时间为10、20、30、40、50 min下提取1次。450 nm测定色素粗提物的正己烷溶液的吸光度,结果如图4。

图4 提取时间对β-胡萝卜素提取效率的影响Fig.4Effect of extraction time on extraction yield of β-carotene
随着提取时间增加,提取液吸光度先增大再减小,在20 min时达到最大。在少于20 min时,随着时间的增加,细胞破裂程度、加热程度也均随之增加,能使色素容易地被提取出来,所测类胡萝卜素的吸光度增大,即提取效率增加。但在20 min以后,吸光度有下降趋势,这可能是由于类胡萝卜素较长时间在较高温度下不稳定,而导致类胡萝卜素提取率略有下降趋势[15]。故20 min左右的提取时间对枸杞色素提取更有效。
2.2.5 提取次数对类胡萝卜素提取效果的影响
准确称取4份5.00 g鲜枸杞浆,加入150 mL正己烷,在40℃下,超声波功率为200 W,超声时间为30 min,分别提取1、2、3、4次。450 nm测定色素粗提物的正己烷溶液的吸光度,结果如图5。
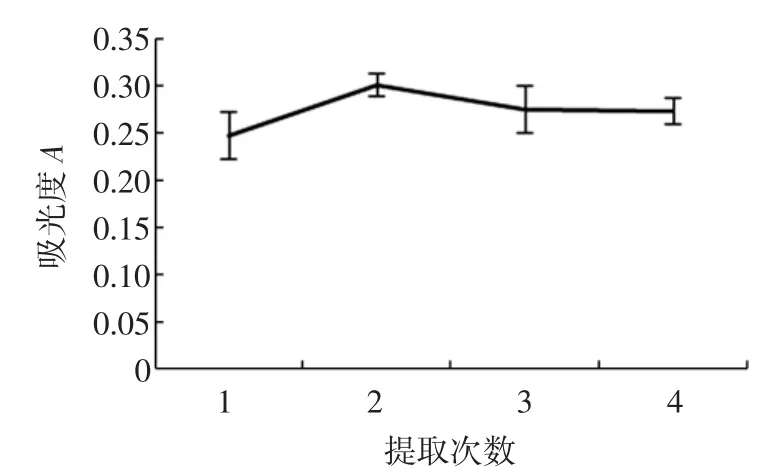
图5 时间对β-胡萝卜素提取效率的影响Fig.5Effect of time on extraction yield of β-carotene
提取次数对枸杞色素影响不大,在提取1~4次中,枸杞色素得率没有明显变化规律,相差不大,考虑到效率问题以及成本问题,在以下正交试验中,一致选用提取1次方案。
2.3 正交试验
根据单因素试验的结果,选取温度、时间、功率和料液比4个主要影响因素进行正交设计试验组合L9(34)正交试验,其因素水平表见表2,正交试验结果见表3,方差分析见表4。
通过本次超声波辅助提取鲜枸杞色素的实验设计,采用单因素-正交试验方法,由表3的R值可以看出各因素对试验结果影响的大小顺序为:A>C>B>D(温度>料液比>时间>功率)。由表3与表4的方差分析可见,温度与料液比对枸杞色素得率有显著影响,提取时间次之,即显著性分析为:A>C>B(温度>料液比>时间),对于A、B、C因素,选择最优,即A3、B3、C3,超声温度50℃,超声时间40 min,料液比1∶30(g/mL),从经济与效率角度考虑,选择D1,超声功率200 W,提取一次。所以,综上所述,本次超声波辅助提取枸杞色素最佳工作条件为A3B3C3D1,即超声温度50℃,超声时间40 min,料液比1∶30(g/mL),超声功率200 W,提取次数1次。在最优工艺条件下,β-胡萝卜素得率为8.45%,色素粗提物得率为9.93%,色素粗提物纯度为85.0 0%。
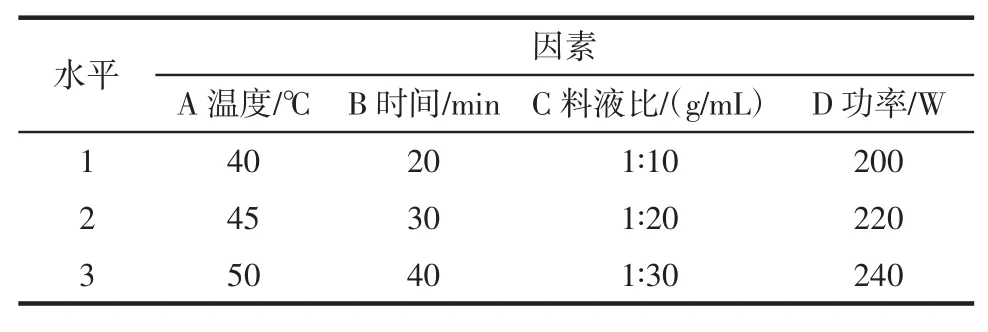
表2 因素水平表Table 2Levels and factors of orthogonal test
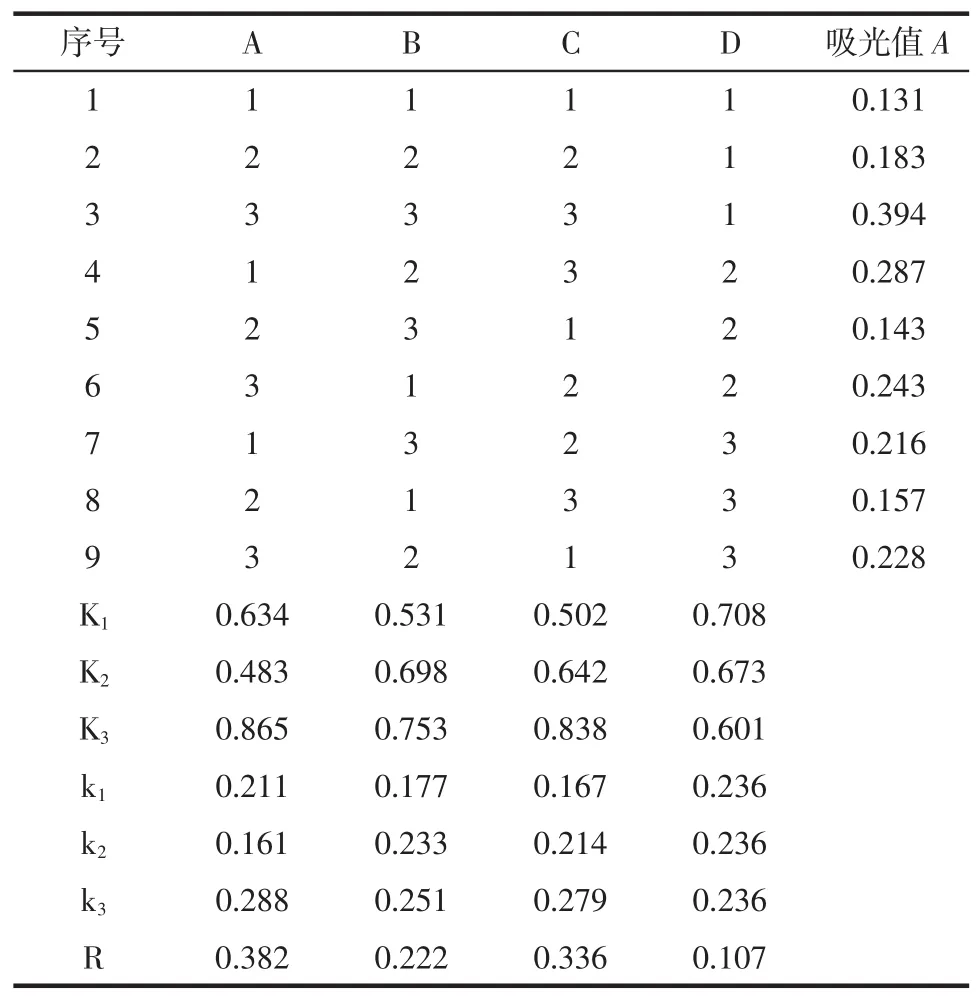
表3 正交试验设计与结果Table 3Design and results of the experiment
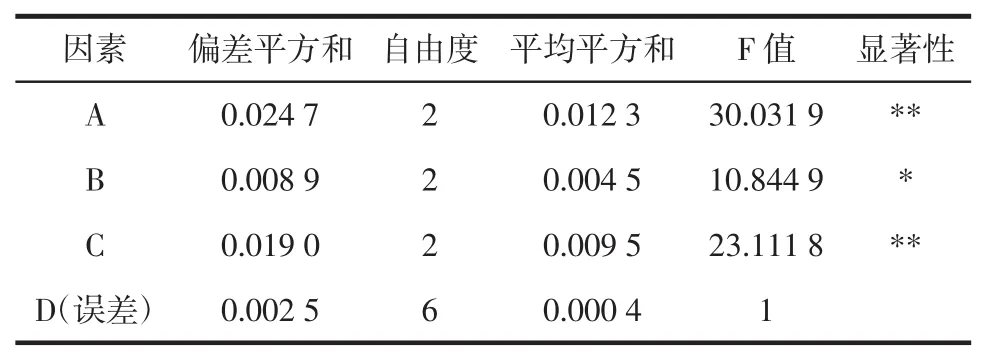
表4 正交试验结果方差分析Table 4Variance analysis
3结论
通过单因素-正交试验得出,采用超声波辅助提取鲜枸杞色素的最佳工艺条件为超声温度50℃,超声时间40 min,料液比1∶30(g/mL),超声功率200 W,提取次数1次,提取溶剂正己烷。此工艺条件下,β-胡萝卜素得率为8.45%,色素粗提物得率为9.93%,色素粗提物纯度为85.0%。
[1]李福枝,刘飞,曾晓希,等.天然类胡萝卜素的研究进展[J].食品工业科技,2007,28(9):227-232
[2]Kadian S S,Sharma A,Sood D R.Effect of Light and Heat on Stability of Crude Carotenoid Extract From Natural Sources[J].International Journal of Pharmaceutical Sciences and Research,2013,4(6):2415-2418
[3]Sommer A,Vyas K S.A global clinical view on vitamin A and carotenoids[J].The American journal of clinical nutrition,2012,96(5):1204S-1206S
[4]Böhm F,Edge R,George Truscott T.Interactions of dietary carotenoids with singlet oxygen(1O2)and free radicals:potential effects for human health[J].Acta Biochimica Polonica,2012,59(1):27
[5]Zhang X,Zhao W,Hu L,et al.Carotenoid Inhibit Proliferation and Regulate Express of Peroxisome Proliferators-Activated Receptor Gamma(PPARγ)in K562 Cancer Cells[J].Archives of Biochemistry and Biophysics,2011,512(1):96-106
[6]Satomi Y,Nishino H.Implication of Mitogen-Activated Protein Kinase in the Introduction of G1 Cell Cycle Arrest and Gadd45 Expression by the Carotenoid Fucoxanthin in Human Cancer Cell[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,2009,1790(4):260-266
[7]Hughes D A.Dietary carotenoids and human immune function[J]. Nutrition,2001,17(10):823-827
[8]Giordano P,Scicchitano P,Locorotondo M,et al.Carotenoids and cardiovascular risk[J].Current pharmaceutical design,2012,18(34):5577-5589
[9]Basu H N,Vecchio AJ Del,Flider F,et al.Nutritional and potential disease prevention properties of carotenoids[J].Journal of the American Oil Chemists' Society,2001(78):665-667
[10]贺小贤,刘昌蒙.杏皮渣中类胡萝卜素的提取工艺研究[J].现代食品科技,2013,9(3):587-590
[11]黄丽,於洪建,吴巍.枸杞中类胡萝卜素的研究进展[J].食品研究与开发,2012,33(5):233-236
[12]周会舜,罗海涛,王建兵,等.枸杞中类胡萝卜素超声波法提取工艺优化及其在卷烟中的应用研究[J].食品工业,2011(2):73-76
[13]Ofori-Boateng C,Lee K T.Response surface optimization of ultrasonic-assisted extraction of carotenoids from oil palm(Elaeis guineensis Jacq.)fronds[J].Food Science&Nutrition,2013,1(13):209-211
[14]Tai C Y,Chen B H.Analysis and Stability of Carotenoids in the Flowers of Daylily(Hemerocallis d isticha)as Affected by Various Treatments[J].Journal of agricultural and food chemistry,2000,48(12):5962-5968
[15]Qiu D,Shao S X,Zhao B,et al.Stability of β-Carotene In Thermal Oils[J].Journal of Food Biochemistry,2012,36(2):198-206
Ultrasonic-assisted Extraction of Pigment from Lycium Barbarum
SUN Jian-xia1,LÜ Zhao-wei1,WEN Luo-na2,BAI Wei-bin2,*,SONG Ye3,HE Fa-tao3,ZHAO Yan3,ZHU Feng-tao3
(1.Faculty of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou 510090,Guangdong,China;2.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,Guangdong,China;3.Jinan Fruit Research Institute All China Federation of Supply&Marketing Co-operatives,Jinan 250014,Shandong,China)
With lycium barbarum as the research object,and absorbance of extracts of β-carotene as a measure indicator,five extraction parameters during extraction of pigment from lycium barbarum assisted by ultrasonic including extractant,extraction times,ultrasonic power,extracting time,ratio of material and solvent were optimized through single factor experiments followed with orthogonal experiments.according to single factor experiments,N-hexane was chosen to be extractant and extraction times was choosen to be once.Other optimum parameters determined using orthogonal experiments were as follow:ultrasonic power 200 W,extracting time 40 min,extraction temperature 50℃and ratio of material and solvent 1∶30(g/mL).Under these conditions the yield of β-carotene,the yield of pigment,and the purity of β-carotene in pigment turned out to be 8.45%,9.93%and 85.00%,respectively.
lycium barbarum;ultrasonic-assisted extraction;carotenoids;orthogonal experiments
10.3969/j.issn.1005-6521.2015.09.011
2013-12-02
“十二五”国家科技支撑计划项目(2012BAD36B04);国家自然科学基金(31201402);山东省优秀中青年科学家科研奖励基金(BS2011NY016)
孙建霞(1978—),女(汉),讲师,博士,研究方向:果蔬加工。
*通信作者:白卫滨(1978—),男(汉),副教授,博士,研究方向:食品营养。
