盐胁迫对盐生杜氏藻生长及叶绿素荧光特性的影响*
2015-10-16王帅,梁英
王 帅,梁 英
(1.中国海洋大学海水养殖教育部重点实验室,山东 青岛266003;2.国家海洋局第一海洋研究所海洋生态研究中心,山东 青岛266061;3.中国海洋大学海洋生命学院,山东 青岛266003)
盐度是影响海洋微藻生长的重要环境因子,盐度的高低必然会促进或抑制海洋微藻的生长,直接或间接影响其光合作用和呼吸作用。大量实验结果表明[1-4],盐度会通过多条途径来影响植物光合作用,例如:离子胁迫和渗透胁迫,高盐条件下还会造成水分平衡的紊乱、影响光合电子传递效率和CO2同化作用。传统方法确定微藻生存盐度和最适生长盐度范围是通过比较微藻在不同盐度条件下的细胞密度,耗时较多[5]。为了解决这一问题,国外某些学者利用植物体内叶绿素作为天然探针,在黑暗环境中适应数分钟,然后置于适当的激发光下,通过检测植物发出的随时间变化的微弱荧光信号(Kautsky效应)来测定微藻对盐度的适应范围[6]。
利用叶绿素荧光分析技术可对植物进行活体测定和诊断,这一方法具有快速、准确和需要样品量少等优点,目前,采用叶绿素荧光分析技术研究不同盐度对高等植物光合作用影响的报道相对较多,但由于实验材料、生长阶段和处理时间等因素的不同,研究结果不太一致。Singh等[7]研究结果表明盐胁迫能促进PSII的功能;而Allakhverdiev等[8]研究发现盐胁迫会抑制PSII的功能;Qia等[9]报道盐胁迫对PSII的功能没有造成明显的影响。迄今为止,有关盐胁迫对植物叶绿素荧光特性影响已有较多的报道[10-14],但目前还未见盐胁迫对高耐盐藻株—盐生杜氏藻叶绿素荧光特性影响的报道。
盐生杜氏藻是绿藻门中唯一一种无细胞壁的单细胞海洋微藻,是高盐环境中常见藻株,具有很强的耐盐性,因其富含胡萝卜素和甘油而逐渐受到重视,近年来已被国内外广泛应用于环境胁迫的研究[15]。本文采用Water-PAM叶绿素荧光仪研究不同盐浓度对1株具有很好的耐受高盐胁迫特性的盐生杜氏藻生长及叶绿素荧光特性的影响,以期为筛选耐盐微藻藻株提供重要的方法,并为揭示盐生杜氏藻光合作用抵抗盐胁迫时的响应机制提供参考依据。
1 材料与方法
1.1 藻种
实验所用盐生杜氏藻(Dunaliella salina)(代号MACC/C43)藻种来源于中国海洋大学藻种库。
1.2 微藻培养及盐胁迫处理
培养采用f/2培养基[16],培养条件为:培养温度为(20±1)℃,光照强度为100μmol·m-2·s-1,采用连续光照进行培养。
在250mL的锥形瓶中进行盐胁迫实验,将处于指数生长期的盐生杜氏藻离心洗涤后,以2.08×104个/mL的接种量分别培养在不同盐度的培养液中,培养液盐度设定为5,10,20,30,40,50,60,70,80,90,100,110,120,130等梯度,每个盐度3个平行组。培养过程中随机调换锥形瓶并摇动3次/d。在接种12、24和48h后取样,测定盐生杜氏藻的叶绿素荧光参数、细胞密度和叶绿素含量。
1.3 叶绿素荧光参数、叶绿素含量的测定及数据处理
按照王帅等[13]的方法,采用 Water-PAM 叶绿素荧光仪进行荧光参数和叶绿素含量的测定。
采用Origin Pro8.0软件进行作图。采用SPSS11.0软件进行多因子方差分析(盐度、胁迫时间以及二者的交互作用(盐度×时间))和相关性分析。
2 结果
2.1 盐度对盐生杜氏藻叶绿素荧光参数的影响
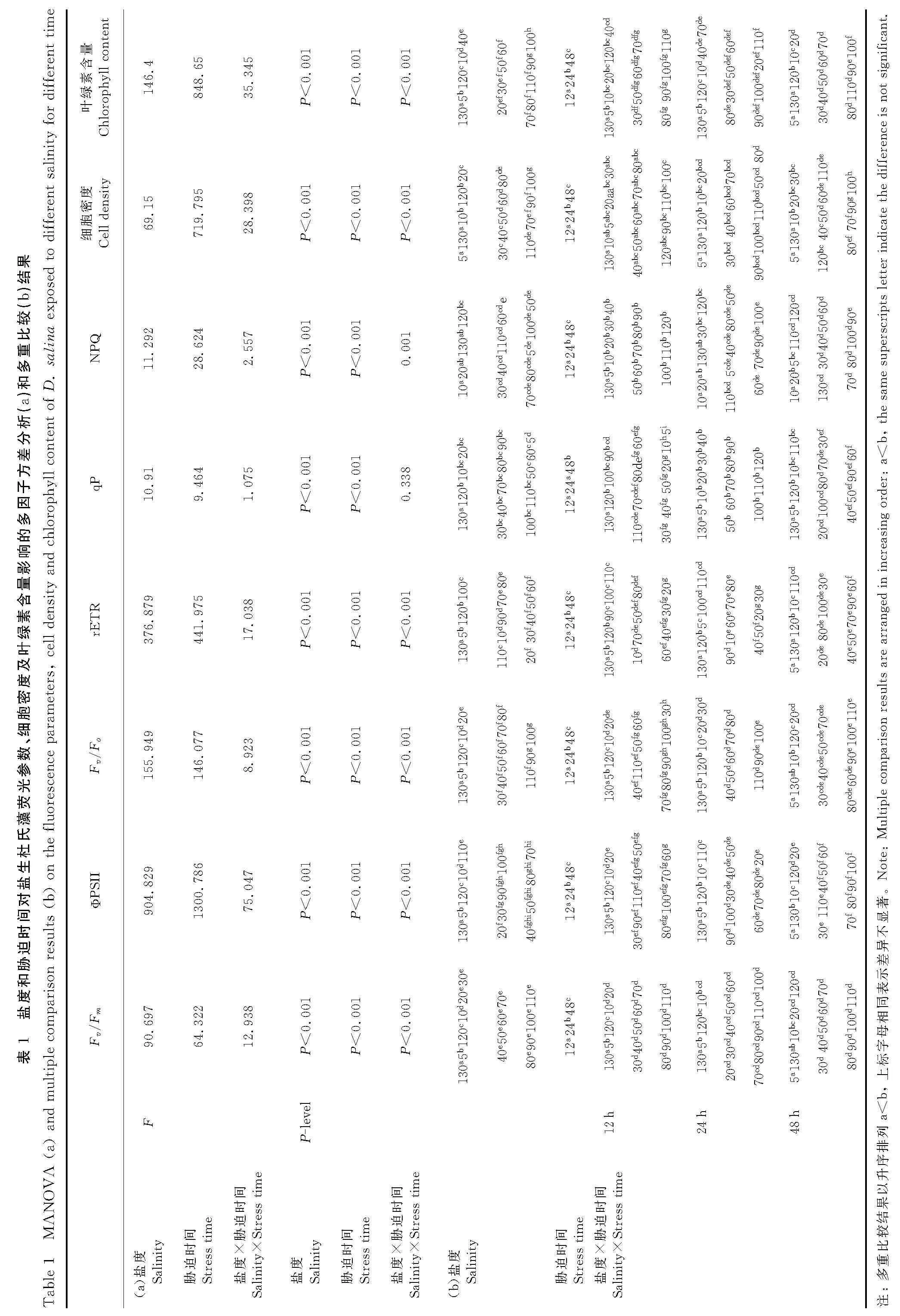
图1和表1给出了盐度和胁迫时间对盐生杜氏藻叶绿素荧光参数的影响。表1(a)的多因子方差分析结果表明,在整个培养过程中,盐度和胁迫时间对盐生杜氏藻的荧光参数 Fv/Fm、ΦPSII、Fv/Fo、rETR、qP 和NPQ均有显著影响(P<0.001),其中盐度对参数Fv/Fm、Fv/Fo和 qP 的 影 响 更 显 著,而 胁 迫 时 间 对rETR和NPQ的影响更显著。表1(b)给出的多重比较结果表明,Fv/Fm、ΦPSII和Fv/Fo值在盐度100时最高,但在盐度20~110范围内无显著性差异;rETR值在盐度为60时达到最高;qP值在盐度为5时最高;NPQ值则在盐度为90时最高。胁迫时间对该藻的上述6个荧光参数值均有显著影响,各参数值均随胁迫时间的延长而逐渐升高。
盐生杜氏藻的荧光参数与盐度之间的相关性见表2,盐度在5~70之间的范围内,胁迫12和48h后,盐生杜氏藻的Fv/Fm、ΦPSII、Fv/Fo和rETR与盐度呈极显著的正相关关系,胁迫48h后qP与盐度呈显著的正相关关系。NPQ在胁迫12h时与盐度无明显的相关性,在胁迫24和48h时,该参数与盐度呈极显著正相关;盐度在70~130范围内时,荧光参数Fv/Fm、ΦPSII、Fv/Fo、rETR 以及qP均与盐度呈极显著的负相关性;胁迫12h后,NPQ与盐度呈显著的负相关;胁迫24h后,NPQ与盐度呈极显著的负相关;胁迫48h后与盐度无明显的相关性。
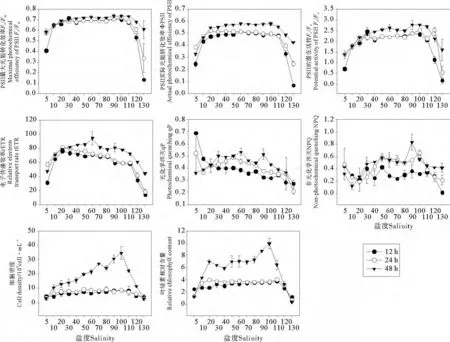
图1 盐度对盐生杜氏藻荧光参数、细胞密度和叶绿素含量的影响Fig.1 Effects of salinity on the fluorescence parameters,cell density and chlorophyll content of D.salina
?
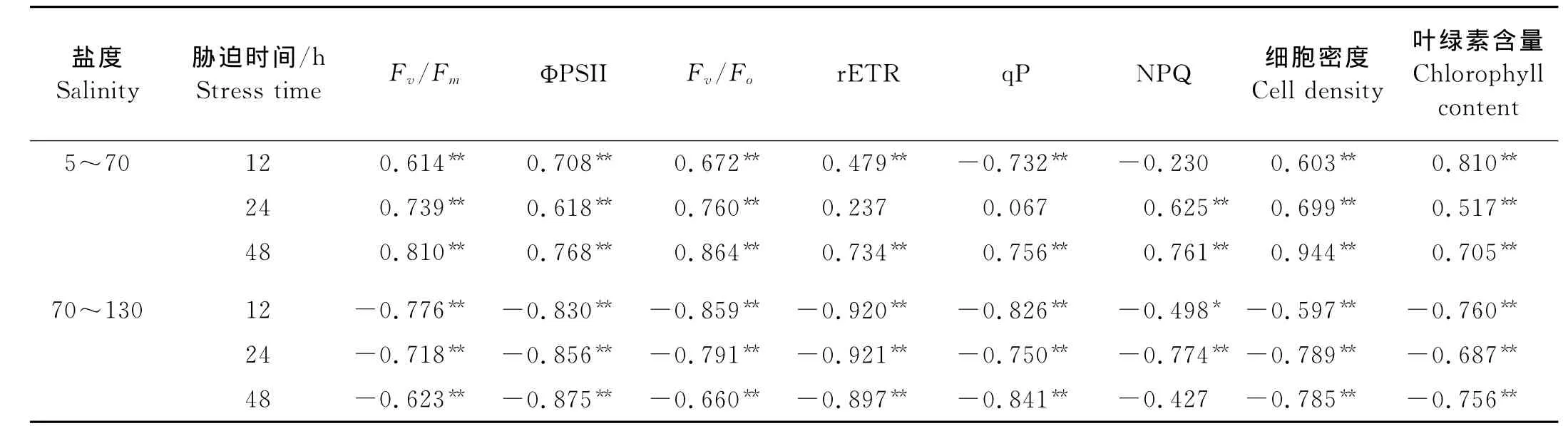
表2 盐生杜氏藻荧光参数、细胞密度及叶绿素含量与盐度的相关系数Table 2 The interrelated coefficients of fluorescence parameters,cell density and chlorophyll content with salinity of D.salina
2.2 盐度对盐生杜氏藻细胞密度和叶绿素含量的影响
图1和表1给出了盐度和胁迫时间对盐生杜氏藻细胞密度和叶绿素含量的影响。表1(a)的多因子方差分析表明,在整个培养过程中,盐度、胁迫时间及其交互作用对该藻的叶绿素含量和细胞密度均产生了显著影响(P<0.001),胁迫时间对上述2个参数的影响最为显著。表1(b)给出的多重比较结果表明,盐度在5~100之间的范围内,48h后随着盐度的升高,细胞密度和叶绿素含量的值明显增加,且均在盐度100时达到最大值;盐度在100~130之间时,上述2个参数的值随盐度升高而逐渐降低。盐生杜氏藻的细胞密度和叶绿素含量数值均随胁迫时间的延长而逐渐增加。
表3给出的盐生杜氏藻的荧光参数与细胞密度之间的相关关系,由表3可见,盐生杜氏藻的Fv/Fm、ΦPSII、Fv/Fo和rETR与细胞密度呈极显著的正相关;胁迫12和24h后,qP和NPQ与细胞密度的相关性较差,qP和NPQ在胁迫48h后与细胞密度呈显著的正相关性。
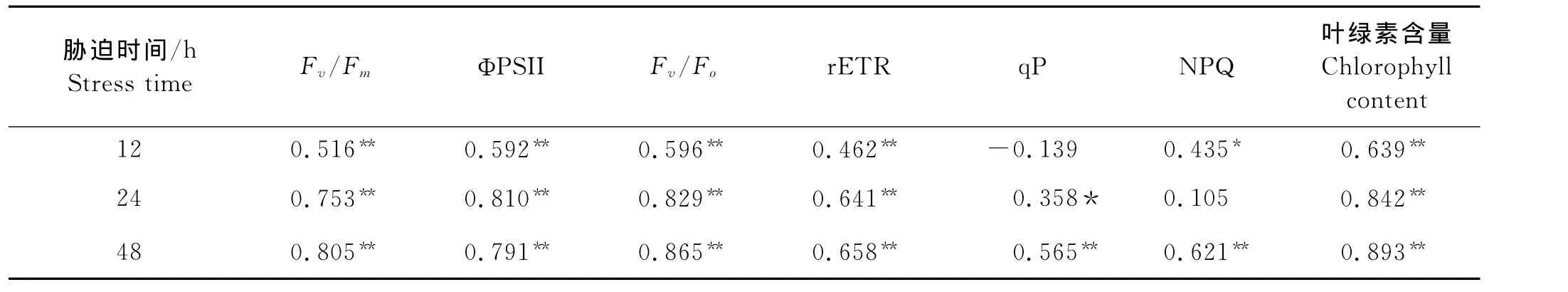
表3 盐生杜氏藻荧光参数及叶绿素含量与细胞密度的相关系数Table 3 The interrelated coefficient of fluorescence parameters and chlorophyll content with cell density of D.salina
3 讨论
作为一种研究植物光合功能的新型植物活体检测和诊断技术,叶绿素荧光分析技术在测定植物光合作用的过程中,利用植物中叶绿素作为天然探针,在光能的吸收、传递、分配和耗散等方面具有独特的优势,并且其快速、灵敏、不会对细胞造成损伤。国际上对叶绿素荧光分析技术的研究已成为热点,并针对耐寒性、耐热性、耐强光性和耐盐性等多种逆境生理条件进行了研究,结果表明,叶绿素荧光技术在研究植物逆境生理方面有许多优势[17-19],但有关盐胁迫对微藻光合作用影响的研究不多[12-13,20-22]。Fv/Fm比值是 PSII最大光化学量子产量,可以反映PSII的活性大小。正常生理状态下参数Fv/Fm很稳定,浮游植物Fv/Fm值保持在0.65左右[23],该参数不具有种间特异性,但植物受到胁迫后,Fv/Fm值会明显降低。有研究结果表明,微藻在盐胁迫条件下,其PSII的活性会降低,反映在Fv/Fm会随盐度的增加而下降。毕永红等[20]研究发现,随培养液中NaCl浓度的增加,发状念珠藻(Nostoc flagelliforme)Fv/Fm比值逐渐降低,欧阳叶新等[21]对鱼腥藻(Anabaenasp.)的研究也得到了相似的结果。而陈兰周等[22]的实验表明,爪哇伪枝藻(Scytonema javanicum)对盐胁迫则很敏感,在0.1mol/L NaCl时Fv/Fm比值已下降至0.4左右。本实验结果表明,盐生杜氏藻有很强的耐盐性,适宜盐度范围为20~110,在此盐度范围之间,Fv/Fm比值无明显降低,当低盐胁迫(盐度<20)和高盐胁迫(盐度>110)条件下,Fv/Fm比值才开始逐渐降低。盐胁迫条件下,盐生杜氏藻的PSII荧光指标Fv/Fo、rETR 与Fv/Fm具有相同 的 变 化 趋势,可见盐生杜氏藻自身光系统的转换能力较强。ΦPSII的变化,反映的是藻细胞同化力(NADPH,ATP)的形成,即碳的固定与同化作用,本实验研究结果表明,在盐度20~110之间,不影响盐生杜氏藻对CO2的固定和同化。qP(光化学淬灭)的变化表明,吸收的光能用于电子传递,当qP降低时表示进行光合作用的电子正在减少,以热的形式耗散的光能会逐渐增加,这与NPQ(非光化学淬灭)的变化是吻合的。本实验结果发现,盐胁迫对荧光指标(qP和NPQ)都造成了一定程度的抑制作用。
有关微藻耐盐机制的研究,主要集中在光合色素和蛋白含量等方面。Rafiqul[24]等研究发现,蓝藻(Spirulina fusiformis)叶绿素a含量随着NaCl浓度的增加而降低。蓝藻(S.fusiformis)在较低NaCl浓度条件下,类胡萝卜素含量降低;而在较高NaCl浓度条件下,其类胡萝卜素含量增加。耐盐蓝藻(Anabaena doliolum)的叶绿素含量则随着NaCl浓度的增加而增加[7]。盐胁迫下,藻蓝蛋白(PC)含量的变化结果较为一致,集胞藻(Synechocystis sp.)PCC6803在盐处理下,PC含量明显降低[25];蓝藻(S.fusiformis)的 PC含量随盐浓度的增加而降低[24]。本实验结果表明,在盐度为20~110条件下,盐胁迫不仅不会对耐盐的盐生杜氏藻造成损伤,反而会促进其生长,48h后随着盐度的升高,细胞密度和叶绿素含量逐渐增加,盐度为100时,二者均达到最大值。但超过一定盐度范围(>110)后,高盐胁迫对盐生杜氏藻的PSII会产生伤害,主要表现在加速了藻体中叶绿素含量的降低(见图1),可能高盐(>110)会影响类囊体膜的稳定性,加速叶绿素的分解,从而降低PSII反应中心的光合速率。目前对于微藻耐盐机制的研究还不是十分清楚,仅从某一方面研究其耐盐性还远远不够,这有待于进行深入研究。
盐生杜氏藻属于水产动物的优质饵料之一,但可能由于微藻藻株、培养条件等因素的不同,目前对盐生杜氏藻适盐范围的报道并不一致。吴春[26]报道盐生杜氏藻(D.salina)的最适盐度范围为20~30。而吕爱玲等[27]对中国渤海湾滩涂的绿色杜氏藻进行盐度驯化实验,认为绿色杜氏藻可在9~320的盐度范围生长,能耐受接近饱和的盐度条件。本文的研究结果表明,盐生杜氏藻对盐度的适应范围很广,在盐度20~110时,Fv/Fm值无显著性差异,这表明盐度20~110均适于盐生杜氏藻的生长,与之前利用叶绿素荧光技术对塔胞藻[13]的研究结果相比,本研究筛选得到的这株盐生杜氏藻(D.salina)具有更好的耐盐性,在高盐条件下更有利于对其进行培养。即使盐度在5~20之间的低盐胁迫条件下,Fv/Fm、ΦPSII、Fv/Fo、rETR、细胞密度和叶绿素含量等一系列指标均在逐渐增加(见图1),这也是该藻株对盐度较强适应性的一种表现。本实验结果发现,盐生杜氏藻在盐度5~110之间均能生长,最适盐度为100。本文的结果表明,盐生杜氏藻PSII的荧光指标(Fv/Fm、ΦPSII、Fv/Fo和rETR)与细胞密度均呈极显著的正相关性,而且细胞密度也与叶绿素含量呈极显著的正相关性,因此,在一定范围内,可通过该藻PSII荧光指标的变化反映其细胞密度及叶绿素含量对盐胁迫的耐受性。与计数细胞密度的传统方法相比,叶绿素荧光分析方法更加快速、灵敏和准确,并且不会对藻细胞造成损伤[28-29]。
现已证明,PSII的荧光指标更能反映植物的内在性特点,因此,叶绿素荧光技术已成为筛选高等植物(拟南芥、枸杞,特别是小麦等)耐盐品种的一种理想手段[1,4,14]。本文的结果表明,筛选得到的盐生杜氏藻其耐盐性很好,该藻 PSII的荧光指标(Fv/Fm、ΦPSII、Fv/Fo和rETR)与细胞密度具有良好的正相关关系,可用于该藻盐胁迫耐受性的评价依据,但目前对这方面研究的微藻品种还较少,PSII的荧光指标作为筛选耐盐微藻的参考指标是否可行,有待针对不同的微藻品种和品系进行全面的实验研究,以确定该方法的适应范围及可靠性。
[1] 赵昕,吴雨霞,赵敏桂,等.NaCl胁迫对盐芥和拟南芥光合作用的影响 [J].植物学通报,2007,24(2):154-160.
[2] 周丽,孟祥红,刘成圣.渗透胁迫对杜氏盐藻胞内甘油含量及相关酶活性影响 [J].植物学通报,2006,23(2):145-151.
[3] Rosarlo V E,Bronwyn J B,Liliana G R,et al.Salt stress in Thellungiella halopila activates Na+transport mechanisms required for salinity tolerance[J].Plant Physiol,2005,139:1507-1517.
[4] 惠红霞,许兴,李前荣.NaCl胁迫对枸杞叶片甜菜碱、叶绿素荧光及叶绿素含量的影响 [J].干旱地区农业研究,2004,22(3):109-114.
[5] 冯力霞.环境胁迫对4株微藻叶绿素荧光特性的研究 [D].青岛:中国海洋大学,2006:1-85.
[6] 冯永军,史宝胜,董桂敏,等.叶绿素荧光诱导动力学在植物抗逆性及水果保鲜中的应用 [J].河北农业大学学报,2003,26:89-92.
[7] Singh D P,Kshatriya K.NaCl-induced oxidative damage in the cyanobacterium Anabaena doliolum [J].Curr Microbiol,2002,44(6):411-417.
[8] Allakhverdiev S I,Klimov V V,Hagemenn M.Cellular energization protects the photosynthetic machinery against salt-induced inactivation in Synechococcus [J].Biochim Biophys Acta,2005,1708:201-208.
[9] Qia N W,Lu Q T,Lu C M.Photosynthesis,photosystem II efficiency and the xanthophyll cycle in the salt-adapted halophyte Atri-plex centralasiatica[J].New Phytol,2003,159:479-486.
[10] Lu C,Qiu N,Lu Q,et al.Does salt stress lead to increased susceptibility of photosystem Ⅱ to photoinhibition and changes in photosynthetic pigment composition in halophyte Suaeda salsa grown outdoors?[J].Plant Sci,2002,163:1063-1068.
[11] Netondo G W,Onyango J C,Beck E.Sorghum and salinity:Ⅱ.Gas exchange and chlorophyll fluorescence of Sorghum under salt stress[J].Crop Sci,2004,44(3):806-811.
[12] Lu C M,Vonshak A.Effects of salinity stress on photosystem II function in cyanobacterial Spirulina platensis cells[J].Physiol Plant,2002,114:405-413.
[13] 梁 英,冯力霞,田传远,等.盐胁迫对塔胞藻生长及叶绿素荧光动力学的影响 [J].中国海洋大学学报:自然科学版,2006,36(5):726-732.
[14] 黄有总,张国平.叶绿素荧光测定技术在麦类作物耐盐性鉴定中的应用 [J].麦类作物学报,2004,24(3):114-116.
[15] 耿德贵,韩燕,王义琴,等.杜氏盐藻的耐盐机制研究进展和基因工程研究的展望 [J].植物学通报,2002,19(3):290-295.
[16] Guillard R R,Ryther J H.Studies of marine planktonic diatoms.I.Cyclotella nana (Hustedt)and Detonula confervacea (Cleve)Gran[J].Can J Microbiol,1962,8:229-239.
[17] Annick M,Elisabeth P,Gerard T.Osmotic adjustment,gas exchanges and chlorophyll fluorescence of a bexaploid triticale and its parental species under salt stress [J].Plant Physiol,2004,1619(1):25-33.
[18] Bhargava S,Paranjpe S.Genotypic variation in the photosynthetic competence of Sorghum bicolor seedlings subjected to polyethylene glycol-mediated drought stress[J].Plant Physiol,2004,161(1):125-129.
[19] Lavaud J,Rousseau B,Gorkom H J van,et al.Influence of the diadinoxanthin pool size on photoprotection in the marine planktonic diatom Phaeodactylum tricornutum [J].Plant Physiol,2002,129(3):1398-1406.
[20] 毕永红,邓中洋,胡征宇,等.发状念珠藻对盐胁迫的响应 [J].水生生物学报,2005,29(2):125-129.
[21] 欧阳叶新,施定基,黄开耀,等.鱼腥藻7120响应NaCl胁迫的光合特性 [J].水生生物学报,2003,27(1):74-77.
[22] 陈兰周,刘永定,李敦海.盐胁迫对爪哇伪枝藻生理生化特性的影响 [J].中国沙漠,2003,23(3):285-288.
[23] SeppalaJ.fluorescence properties of Baltic sea phytoplankton[D].Helsinki:University of Helsinki,2009:1-43.
[24] Rafiqul I M,Hassan A,Sulebele G,et al.Salt stress culture of blue-green algae Spirulina fusiformis [J].Pakistan Biological Sci,2003,6(7):648-650.
[25] Marin K,Kanesaki Y,Los D A,et al.Gene expression profiling reflects physiological processes in salt acclimation of Synechocystis sp.Strain PCC 6803[J].Plant Physiol,2004,136:3290-3300.
[26] 吴春,段舜山.盐生杜氏藻对盐度改变的生理响应 [J].生态科学,2006,25(2):135-138.
[27] 吕爱玲,张福,马若欣,等.中国渤海湾滩涂极端嗜盐绿色杜氏藻生物学特性研究(二)[J].海湖盐与化工,2004,34(3):19-25.
[28] 梁英,冯力霞,尹翠玲.叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景 [J].海洋科学,2007,31(1):71-76.
[29] 王帅,梁英,冯力霞,等.重金属胁迫对杜氏盐藻生长及叶绿素荧光动力学的影响 [J].海洋科学,2010,34(10):38-48.
