豌豆根瘤菌透性酶基因突变体的构建及其功能研究
2015-10-13周艳琳等
周艳琳等

摘要:为研究豌豆根瘤菌(Rhizobium leguminosarum)3841透性酶基因rl1568的作用,通过同源重组构建了豌豆根瘤菌透性酶基因rl1568突变体。结果表明,rl1568基因突变不影响菌株在自生培养条件下生长,但该基因突变株对低浓度的氧化物十分敏感且生长较差。荧光定量RT-PCR结果表明,H2O2不能诱导rl1568基因表达。植物盆栽试验发现rl1568基因突变对根瘤菌共生固氮能力无影响。
关键词:豌豆根瘤菌(Rhizobium leguminosarum);透性酶;rl1568基因; 抗氧化;共生固氮
中图分类号:Q936 文献标识码:A 文章编号:0439-8114(2015)18-4613-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.057
细胞膜作为细胞与细胞外环境之间的一种选择性通透屏障,一方面能保障细胞对基本营养物质的摄取、代谢废物的排除和细胞内离子浓度的调节;另一方面使细胞维持相对稳定的内环境,因此物质的跨膜运输对细胞的生存和生长极为重要。跨膜转运过程大部分情况是由膜蛋白介导的,在功能上有时与细胞外受体和细胞质内的调控蛋白相联系[1-3],这种蛋白复合体可称为转运体,或者透性酶。
根瘤菌是一类能够以类菌体的形式存在于豆科植物中的革兰氏阴性菌,一方面将氮气固定成植物所需氮源;另一方面利用植物所提供的氮源生存。为建立这种共生系统,土壤中的根瘤菌必须在根系环境中大量繁殖,并与其他有机体争夺养分,而根瘤菌中被发现越来越多的转运体为根瘤菌在根系定殖时获得重要的养分如氨基酸[4]。在豌豆根瘤菌(Rhizobium leguminosarum)中,编码氨基酸透性酶Aap和Bra基因双突变后,由于不能利用谷氨酸、谷氨酰胺、脯氨酸以及天冬氨酸等氨基酸,根瘤菌生长受到明显影响[5]。另外在肺炎链球菌(Streptococcus pneumoniae)中发现作为ABC转运体的psa透性酶不仅参与Mn2+转运,同时在系统毒性和抵御超氧化物以及过氧化物中起重要作用[6]。
在豌豆根瘤菌中发现了一种透性酶基因rl1568(NC_008380.1),编码一个362氨基酸的蛋白质(YP_767172.1),含有6个跨膜区域,属于YjgP/YjgQ超家族。YjgP/YjgQ超家族存在范围广泛,如单独以膜结构[7]存在,或者与其他结构域构成各种酶如组氨酸激酶[8]以及脂肪酶[9],其功能推测为透性酶[10],但具体功能机制尚不清楚。在大肠杆菌中发现属于YjgP/YjgQ超家族的两种内膜蛋白YjgP和YjgQ在脂多糖LPS转运的过程中起重要作用,推测可能为ABC型转运系统的一部分[11],而在Rhodopirellula baltica SH 1中则推测为信号肽[12]。因此本研究在构建豌豆根瘤菌3841 rl1568基因突变株的基础上,通过自生和共生试验,研究了rl1568基因是否对菌株生长和共生固氮能力有影响,并通过RT-PCR分析相关基因的表达情况,为阐明rl1568基因的调控机制提供了研究基础。
1 材料与方法
1.1 材料
1.1.1 菌种质粒和培养基 豌豆根瘤菌3841和克隆载体pK19mob由英国牛津大学Philip S Poole教授提供。LB培养基[13]用于大肠杆菌培养,豌豆根瘤菌培养所用培养基TY[13]和AMS培养基[14]。培养根瘤菌所用抗生素:链霉素(Str)、新霉素(Neo)、卡那霉素(Km)和四环素(Tc),购于Sigma公司,使用浓度为:Str,500 μg/mL;Neo,80 μg/mL;Tc,2 μg/mL;培养大肠杆菌所用抗生素浓度:Km,20 μg/mL; Tc,5 μg/mL。
1.1.2 主要试剂和仪器 限制性内切酶Hind Ⅲ 及XbaⅠ,T4 DNA连接酶,RNAiso Plus等(TAKARA公司);phusion 高保真酶、Taq DNA 聚合酶(Thermo scientific),DNA凝胶回收试剂盒(博大泰克生物技术有限公司),PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time),FastStart Universal SYBR Green Master (Roche),752型紫外可见光光度计(上海光谱仪器有限公司),PCR仪(Biometra),荧光定量PCR仪(Applied Biosystems)。
1.2 rl1568基因插入突变株的构建
rl1568基因突变按照Luo等[15]方法进行,以豌豆根瘤菌3841总DNA为模板,以Pr1568-1F/Pr1568-1R为引物扩增得到目的片段,引物见表1。将扩增得到的产物与空载体pK19mob分别经XbaⅠ和Hind Ⅲ双酶切后,利用T4 DNA连接酶连接过夜,然后导入DH5α中,经PCR和测序验证后,获得阳性克隆质粒pK1568。以含pK1568质粒的大肠杆菌为供体菌,3841为受体菌,含质粒pRK2013的大肠杆菌为辅助菌进行三亲本杂交,通过抗性筛选及用引物Pr1568-map/M13F PCR验证缺失突变株。
1.3 菌株生长情况
1.3.1 无H2O2胁迫条件下菌株的生长情况 将已活化的RL1568和3841经AMS洗脱后,接种于50 mL的AMS培养基中,使初始OD600 nm为0.01,每个菌3个重复,28 ℃下200 r/min于摇床中振荡培养,每隔一段时间取样,测定OD600 nm。
1.3.2 抑菌圈试验 将培养至对数期的待测菌株经生理盐水清洗并重新溶解后,涂布于AMS琼脂平板,待平板晾干后将浸有不同浓度氧化物的圆滤纸片放置在平板中央,每个平板一个圆滤纸片,每种浓度3个重复,测定抑菌圈的直径。氧化物为过氧化氢(H2O2)和过氧化氢异丙苯(CuOOH),其中CuOOH用无水乙醇稀释成不同浓度。endprint
1.4 qRT-PCR分析相关抗氧化基因的表达量
进行细菌RNA提取[16]时,将3841接种于AMS液体培养基中,使初始OD600 nm为0.01,28 ℃下200 r/min于摇床中振荡培养至OD600 nm在0.3至0.6之间,菌体离心收集后分别用生理盐水和0.5 mmol/L H2O2处理1 h,采用Trizol法提取总RNA,然后利用PrimeScriptTM RT reagent Kit with gDNA Eraser 试剂盒将其反转录成cDNA,用相关抗氧化基因的PCR引物和gyrB1内参基因的引物(表1),对cDNA模板进行荧光定量PCR。
1.5 植物盆栽试验
参照Poole等[17]的方法,采用无菌蛭石盆栽。豌豆种子经表面灭菌催芽处理后,播入已灭菌的蛭石塑料烧杯。栽培大豆用无氮营养液,播种时每颗豌豆上加1 mL相应菌液,一钵2豌豆,3钵重复。盖好保鲜膜后放入光照培养箱中培养,3周后利用乙炔还原法测量根瘤固氮酶活。
2 结果与分析
2.1 豌豆根瘤菌3841 rl1568基因突变体的构建
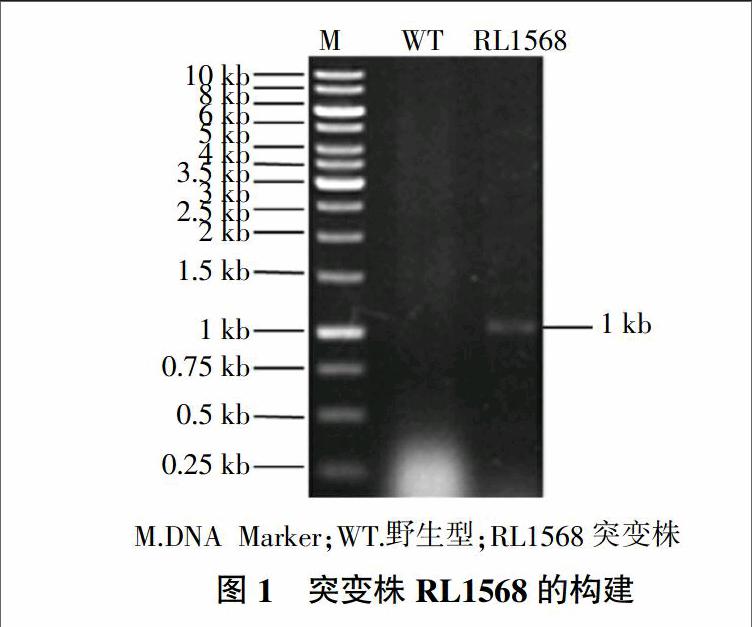
参照Karunakaran等[18]突变体构建的方法,利用Pr1568-map/pk19A对重组子进行PCR验证,成功扩增出1 kb左右的目标片段(图1),获得rl1568基因突变株RL1568。
2.2 rl1568基因突变后豌豆根瘤菌对H2O2敏感
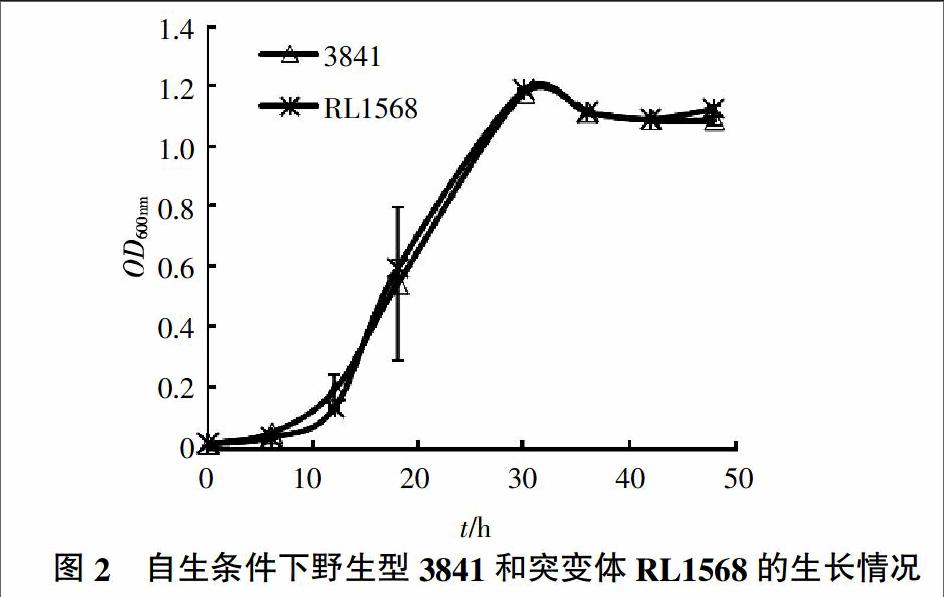
2.2.1 rl1568基因突变不影响菌株正常生长 将RL1568和3841分别接种于AMS培养基上,使初始OD600 nm为0.1,每隔一段时间测定其OD600 nm。结果(图2)表明,突变株RL1568的生长情况与野生型3841无明显区别,表明rl1568基因对豌豆根瘤菌3841生长无明显影响。
2.2.2 rl1568基因突变影响豌豆根瘤菌抗氧化能力 选取H2O2和CuOOH作为过氧化物,研究了不同浓度下野生型3841和突变株RL1568的抑菌圈直径(表2)。当H2O2以及CuOOH浓度在100 mmol/L和50 mmol/L时,培养24 h后,突变株抑菌圈直径相对于野生型3841很大,有显著性差异;而在高浓度情况下两者相差不大。表明rl1568基因对低浓度的H2O2和CuOOH更为敏感。
2.3 抗氧化相关基因的表达分析
进行RT-PCR后,并用2-ΔΔCt进行处理,以生理盐水处理的3841为对照,0.5 mmol/L H2O2处理的3841中rl1568基因的表达量为0.98±0.5,表明rl1568基因表达不受H2O2的影响。
2.4 植物盆栽试验
将突变株RL1568和野生型3841接种于豌豆中4周后,突变株RL1568接种的植株能形成粉红色有效根瘤,用乙炔还原法测定豌豆植株的固氮酶活。结果表明,野生型3841的固氮酶活为3.58±0.44 μmol/(g·h),RL1568为3.39±1.19 μmol/(g·h),两者固氮酶活无明显差异,表明rl1568基因突变对根瘤固氮无明显影响(图3)。
3 小结与讨论
细胞膜的外膜结构OM作为一种选择性透性屏障阻挡有毒物质比如去污剂和抗生素[19]。根瘤菌与豆科植物共生固氮中,根瘤菌分泌的外膜蛋白对根毛的吸附、根瘤及侵染结构的形成、保护细胞免受植物防卫反应的作用等方面都有重要作用[20]。
在本试验中,发现透性酶rl1568基因突变虽然对豌豆根瘤菌3841正常生长并无明显影响,但对低浓度的氧化物如H2O2和CuOOH敏感。在低浓度的氧化物浓度下,突变株RL1568的抑菌圈直径比野生型3841明显大很多,但当氧化物浓度提高时,两者并无明显差别。经H2O2处理后,野生型菌株中rl1568基因表达量为0.98±0.5,说明rl1568基因表达并不受外界H2O2影响。此外通过盆栽试验发现,rl1568基因突变并不影响豌豆根瘤菌的固氮能力。rl1568基因编码产物属于YjgP/YjgQ透性酶,目前还没有关于YjgP/YjgQ透性酶抗氧化相关的报道,对rl1568基因及YjgP/YjgQ透性酶在抗氧化中的机制还有待深入研究。
参考文献:
[1] HIGGINS C F.The ABC of channel regulation[J].Cell,1995, 82(5):693-696.
[2] REIZER J, SAIER J M H. Modular multidomain phosphoryl transfer proteins of bacteria[J]. Current Opinion in Structural Biology,1997,7(3):407-415.
[3] SAURIN W, HOFNUNG M, DASSA E. Getting in or out: Early segregation between importers and exporters in the evolution of ATP-binding cassette (ABC) transporters[J]. Journal of Molecular Evolution, 1999, 48(1): 22-41.
[4] HOSIE A H F, ALLAWAY D, POOLE P S. A monocarboxylate permease of Rhizobium leguminosarum is the first member of a new subfamily of transporters[J]. Journal of Bacteriology, 2002, 184(19): 5436-5448.endprint
[5] MCALLISTER L J,TSENG H J,OGUNNIYI A D,et al. Molecular analysis of the psa permease complex of Streptococcus pneumoniae[J]. Molecular Microbiology,2004,53(3):889-901.
[6] HOSIE A H F,ALLAWAY D,GALLOWAY C S,et al. Rhizobium leguminosarum has a second general amino acid permease with unusually broad substrate specificity and high similarity to branched-chain amino acid transporters (Bra/LIV) of the ABC family[J]. Journal of Bacteriology,2002,184(15):4071-4080.
[7] KANEKO T,SATO S,KOTANI H,et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803.Ⅱ. Sequence determination of the entire genome and assignment of potential protein-coding regions[J]. DNA Research,1996,3(3):109-136.
[8] THOMSON N R, HOWARD S, WREN B W, et al. The complete genome sequence and comparative genome analysis of the high pathogenicity Yersinia enterocolitica strain 8081[J]. PLoS Genetics,2006,2(12):e206.
[9] WANG Y, LI X, MAO Y, et al. Genome-wide dynamic transcriptional profiling in Clostridium beijerinckii NCIMB 8052 using single-nucleotide resolution RNA-Seq[J]. BMC Genomics, 2012, 13(1): 102-117.
[10] FINN R D, MISTRY J, SCHUSTER-B?魻CKLER B, et al. Pfam: Clans, web tools and services[J]. Nucleic Acids Research, 2006, 34(s1): 247-251.
[11] RUIZ N, GRONENBERG L S, KAHNE D, et al. Identification of two inner-membrane proteins required for the transport of lipopolysaccharide to the outer membrane of Escherichia coli[J]. Proceedings of the National Academy of Sciences, 2008, 105(14): 5537-5542.
[12] GL?魻CKNER F O,KUBE M,BAUER M,et al.Complete genome sequence of the marine planctomycete Pirellula sp. strain 1[J].Proceedings of the National Academy of Sciences,2003, 100(14): 8298-8303.
[13] JOSEPH S, DAVID W R,HUANG P. Molecular Cloning-A Laboratory Manual[M].Beijing: Science Press,2002.
[14] WHITTENBURY R, PHILLIPS K C,WILKINSON J F. Enrichment, isolation and some properties of methane-utilizing bacteria[J]. Journal of General Microbiology, 1970, 61(2): 205-218.
[15] LUO L,YAO S,BECKER A,et al.Two new Sinorhizobium meliloti LysR-type transcriptional regulators required for nodulation[J].Journal of Bacteriology,2005,187(13): 4562-4572.
[16] 彭杰丽.基于全局转录组分析研究华癸中慢生根瘤菌7653R 类菌体分化和固氮机理[D].武汉:华中农业大学,2014.
[17] POOLE P S,BLYTH A,REID C J,et al. Myo-Inositol catabolism and catabolite regulation in Rhizobium leguminosarum bv. Viciae[J]. Microbiology, 1994, 140(10): 2787-2795.
[18] KARUNAKARAN R, HAAG A F, EAST A K, et al. BacA is essential for bacteroid development in nodules of galegoid, but not phaseoloid, legumes[J]. Journal of Bacteriology, 2010, 192(11): 2920-2928.
[19] NIKAIDO H. Molecular basis of bacterial outer membrane permeability revisited[J]. Microbiology and Molecular Biology Reviews, 2003, 67(4): 593-656.
[20] 程国军,周俊初,李友国.华癸中生根瘤菌脂多糖突变株的共生能力[J].中南民族大学学报,2008,27(2):11-13.endprint
