一种基于RFLP分析的冈比亚藻检测方法的建立
2015-10-13吕意华俞志明郑天凌
吕意华,周 进,郑 伟,高 岩,俞志明,郑天凌*
(1.厦门大学生命科学学院,滨海湿地生态系统教育部重点实验室,福建 厦门361102;2.清华大学深圳研究生院海洋科学与技术学部,广东深圳518055;3.中国科学院海洋研究所,海洋生态与环境科学重点实验室,山东青岛266071)
一种基于RFLP分析的冈比亚藻检测方法的建立
吕意华1,周 进2,郑 伟1,高 岩3,俞志明3,郑天凌1*
(1.厦门大学生命科学学院,滨海湿地生态系统教育部重点实验室,福建 厦门361102;2.清华大学深圳研究生院海洋科学与技术学部,广东深圳518055;3.中国科学院海洋研究所,海洋生态与环境科学重点实验室,山东青岛266071)
雪卡毒素作为一种脂溶性藻毒素近年来日益引起人们的重视,冈比亚藻(Gambierdiscus spp.)是雪卡毒素的主要产生藻.不同的冈比亚藻具有不同的生长特性和产毒性能,且存在地域差异性,因而对冈比亚藻的监测存在较大挑战.建立一种快速简单地鉴定冈比亚藻及其种群结构的方法,是基础科研和社会公众关心的共性问题.为此,以加勒比海的10种冈比亚藻为受试生物,应用限制性片段长度多态性(restriction fragment length polymorphism,RFLP)分析技术,通过生物软件分析发现受试藻的限制性内切酶Aci I具有良好的特异性和灵敏性,可有效区分目前已鉴定的10种冈比亚藻.验证实验中,通过与分离自野外环境的多株冈比亚藻进行酶切电泳和DNA测序,证实了Aci I的有效性和可靠性.结果表明,该Aci I分子具有检测自然环境中冈比亚藻属性和追踪其种群结构变化的潜力,对雪卡毒素的预判与风险评估具有重要的借鉴意义.
雪卡毒素;冈比亚藻;限制性片段长度多态性;Aci I;D1-D2
冈比亚藻(Gambierdiscus spp.)是一种单细胞的小型底栖甲藻,通常附着在大型藻或硬质死亡珊瑚的表面,主要分布于35°N和35°S之间的加勒比海及热带和亚热带太平洋海域及印度洋,是雪卡毒素(ciguatera)前体——冈比亚毒素的重要产生者.早在古罗马和唐朝时期便有因误食雪卡毒素污染的鱼类而中毒的事件[1-2].随着全球气候变暖,有害赤潮藻分布范围扩大及珊瑚鱼贸易和旅游事业发展,雪卡毒素中毒(ciguatera fish poisoning,CFP)危害呈越来越严重的趋势[3-5].人们对雪卡毒素的关注,一方面是因为它威胁到水产品安全和公众健康;另一方面也源自于它的生态指示价值,Hales等[6]认为雪卡毒素可作为热带海洋生态系统评估的敏感指示物,能间接反映环境变化所导致的生态破坏情况.

雪卡毒素的研究多聚焦于它的生产者——冈比亚藻.然而,以往受限于传统分类学手段分辨率差等因素,人们一直将所有的冈比亚藻都笼统地归类为毒性冈比亚藻(G.toxicus).随着分子生物学的发展, r DNA测序被广泛应用到冈比亚藻的分类鉴定中. Richlen等[7]采用r DNA测序和传统的形态学相结合的方法在太平洋和加勒比海域分离鉴定了4种冈比亚藻,进一步的研究发现冈比亚藻具有丰富的种间多样性,目前已有10种不同的冈比亚藻种被分离、鉴定和命名,另有2种潜在新种的基因型(G.ribotype 1和2)被报道[8].在已发现的主要冈比亚藻中,人们对其地理分布、产毒特性以及共存状态有了一定的认识.在区域分布上,Litaker等[5]根据目前已报道的冈比亚藻,勾勒出了所有冈比亚藻种在全球的分布图,其中G.carpenteri和G.caribaeus在太平洋和加勒比海域均有分布,而G.australes,G.pacificus,G. polynesiensis,G.toxicus和G.yasumotoi只分布于太平洋,G.belizeanus,G.carolinianus,G.ruetzleri, G.ribotype 1和G.ribotype 2则只在加勒比海域被发现[5].在毒性特征上,冈比亚藻毒性(毒素成分,毒性大小)存在明显的种间差异,如G.toxicus和G. caribaeus属低毒性种;G.austral,G.belizeanus,G. ribotype 2和G.pacificus为中等毒性种;而G. polynesiensis和G.excentricus为高毒性种[9-10].目前发现多种产毒冈比亚藻可以在某一区域共存,使得该海域的毒素组成具有多样性和更替性.Holmes等[11]认为由于不同组合的冈比亚藻种会表现出不同的雪卡毒素,而环境参数作为不同冈比亚藻种选择性生存和繁殖重要的驱动力,对其分布具有重要的选择作用,是雪卡毒素形成的主要原因[11].
如何快速有效地追踪某海域中环境选择压力下的冈比亚藻种群结构变化对于解释和预测雪卡毒素的暴发具有至关重要的作用.目前,人们对冈比亚藻种的鉴定主要依靠对核糖体大亚基(LSU)的多变区的克隆和测序来实现[12].DNA测序方法具有准确度和分辨率高的优点,但是也存在实验周期长、成本消耗大、操作相对繁琐,以及无法分析某一冈比亚藻的具体丰度等问题.因此,开发经济简单的冈比亚藻种群分析方法就成了研究者们亟需解决的问题.
限制性片段长度多态性(restriction fragment length polymorphism,RFLP)分析因技术成熟、成本低等优点已被大量使用在微生物、真菌和赤潮藻等生物种群结构的研究中,特别是随着快速反应的限制性酶和荧光RFLP分析的发展,RFLP的应用越来越广泛[13-15].冈比亚藻LSU的D1-D2区域具有一定的种间差异性.本实验以RFLP技术为切入点,以冈比亚藻LSU中的多变区D1-D2为检测区域,找到了限制性内切酶Aci I.该组合酶具有区分现已发现的10种冈比亚藻种的潜能.在实际的研究工作中,我们选取了实验室现有的7种冈比亚藻,获得了这7种藻的酶切图谱.为了进一步验证该组合酶的特异性,我们对5株来自加勒比海域的野外冈比亚藻进行了酶切实验和DNA测序验证,结果显示本次实验建立的Aci I检测方法与分子测序方法有很好的重现性.
1 材料与方法
1.1 藻种和培养条件
本次实验中所用到的冈比亚藻或DNA样品均由Donald M Anderson教授实验室(伍兹霍尔海洋研究所,美国)惠赠,其中部分来自加勒比海域圣托马斯岛沿海.冈比亚藻培养在30 m L的K培养基中[16],培养温度23℃,盐度32,光照强度100μmol·m2/s,光照周期12 h∶12 h(光照∶黑暗).
1.2 限制性内切酶的设计
从NCBI数据库下载所有被收录的冈比亚藻的D1-D3序列(约920 bp),根据引物序列使用Geneious Pro 6.1.2(Biomatters,Auckland,NZ)获取目标片段D1-D2序列(约700 bp),然后分析各冈比亚藻种之间的D1-D2的进化关系,确定最大相似种(即RFLP分析的限制性藻种),最后利用DNAMAN 6.0和Restriction Enzyme Picker模拟酶切,获得最佳的限制性内切酶.
1.3 DNA提取和目标基因扩增
3 000 g离心收集10 m L对数期的藻细胞重悬于100μL的无菌水中,使用MoBIO PowerSoil DNA I-solation试剂盒(MoBio Laboratories,Inc.,Carlsbad, CA,USA)提取冈比亚藻总DNA,并采用1.5%(质量分数,下同)的TAE琼脂糖凝胶电泳验证.高变区D1-D2片段的扩增引物为D1R和D2C[17],PCR的反应体系(50μL)为:约5 ng的DNA模板,10×PCR缓冲液5μL(500 mmol/L KCL,100 mol/L Tris-HCl, p H 8.3),5μL d NTPs(0.8 mmol/L),4μL MgCl2(2 mmol/L),各2.5μL D1R和D2C引物(0.5μmol/ L),以及1 U Ampli Taq DNA聚合酶(Applied Biosystems Inc.,Foster City,CA,USA),用水补充到50 μL.PCR反应在Eppendorf Mastercycler Nexus PCR仪(Eppendorf,Hamburg,Germany)中进行,反应条件为:94℃预变性5 min;然后94℃变性30 s,57℃退火1 min,72℃延伸2 min,共35个循环;最后72℃反应10 min.所有的样品均设置2个重复,反应完成后将2个重复的PCR产物混合,再采用2%的TAE凝胶电泳检测PCR结果.
1.4 产物纯化及定量
PCR产物采用QIAquick DNA纯化试剂盒(QIAGE,Valencia,CA,USA)进行纯化,纯化产物重溶在30μL的超纯水中.使用PicoGreen核酸定量试剂盒(Life Technologies,Eugene,Oregon,USA)和紫外分光光度计(Spectramax M3)构建标准曲线,对D1-D2纯化产物进行定量(参照试剂盒操作流程).
1.5 限制性内切酶酶切反应及凝胶电泳检测
用Aci I快速限制性内切酶对不同的冈比亚藻进行限制性酶切,预测的酶切位点和切片段大小如表1所示.酶切反应分两步进行,反应体系为25μL,包含2.5 μL的10×酶切缓冲液,0.5 U的Spe I,HPYCH 4IV以及2μg DNA(用水补充到终体积25μL).37℃反应10 min后,再加入0.5 U的TaqαI加热到65℃反应10 min,最后80℃保持20 min将酶失活.取10μL的反应产物使用2%的TAE凝胶电泳检测各冈比亚藻的酶切产物大小.产物在1.5%的TAE胶中电泳(75 V,90 min),成像结果在凝胶成像仪上进行分析.
1.6 D1-D2的克隆与测序
使用p-GEM-T质粒试剂盒(Promega,Madison, WI,USA),将新鲜的D1-D2扩增产物克隆和转化至感受态的大肠杆菌中.然后根据蓝白斑方法筛选阳性克隆,PCR验证之后,选取阳性克隆子进行正反双向测序(Eurofins MWG Operon,Ebersberg,Germany).
2 结 果
2.1 限制性内切酶的筛查
由于不同冈比亚藻种LSU的多变区D1-D2通常只有数个碱基的差异,目前已经商品化的限制性内切酶很难独自将所有的冈比亚藻区分开来,而不同的限制性内切酶具有不同的酶切识别位点.本次实验中我们尝试寻找一种特异性的内切酶,以期达到具有区分现有的冈比亚藻的能力.通过分析各种冈比亚藻之间的进化关系,获取相似性最大的冈比亚藻种,在此基础上确定所有冈比亚藻RFLP酶设计过程中的必需限制性内切酶,然后再遵循组合酶含酶种类最少、酶切产物片段最少和经济实用的原则对潜在的限制性内切酶进行了筛查,最终确定了限制性内切酶Aci I (5′-C|CGC-3′)为靶向酶(表1).
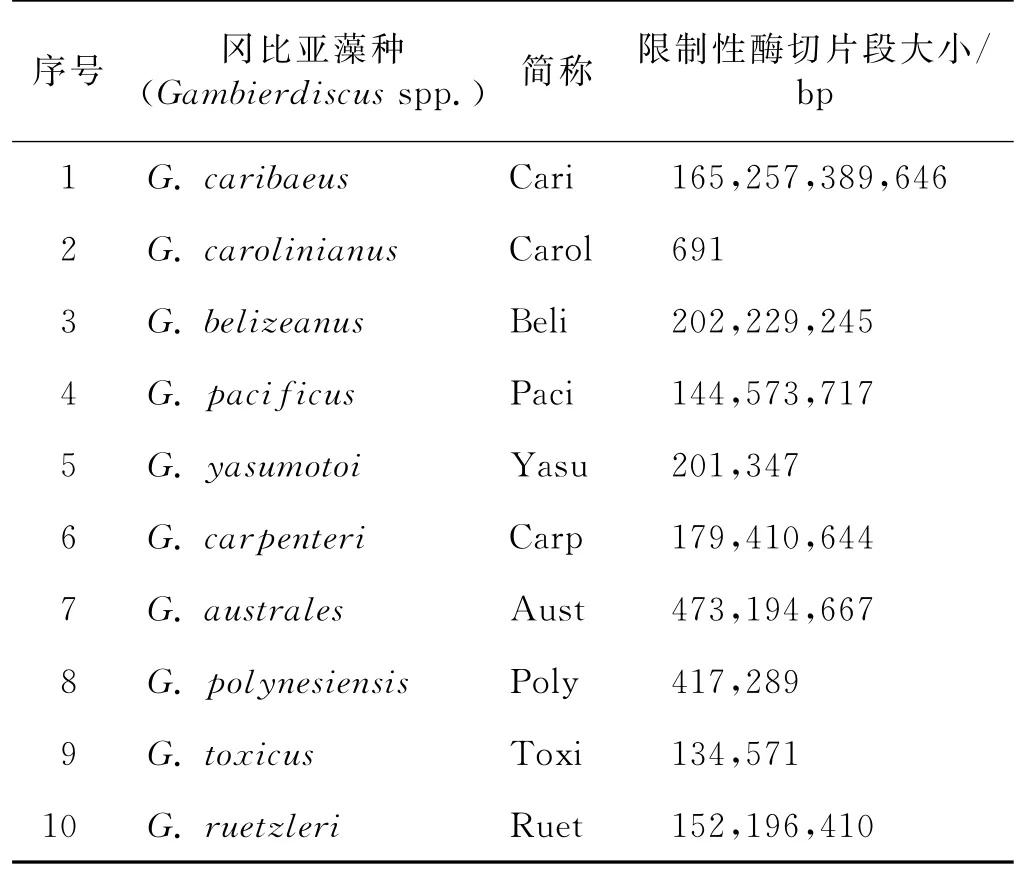
表1 10种冈比亚藻预计限制性内切酶酶切片段位点Tab.1 The Aci I recognition site for ten Gambierdiscus spp.
2.2 D1-D2扩增及定量
藻类LSU多变区D1-D2因种内的高保守性,被研究者广泛应用在藻类的基因分型和种类鉴定中.本研究中选用D1R和D2C引物对实验室拥有的7种冈比亚藻的D1-D2区域进行PCR扩增(图1).结果显示该引物具有很好的特异性,所有PCR扩增产物在700~800 bp之间形成清晰、单一的电泳条带,且与实际序列大小相当.
另外,为了保证所有酶切反应的DNA浓度一致,本研究使用PicoGreen核酸定量试剂盒来定量D1-D2扩增产物纯化后的浓度.如图2所示,当DNA质量浓度分别为0,1,10,100,1 000 ng/m L时,DNA标准曲线拥有很好的线性关系(R2=0.999 9),但由于0,1, 10 ng/m L的数据结果非常接近,较难识别.通过该标准曲线的回归公式计算,所有冈比亚藻的D1-D2酶切反应浓度都换算成2μg对应的DNA体积,以保证酶切结果的可比较性.
图1 7种冈比亚藻LSU多变区D1-D2的PCR产物电泳图Fig.1 D1-D2 products of seven Gambierdiscus spp.
图2 DNA定量标准曲线Fig.2 Standard curve of DNA quantification
2.3 限制性内切酶酶切图谱
如图3所示,7种所检测的冈比亚藻D1-D2区域经Aci I限制性内切酶消化之后,所得酶切图谱具有较大的差异性.参照表1及图3中电泳条带的位置不难发现,各冈比亚藻的酶切图谱片段除了部分小片段以外,所有的DNA电泳片段都与预计的酶切结果相吻合.但是,由于数据库中缺乏G.ribotype的D1-D2序列,本研究未能提供该型藻可能的限制性内切酶酶切片段大小.

图3 7种冈比亚藻D1-D2多变区的限制性内切酶酶切图谱Fig.3 D1-D2 digestion profiles of seven Gambierdiscus spp.
2.4 限制性内切酶酶切应用
为了验证组合酶对自然环境中冈比亚藻的鉴定能力,我们随机选取了来自加勒比海圣托马斯岛沿海5株未知冈比亚藻种(HG,BB,KM,BP,TP)进行了酶切分析,酶切结果如图4所示.对照表1和图3不难发现,HG,KM和TP的酶切片段大小相同且与G.carpenteri的酶切图谱吻合,因此初步确定这3株藻为G.carpenteri;BB,BP 2株藻的酶切图谱相同,且与G.carolinianus完全一致,因此可初步断定这2株藻为G.carolinianus.

图4 来自加勒比海域的5株冈比亚藻的D1-D2区酶切图谱Fig.4 D1-D2 digestion profiles of five unknown Gambierdiscus spp.from Caribbean Sea
2.5 DNA测序验证
为了进一步验证酶切结果,我们对上述5株冈比亚藻LSU多变区D1-D2进行了DNA测序和Blast分析(某实验未发表数据).其中HG,KM和TP的D1-D2测序结果与G.carpenteri 1S0510-22(KJ125101.1)的相似度为99%;BB和BP 2株冈比亚藻的D1-D2的BLAST比对显示其与G.carolinianus NOAA6 6 (GU968522.1)的相似度达99%.因此,由于分子测序结果的高相似性,可以确定上述5株藻分别为G.carpenteri和G.carolinianus.分子鉴定方法与本次实验所建立的RFLP酶切检测法具有较好的匹配性,证实了RFLP方法的可靠性.
3 讨 论
RFLP是近年发展起来的一项新型分子技术,因其具有技术成熟、成本低廉等优点,在微生物、真菌和赤潮藻等生物种群结构的研究中已被广泛应用[15,17].如Chang等[18]利用RFLP方法研究了厌氧条件下多环芳烃的降解,发现添加抑制甲烷生成的试剂后,萘和菲的降解被抑制,而且产甲烷细菌古生菌也被消除,从而证明产甲烷细菌参与多环芳烃的厌氧降解. Scholin等[19]利用RFLP对多种亚历山大藻(Alexandrium)的LSU的D1-D3区进行了多种限制性内切酶的酶切图谱分析,为包括塔玛亚历山大藻(A.tamarense),链状亚历山大藻(A.catenella),A.fundyense和A.affine等的酶切鉴定提供了酶学基础.RFLP技术操作简单,能有效摆脱对设备的高要求和对成本的高依赖,与其他方法(如变性凝胶电泳、分子测序等)相比优势明显,具有较大的生态应用价值.
在产毒藻类中,例如冈比亚藻,由于不同冈比亚藻的生长和产毒特性差别巨大,且分布具有明显的地域性,如何快速获得某热带或亚热带海域的冈比亚藻群信息对预测和监控该海域的雪卡毒素具有非常重要的意义.以往针对冈比亚藻的鉴定有过RFPL的尝试,然而,普通RFPL的检测手段一般为琼脂糖凝胶电泳,该检测手段分辨率低,依赖于人眼观察,具有明显的局限性.且部分冈比亚藻在PCR过程总会产生假基因(pseudo-gene),导致其酶切结果存在误差[20].随后发展的末端限制性片段长度多态性分析法(terminal restriction fragment length polymorphism,TRFLP)利用荧光标记引物对样品中DNA进行特异扩增,然后进行限制性内切酶酶切,用带荧光检测器的序列仪对荧光标记片断进行分离和识别,检测末端限制片段的多样性这种方法能够得到一个群落的特征指纹图谱,可大幅提高检测该酶切方法的分辨率和检测限.Joo等[15]根据12种不同藻种的核糖体小亚基多变区构建了藻的T-RFLP库,然后设计了包含2种限制性内切酶的组合酶对2个不同水库的藻类群体结构进行了比较分析,成功鉴定了包括绿藻门、隐藻门等在内的多种藻细胞.
本次实验中我们聚焦于冈比亚藻,将RFLP技术用于冈比亚藻的分类鉴定中.以冈比亚藻D1-D2保守区域为切入点,筛查了10余种限制性内切酶,按照产物最少、成本最省的原则优选了Aci I内切酶.该酶获得的酶切图谱具有较好的区分度,能有效识别目前已有的主要冈比亚藻种.从验证的7种待检藻种来看,条带图谱清晰、特异,能借助肉眼进行快速识别,证明了所建方法的有效性.随后的野外样品验证中,分子测序方法与该方法有较好的吻合度和重现性,证实了Aci I内切酶的可靠性.然而,受限于冈比亚藻的材料来源,我们未能获得上述10种冈比亚藻种的酶切指纹图谱,而只对本课题组已有冈比亚藻进行了酶切分析,给后续的研究遗留了一定的空间.在未来的工作中,我们将通过各种方式(国际交往、航次考察、种源购买)力争获取更为广泛的样品来源,获取它们的酶切指纹图谱,将Aci I作用下的酶切分型进行精细验证,构建冈比亚藻的指纹图库,为冈比亚藻的准确鉴定和快速识别提供理论依据和借鉴方法.
4 结 论
根据已有数据库冈比亚藻的序列信息,经生物软件分析找到了限制性内切酶Aci I可分离目前已鉴定的10种冈比亚藻.通过酶切电泳实验获得了本课题组拥有的已被鉴定的7种冈比亚藻种的酶切片段和电泳图谱,然后通过对分离自加勒比海域的5株未知冈比亚藻的酶切和DNA测序分析,确定了这5株藻分别为G.carpenteri和G.carolinianus,因此我们认为Aci I能初步鉴定上述的冈比亚藻.为了进一步验证和优化该限制性内切酶的特异性和检测限,后续实验应对目前已发现的所有冈比亚藻种进行酶切和测序验证,为开发检测灵敏度更高的荧光T-RFLP提供实验基础.
致谢 本文部分测序工作由伍兹霍尔海洋研究所(USA)的Mindy Richlen副教授协助完成,谨致感谢.
[1] Dickey R W,Plakas S M.Ciguatera:a public health perspective[J].Toxicon,2010,56(2):123-136.
[2] Russell F E,Egen N B.Ciguateric fishes,ciguatoxin (CTX)and ciguatera poisoning[J].Toxin Reviews,1991, 10:37-62.
[3] Lehane L,Lewis R.Ciguatera:recent advances but the risk remains[J].International Journal of Food Microbiolohy,2000,61:91-125.
[4] Poon-King C M,Chen A,Poog-King T.Ciguatera fish poisoning in industrial ship crewmembers:a retrospective study in a seaport general practice in Trinidad and Tobago[J].West Indian Medical Journal,2004,53:220-226.
[5] Litaker R W,Vandersea M W,Faust M A,et al.Global distribution of ciguatera causing dinoflagellates in the genus Gambierdiscus[J].Toxicon,2010,56(5):711-730.
[6] Hales S,Weinstein P,Woodward A.Ciguatera(fish poisoning),El Niño,and Pacific Sea surface temperatures [J].Ecosystem Health,1999,5(1):20-25.
[7] Richlen M L,Morton S L,Barber P H,et al.Phylogeography,morphological variation and taxonomy of the toxic dinoflagellate Gambierdiscus toxicus(Dinophyceae)[J]. Harmful Algae,2008,7(5):614-629.
[8] Litaker R W,Vandersea M W,Faust M A,et al.Taxonomy of Gambierdiscus including four new species,Gambierdiscus caribaeus,Gambierdiscus carolinianus,Gambierdiscus carpenteri and Gambierdiscus ruetzleri(Gonyaulacales,Dinophyceae)[J].Phycologia,2009,48(5): 344-390.
[9] 徐轶肖,江涛.雪卡毒素产毒藻(冈比亚藻)研究进展[J].海洋与湖沼,2014,45(2):244-252.
[10] Richlen M L,Lobel P S.Effects of depth,habitat,and water motion on the abundance and distribution of ciguatera dinoflagellates at Johnston Atoll,Pacific Ocean [J].Marine Ecology Progress Series,2011,421:51-66.
[11] Holmes M J,Lewis R J,Poli M A.Strain dependent production of ciguatoxin precursors(gambiertoxins)by Gambierdiscus toxicus(Dinophyceae)in culture[J]. Toxicon,1991,29(6):761-765.
[12] Xu X,Richlen M L,Morton S L,et al.Distribution,abundance and diversity of Gambierdiscus spp.from a ciguatera-endemic area in Marakei,Republic of Kiribati [J].Harmful Algae,2014,34:56-68.
[13] 罗建飞,林炜铁,任杰,等.T-RFLP技术及其在硝化细菌群落分析中的应用[J].微生物学通报,2008,35(3): 456-461.
[14] Dickie I A,FitzJohn R G.Using terminal restriction fragment length polymorphism(T-RFLP)to identify mycorrhizal fungi:a methods review[J].Mycorrhiza, 2007,17:259-270.
[15] Joo S,Lee S R,Park A.Monitoring of phytoplankton community structure using terminal restriction fragment length polymorphism(T-RFLP)[J].Journal of Microbiology Methods,2010,81:61-68.
[16] Keller M D,Guillard R L.Factors significant to marine dinoflagellte culture[M]∥Andorson D M,White A W, Baden D C.Toxic dinoflagellates.New Xork:Elsevier, 1985:113-116.
[17] Scholin C A,Anderson D M.Identification of group and strain-specific genetic markers for globally distributed Alexandrium(Dinophyceae):II.RFLP analysis of LSU r RNA genes[J].Journal of Phycology,1994,30: 999-1011.
[18] Chang W,Um X,Holoman T R P.Polycyclic aromatic hydrocarbon(PAH)degradation coupled to methanogenesis[J].Biotechnology Letter,2006,28:425-430.
[19] Scholin C,Hallegraeff G,Anderson D.Molecular evolution of the Alexandrium tamarense species complex (Dinophyceae):dispersal in the North American and West Pacific regions[J].Phycologia,1995,34:472-485.
[20] Tomohiro N,Shinya S,Wittaya T,et al.Genetic diversity and distribution of the ciguatera-causing dinoflagellate Gambierdiscus spp.(Dinophyceae)in coastal areas of Japan[J].PLoS ONE,2013,8(4):e60882.doi: 10.1371/journal.pone.0060882.
LSU r DNA Based on RFLP Assays for Distinguishing Species of Gambierdiscus spp.
LÜXi-hua1,ZHOU Jin2,ZHENG Wei1,GAO Xan3,XU Zhi-ming3,ZHENG Tian-ling1*
(1.Key Laboratory of the Coastal and Wetland Ecosystems,Ministry of Education,School of Life Sciences, Xiamen University,Xiamen 361102,China;2.The Division of Ocean Science and Technology,Graduate School at Shenzhen,Tsinghua University,Shenzhen 518055,China;3.Key Laboratory of Marine Ecology and Environmental Sciences,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China)
Ciguatera fish poisoning(CFP)is a serious seafood poisoning syndrome caused by the consumption of seafood contaminated with ciguatoxins.The toxic organisms most commonly associated with CFP are benthic dinoflagellates in the genus Gambierdiscus.To establish molecular monitoring for the Gambierdiscus community in tropical seas,we analyzed the restriction fragment length polymorphism(RFLP)of large subunit ribosomal(LSU)rDNA sequences of D1-D2 region from ten Gambierdiscus species and several environmental samples.Results showed that the restriction enzyme AciI was able to identify LSU rDNA heterogeneities of Gambierdiscus species,repeatedly and sensitively.Therefore,the assay in this study could be established to monitor Gambierdiscus species in the environments and trace the changes of Gambierdiscus community in the ocean.
ciguatera;Gambierdiscus spp.;restriction fragment length polymorphism(RFLP);Aci I;D1-D2
10.6043/j.issn.0438-0479.2015.02.006
Q 331
A
0438-0479(2015)02-0182-06
2014-08-19 录用日期:2014-11-04
国家海洋公益性行业专项(201305016,201305022);国家基金委-山东省联合基金项目(U1406403)
*通信作者:wshwzh@xmu.edu.cn
吕意华,周进,郑伟,等.一种基于RFLP分析的冈比亚藻检测方法的建立[J].厦门大学学报:自然科学版,2015,54 (2):182-187.
:LüXihua,Zhou Jin,Zheng Wei,et al.LSU r DNA based on RFLP assays for distinguishing species of Gambierdiscus spp.[J].Journal of Xiamen University:Natural Science,2015,54(2):182-187.(in Chinese)
