大豆炸荚发生规律及分子遗传基础
2015-10-13韩德志任玉龙郭勇闫洪睿张雷鹿文成邱丽娟
韩德志,任玉龙,郭勇,闫洪睿,张雷,鹿文成,邱丽娟
1.黑龙江省农业科学院黑河分院,黑河 164300;
2.中国农业科学院作物科学研究所,国家农作物基因资源与遗传改良重大科学工程,农业部北京大豆生物学重点实验室,北京 100081
大豆炸荚发生规律及分子遗传基础
韩德志1,2,任玉龙2,郭勇2,闫洪睿1,张雷1,鹿文成1,邱丽娟2
1.黑龙江省农业科学院黑河分院,黑河 164300;
2.中国农业科学院作物科学研究所,国家农作物基因资源与遗传改良重大科学工程,农业部北京大豆生物学重点实验室,北京 100081
炸荚是野生大豆繁衍后代的一种原始自然属性,同时也是栽培大豆减产的主要原因之一,因此对其发生规律和分子遗传基础的研究具有重要的理论意义和潜在的育种应用价值。文章在剖析抗炸荚大豆荚部细胞学微观组织结构特征的基础上,总结了大豆炸荚的发生规律和大豆炸荚表型性状的鉴定指标与方法,介绍了抗炸荚种质鉴定与抗炸荚品种选育概况,同时详细阐述了大豆抗炸荚性状的分子遗传基础研究进展,最后对大豆抗炸荚性的研究与应用进行了展望。
炸荚性状;细胞结构;炸荚检测;遗传规律;抗炸荚育种
炸荚是野生大豆的一个典型特征。Harpe[1]形象地把在特定时期大量种子从植株上降落的现象称为种子雨。炸荚是栽培大豆(Glycine max L.Merr)祖先种——野生大豆(Glycine soja)繁衍后代的一种自然属性,然而,炸荚现象的存在也是导致栽培大豆产量损失的主要因素之一。早在1989年,印度学者Philbrook和Oplinger便对热带和亚热带的大豆种植区中大豆炸荚造成的损失进行了统计,发现易炸荚和中度炸荚大豆品种的田间产量损失分别为57~175 kg/hm2和0~186 kg/hm2[2]。根据张跃进等[3]的报道,我国黄淮流域主栽大豆品种因炸荚造成的田间产量损失也在112.5 kg/hm2左右,由此可见,大豆炸荚的发生给国内外大豆产业均带来了十分严重的损失。因此,大豆炸荚发生规律以及分子遗传基础方面的研究不仅具有理论意义,更具有潜在的实际应用价值。本文首先从细胞学角度剖析了大豆炸荚发生的结构特征,进而分析了大豆炸荚性状的遗传规律特点,总结了环境因素对炸荚的影响,最后从分子遗传学角度详细阐述了目前关于大豆炸荚分子标记开发与关键基因克隆及其功能研究的最新进展,旨在为今后大豆炸荚性状的研究提供参考。
1 大豆炸荚的概念
大豆豆荚属于荚果的一种,是由单心皮发育而来的果实。大豆完熟期时,因豆荚水分含量相对较低,致使豆荚的内生厚壁组织层细胞的张力发生改变,荚皮围绕着与内生后壁组织层的纤维方向的平行轴呈螺旋扭转而卷曲,进而将连接背、腹缝线的薄壁组织拉裂,最后,荚皮开裂的现象称之为炸荚[4,5](图1:A、B、C)。
2 大豆炸荚发生的细胞学结构特征
大豆品种间豆荚形态特征各异,同时大豆品种的炸荚表现形式也各不相同,暗示炸荚现象的发生可能与豆荚的组织结构特征密切相关。Carlson等[6]研究表明,大豆豆荚内部厚壁层细胞水分丢失后产
生的扭转拉力是炸荚发生的诱因;Tsuchiya[7]和Tiwari等[8]对栽培大豆豆荚的形状、大小与炸荚率之间的关系进行了研究,发现抗炸荚品种豆荚的厚度与宽度的比值相对较大,豆荚的背部包帽的厚度、长度及荚皮厚度等3个荚部特征与炸荚呈显著负相关;Christiansen等[9]和Summers等[10]则提出,在栽培大豆豆荚的背部和腹部的缝合线处存在类似于十字花科植物开裂区(Dehiscence zone)的类似结构(图1:D、E),该结构与大豆抗炸荚能力密切相关。

图1 大豆炸荚性状相关表型图与荚部解剖图A:大豆R6(鼓粒期)时期荚部形态;B:大豆R8(完熟期)时期炸荚形态;C:大豆R6时期横向解剖图;D:大豆腹缝线解剖图;E:大豆背缝线解剖图。
董阳等[11]以抗炸荚栽培大豆品种黑农44和易炸荚的野生大豆ZYD00755为实验材料,利用细胞学的研究手段证实,与野生大豆ZYD00755相比较,栽培大豆黑农44豆荚腹缝线处纤维帽细胞(Fibre cap cell,FCC)次生细胞壁显著增厚,而该处的离层结构无明显差异(图2B),暗示FCC细胞次生细胞壁的增厚是栽培大豆品种具备抗炸荚性的主要因素。近期,Funatsuki等[12]研究发现,在低湿度条件下,荚皮厚壁组织中富含木质素的细胞参与调控荚皮的扭曲力进而控制豆荚的开裂与否。
综上所述,大豆抗炸荚的细胞学结构特征较多,正向遗传学的研究已经相继证实豆荚腹缝线中FCC细胞次生细胞壁的厚度以及荚皮厚壁组织扭曲力的大小均是调控荚皮开裂的主要因素。鉴于上述用遗传学方法研究双亲的特殊性和大豆炸荚现象的多样性,相信后续的研究将会更加详细地解析大豆炸荚发生的细胞学结构特征。
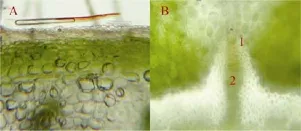
图2 大豆荚皮与腹缝线开裂区解剖图A:大豆荚皮解剖图;B:大豆腹缝线开裂区放大图。1:FCC细胞;2:AL细胞。
3 大豆炸荚发生规律及其影响因素
大豆炸荚造成的产量损失是大豆机器化生产中的主要损失之一。因此,为减少不必要的损失,许多学者对大豆炸荚的发生规律进行了研究。李启干等[13]和彭玉华等[14]对我国黄淮流域主栽大豆品种的炸荚特性进行了统计分析,结果表明不同大豆品种从完熟期到开始炸荚的时间差异较大,多数品种6~10 d即开始炸荚,也有少数品种表现为完熟期即炸或者收获时仍不炸荚,表明大豆炸荚是一个受多因素影响的数量性状。目前,普遍认为遗传与环境是影响大豆炸荚的两大因素,其中遗传是内因,环境因素是外因,二者共同调控大豆炸荚的发生。
3.1 大豆炸荚的遗传因素
彭玉华等[14~16]研究表明,相同环境因素下,不同大豆品种间的抗炸荚能力差异显著。Nilmani等[17]的调查发现,大豆完熟期后10 d,参试材料的炸荚率在0.67%~67.05%之间,暗示遗传背景对大豆炸荚发生的影响巨大。大量研究表明,大豆炸荚是一个主效基因+微效多基因共同调控的数量性状。其中,控制炸荚性状的主效基因表现为显性,其他非等位基因与其表现为加性效应,共同调控炸荚性状[18~24]。
3.2 大豆炸荚的环境因素
环境因素对大豆炸荚的发生具有双重影响。比如我国北方秋季多数以干旱天气为主,空气干燥,大豆发生炸荚现象较多,而个别降雨偏多的年份,大豆则不发生炸荚。大豆炸荚主要是发生在完熟期,大豆成熟后植株及荚部生理脱水,在一定的环境条件下诱发炸荚。Metcalfe等[25]最早提出,相对湿度是影响豆科作物炸荚的主要环境因素,随后Caviness等[26]的研究也证明了此观点;Tsuchiya等[27]研究发现,低湿、高温、快速的温度变化及其多因素交替出现是大豆发生炸荚的普遍诱因,但没有鉴定出影响炸荚的任何特定环境因子;Bailey等[28]、Romkaew等[29]也相继提出影响大豆炸荚的重要环境因素是相对湿度;张跃进等[3]与马赛斐等[15]的研究表明,空气的相对湿度与炸荚率呈极显著负相关,说明空气的相对湿度是造成炸荚的主要外因,同时还提出炸荚率与日照时间长短、日平均气温无明显的相关性;杨德旭等[30]以辽宁省主栽大豆品种沈农12、95-1和辽豆14为研究对象,运用微机控制的电子拉压试验机进行豆荚的静压炸荚试验,结果表明,当大豆籽粒含水率在25%以下、豆壳含水率15%以下,大豆发生炸荚,大豆炸荚与品种自身荚部的含水率关系很大,大豆顶部、中部和底部的豆荚与炸荚率无显著差异。
综上所述,诱导大豆发生炸荚的环境因素是空气中的相对湿度。快速变化的环境因素是导致大豆籽粒与荚皮水分含量下降的关键因素,虽不能定量的描述豆荚发生炸荚的水分的临界值,但当豆荚水分含量下降到炸荚临界值时,易炸类型大豆发生炸荚现象。而温度、光照强度、日照时数、风速、气压、土壤水分等一系列环境因素的变化都会影响到空气的相对湿度,从而间接影响大豆炸荚。
4 大豆炸荚表型鉴定
炸荚表型的鉴定是抗炸荚理论基础研究与品种选育的根本前提。国内外学者在大豆抗炸荚表型鉴定指标与鉴定方法方面开展了大量相关研究,并取得了一定进展。
4.1 炸荚表型鉴定指标
4.1.1 炸荚率
炸荚率是大豆炸荚表型鉴定的主要判断依据,炸荚率是已炸荚数×100%/总荚数[14],炸荚率既可以对群体材料进行炸荚表型评价,也可以对单株材料进行炸荚表型鉴定。早在1979年亚洲蔬菜研究与发展中心(AVRDC)首先利用炸荚率将大豆炸荚表型进行分级,其中将炸荚率为0%定为1级(高抗炸荚),炸荚率在0%~10%之间定为2级(抗炸荚),炸荚率在11%~25%之间定为 3级(中抗炸荚),炸荚率在26%~50%之间定为4级(中度炸荚),炸荚率在50%以上定为5级(重度炸荚)[21];2002年Tukamuhabwa等人根据炸荚率指标,并在AVRDC大豆炸荚分级方法的基础上成功对参试材料进行了分级[31];张跃进[3]和马赛斐等[15]根据炸荚率指标,将田间大豆成熟10 d后的炸荚表型性状分为6级,分别为:0级(不炸荚)、Ⅰ级(0%~1%)、Ⅱ级(1%~5%)、Ⅲ级(5%~ 10%)、Ⅳ级(10%~30%)和Ⅴ级(大于30%);Zhang等[32]根据田间炸荚率将评价标准又进一步细分为8级,包括1级(炸荚率0%)、2级(0%~2%)、3级(2%~5%)、4 级 (5%~10%)、 5 级 (10%~15%)、 6 级(20%~30%)、7级(35%~50%)和8级(60%~100%)。无论是室内鉴定还是田间评价大豆炸荚表型性状,炸荚率都是首要检测指标。
4.1.2 荚皮厚度
荚皮厚度是指荚皮内层厚壁组织到外层厚壁组织的总厚度。Tiwari和Bhatia[8]研究发现,荚背部的包帽的厚度、长度及荚壁厚度与炸荚程度呈显著负相关。荚皮厚度是大豆荚部最容易观察的部位。因此,可以利用显微镜观察大豆荚皮厚度,进而判断大豆品种的炸荚情况。但需要注意的是,取样时间和观察部分应保持高度一致。
4.1.3 开裂区
Christiansen等[9]最早提出,在大豆背部和腹部的缝合线横切面处存在开裂区;Summers等[10]提出抗炸荚能力很可能与荚皮结构或开裂区相关,而不是与荚的大小相关。大豆荚部开裂区概念的提出,为科研人员研究大豆炸荚性状的结构特征指明了方向。董阳等[11]研究证实,栽培大豆豆荚腹缝线处的FCC细胞的次生细胞壁显著大于野生大豆。因此,可以通过观察大豆品种豆荚腹缝线处的FCC细胞情况,来精准判断炸荚与否。
4.2 炸荚表型鉴定方法
4.2.1 田间调查法
科研人员在大豆炸荚研究的初始阶段多数采用田间调查法,主要是调查试验区内大豆植株的炸荚率,依据总炸荚数或某个时期的炸荚数评定大豆炸荚程度。彭玉华等[14]利用田间调查法在河南正阳县大豆试验站,对黄淮流域的30个大豆品种(系)的炸荚表型进行了鉴定,发现田间炸荚的动态类型分为单峰型、单峰延迟型、双峰型和双峰提高型;张跃进[3]和马赛斐等[15]利用田间调查法在河南黄泛区农场农科所对黄淮流域另外32个大豆品种进行32 d跟踪调查,初步明确了田间大豆炸荚表型鉴定的最佳时期;Zhang等[32]在2007~2009年间,成功利用田间调查法对公共机构和私人种子公司的第四熟期组品种进行抗炸荚评价。尽管田间调查法具有方便、快捷、直观等优点,但受环境因素影响较多,导致结果的精确性较差,该方法仅能对炸荚表型差异较大的材料进行粗略分析。目前,在我国抗炸荚大豆品种选育及试验中,田间调查法依然是抗炸荚鉴定的首选方法。
4.2.2 实验室干燥法
干燥法是实验室鉴定大豆炸荚表型的主要方法之一,分为玻璃干燥器法和烘箱干燥法。玻璃干燥器法是将豆荚置于玻璃容器内,经一定时间段的干燥后,因豆荚的水分含量下降而发生炸荚,以炸荚数量判定参试材料的炸荚性;烘箱干燥法是利用烘箱对豆荚进行烘干,设置烘箱的温度与烘干时间,将参试材料根据炸荚情况分为敏感炸荚型和抗炸荚型。Tsuchiya等[27]利用烘箱干燥法进行研究,将豆荚分别放于温度处理40℃、60℃、80℃,干燥持续时间5 h、7 h、24 h的烘箱,然后,测定炸荚率来评价参试材料炸荚性,但干燥法因取样时期、烘箱温度以及持续时间等因素的差异,有待进一步细化研究。Romkaew等[29]分别利用玻璃干燥器法和烘箱干燥法对日本和泰国品种进行炸荚表型检测:玻璃干燥器法中持续天数分为3 d、5 d、7 d、14 d、21 d、28 d、35 d;他们在前人研究的基础上,对烘箱干燥法的温度和持续时间进行了优化:烘箱温度调整为60℃,持续时间为2 h、4 h、7 h,最终证明干燥器法与烘箱干燥法评价大豆炸荚的程度几乎相同。该研究认为干燥器法干燥14 d与置于烘箱干燥法60℃持续烘干7 h的方法均有效,可用于炸荚表型检测。Tukamuhabwa等[31]对烘箱干燥法进行了进一步的优化,将取样时期修正为95%豆荚已达到生理成熟(R8时期),用纸袋(5 cm×10 cm×20 cm)摘取,将纸袋放置在温度与水分含量恒定的室内10 d,然后放入80℃烘箱,持续12 h,最后依据AVRDC大豆炸荚分级方法对上述样品进行分级,以此来判断参试材料的炸荚性。考虑到参试材料的多样性,取样时间和取样方法的差异,实验室干燥法还具有很大的优化空间,尚处于摸索阶段。
4.2.3 随机碰撞测验法(Random impact test,RIT)
RIT法是将豆荚和钢球放在塑料容器内,借助摇床高速震荡进行随机碰撞,以测定炸荚半数所需的时间来判定相关品种的炸荚率[33]。该方法已在油菜抗裂角性研究中得到应用,目前大豆尚未应用。RIT法设备简单,便于快速测定,但容器、小钢球以及震荡频率的选择,是该方法成功的关键。在大豆炸荚表型鉴定中应用该方法,重点是确定大豆豆荚的取样时期与取样方法,同时将容器的大小、钢球的大小、震荡频率的大小、震荡持续时间等关键因素进行多因素组合试验,筛选出最佳组合条件来评价大豆的炸荚性。
上述3种鉴定大豆炸荚表型的方法均简单易行,操作方便,但各种外界因素都会影响测定结果的精准性,还需要不断改进来完善炸荚表型的鉴定方法。3种鉴定方法各有其优缺点,田间调查法具有简单直观、易于操作的优点,该方法的不足在于鉴定的环境条件很难保持一致,鉴定时易受大豆成熟后气候条件的影响,即使在同一年份内鉴定的材料,不同熟期的大豆种质所处的气候条件也不同,鉴定结果也会存在差异。与田间调查法相比,干燥法和随机碰撞法具有鉴定条件一致的优点,但不同大豆种质成熟时豆荚的含水量不同,也会影响鉴定结果。由此可见,无论采用哪种方法都需要进行重复鉴定。因此,创新精准鉴定方法,综合准确评价大豆炸荚性状,是大豆炸荚研究亟待解决的问题。
5 抗炸荚种质鉴定与品种选育
5.1 抗炸荚种质鉴定
大豆抗炸荚资源筛选与鉴定是抗炸荚品种选育的基础,科研人员利用不同鉴定方法鉴定出一大批抗性种质。其中,田间调查法鉴定的抗性种质较多,尽管调查标准略有不同,但抗性种质的炸荚率均在5%以下,共计39份[3,14,28,34,35],Zhang等[32]利用田间调查法对密西西比州公共机构和种子公司的第四熟期组品种进行抗炸荚评价,3年鉴定出炸荚率不超过5%的材料分别为45份、17份、69份,具体品种名单公布在Mississippi大豆官方平台;相比而言,利用干燥法鉴定出的高抗材料相对较少,只有26份[7,16,29,31,36~38],而RIT法目前在大豆炸荚研究尚未实际应用。需要指出的是,在抗炸荚性遗传研究中已经应用的抗炸荚种质有20份,分别是Young、Hayahikari、Yukihomare、Toiku 238、Toiku 239、Harosoy、Nam 2、Roan、Duiker、TGx 1448-2E、GC 81090-48、Sinpaldalkong、Iksan 10、Tokei 992、Kariyutaka、Suzuotome、Tachiyutaka、Tsuyahomare、CM 3和晋豆23,详见表1。
5.2 抗炸荚品种选育
国内外学者对抗炸荚大豆品种育种方法研究较少,一般在抗炸荚育种中,通过后延选种日期,可以鉴定出对环境耐受能力较强且含有抗炸荚基因的材料。Agrawal等[39]利用5个大豆品种进行杂交,发现后代F1炸荚表型不具有超亲优势,明确了抗炸荚育种中亲本选配的重要性。可见,高抗炸荚品种选育的关键是杂交亲本的选择,包括亲本的综合农艺性状、亲本抗炸荚情况以及杂交组合的数量,都会影响到育种目标。目前生产上的大豆品种多数抗炸荚,但抗炸程度差异很大。例如,黑河43号保留了亲本黑河18号高产优质抗病特性的同时,改良了黑河18号炸荚的不良特性,黑河18号的炸荚基因可能来源黑河野生豆3-A。抗炸荚品种黑河43号的选育成功,关键在于杂交组合中父本黑河23号的选择,黑河23号与黑河18号有着相似的遗传背景(图3),均聚合了俄罗斯、美国、日本以及国内优良骨干材料的遗传基因,符合杂交亲本优×优略带缺点的配置原则。然而,需要指出的是,改良炸荚性状本身固然重要,但单一改良炸荚,丢失其他优良性状,所选出的材料仅能作为中间材料而利用[40]。到目前为止,国内已公开报道的抗炸荚品种较少,仅6个[40~44](表2),这些抗炸荚品种为抗炸荚性状的遗传研究以及抗炸荚品种选育奠定了基础。
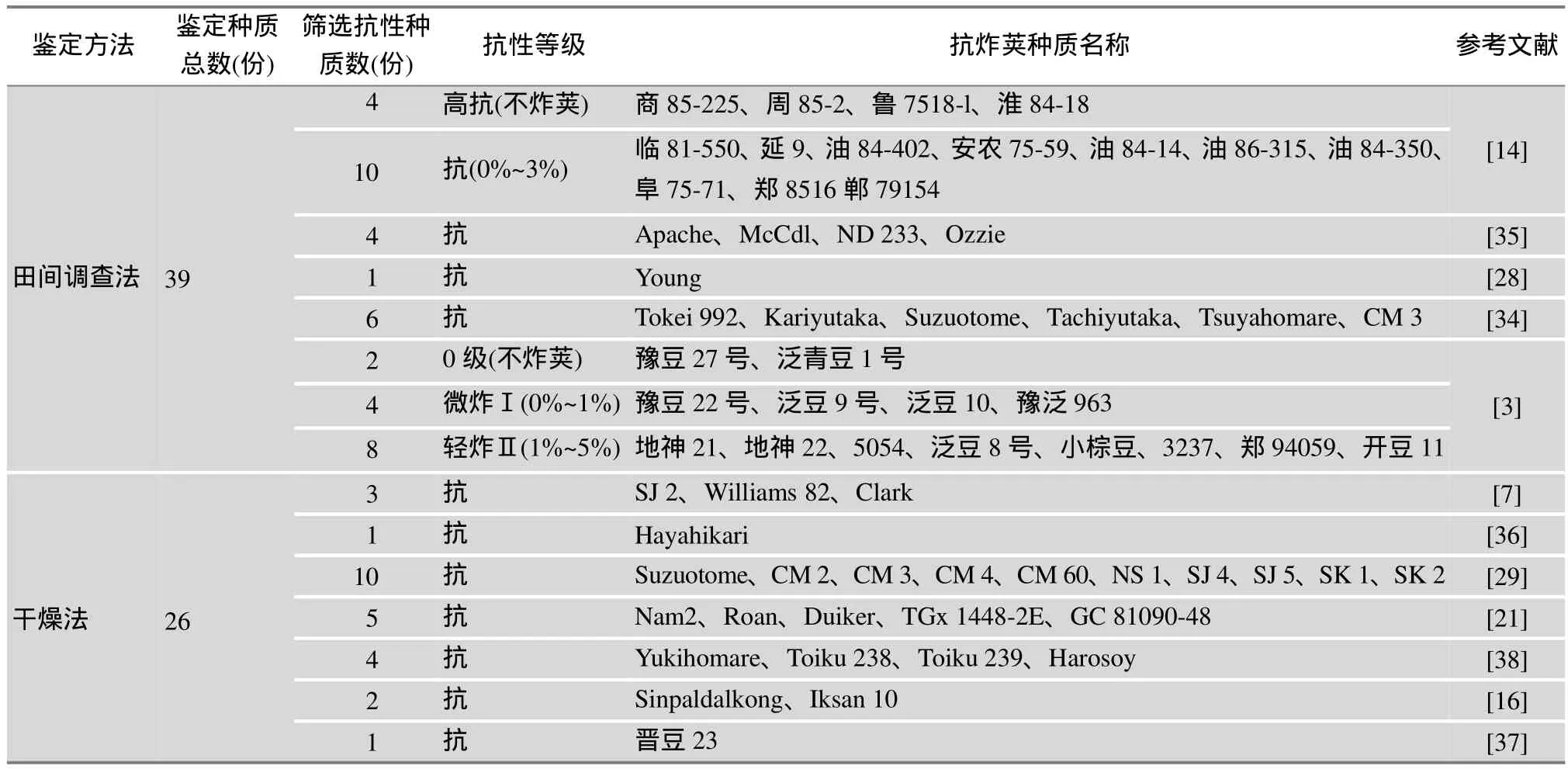
表1 国内外抗炸荚种质鉴定情况
6 大豆抗炸荚基因的定位、标记开发及克隆
6.1 大豆抗炸荚基因的定位与分子标记开发
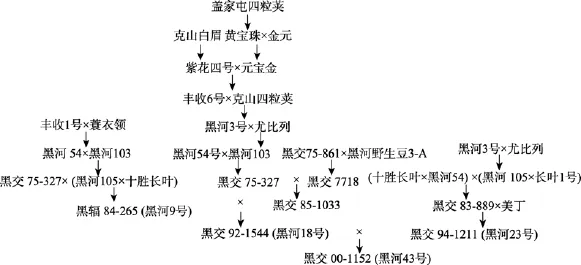
图3 黑河43号遗传系谱
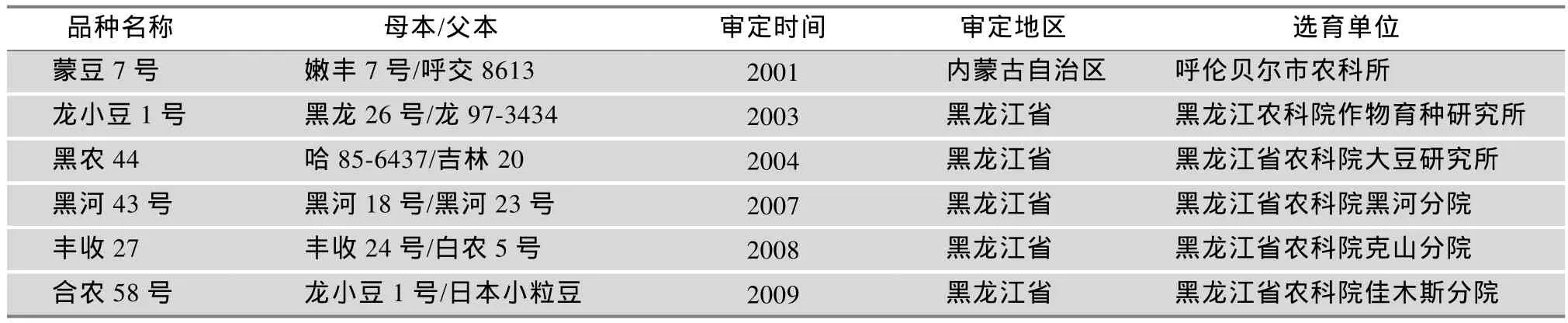
表2 国内明确抗炸荚大豆品种选育
随着生物技术的迅速发展,开发了RAPD(随机扩增多态性)、RFLP(限制性内切酶片段长度多态性)、AFLP(扩增片段长度多态性)、SSR(简单重复序列)等大量分子标记应运而生,其中SSR标记、RFLP标记已在大豆炸荚QTL定位研究中广泛应用[45]。1997年,Bailey等[28]以美国的栽培大豆品种Young与野生大豆PI416937为研究对象,运用RFLP标记技术构建了大豆的遗传连锁图谱,首次鉴定出控制大豆炸荚的1个主效QTL,该QTL位于16号染色体,与分子标记B122-1连锁;日本科学家对抗炸荚基因定位进行了系统研究,Funatsuki等[36]于2006年利用炸荚性状差别较大的两个栽培大豆构建的RIL(重组自交系)群体进行QTL分析,通过CIM法(复合区间区位作图法),验证了位于16号染色体上的Sat_093和Sat_366两个SSR标记间的1个主效QTL,并估算该QTL的遗传距离为2.9 cM。随后他们利用4个不同遗传背景的大豆材料,再次证明了这个QTL具有重演性,将该主效QTL命名为qPDH1,可解释表型变异率的50%,并发现在不同的遗传背景下该位点具有复等位基因[22];Suzuki等[34]进一步将qPDH1区间缩小到第16号染色体的134 kb区域,预测该区域包含10个基因,但这些基因在拟南芥中均未发现同源基因;2014年,Funatsuki等[12]的研究有了进一步的突破,图位克隆了16号染色体已报道的QTL“qPDH1”附近的基因pdh1,并明确了该基因在干旱或半干旱地区对抗炸荚性状的重要作用;Kang等[16]利用一个韩国本地炸荚敏感品种Keunolkong与两个抗炸荚品种Sinpaldalkong和Iksan 10分别创制了两个RIL群体进行QTL分析,利用Keunolkong× Sinpaldalkong创制的RIL群体定位了1个主效QTL和3个微效QTL,主效QTL位于第16号染色体SSR标记Satt 183和Satt 215之间,与qPDH1位置接近,而利用Keunolkong×Iksan 10创制的RIL群体定位了3个微效QTL,虽然鉴定利用的两个群体有着同一亲本,但定位的结果差别很大,推测是由于品种Iksan 10因辐射育种选育导致的背景变异有关。2013年Gao等[22]利用已报道的定位信息,重新创制Young与野生大豆PI416937的RIL群体,通过开发的12个SNP(单核苷酸多态性),将qPDH1锁定在SNP6与SNP10之间的 47 kb的区域内,并预测出Gm16g25610和Gm16g25600两个基因。国内抗炸荚基因分子标记研究起步较晚,且仅有一例报道,国内罗汝叶等[37]利用大豆RIL群体112个株系,采用CIM法,在C2连锁群(即第6染色体)上检测到一个控制豆荚开裂的QTL,命名为qPDH6-1,位于SSR标记 Satt 062和Satt 520之间,与抗炸荚基因的遗传距离为3.1 cM,可解释的表型变异率为49.44%。该基因与国外定位的基因不在同一染色体上,有可能是一个新的抗炸荚基因。大豆炸荚性状的相关QTL信息详见表3。
迄今为止,大豆炸荚遗传和基因定位所用的亲本有两类:一是栽培大豆与野生大豆种间杂交;二是不同栽培大豆品种间杂交。由于定位亲本不同,遗传背景差异比较大,定位的QTL可解释的遗传效应差异也较大。
6.2 大豆炸荚关键基因的克隆及功能研究
目前大豆炸荚基因的克隆与功能研究报道尚少。2014年董阳等人以抗炸荚品种黑农44与炸荚的野生大豆ZYD00755为研究对象,在16号染色体的116 kb区域内,克隆一个抗炸荚的基因,命名为SHAT1-5。进一步利用实时定量PCR研究了该基因的表达情况,发现该基因在厚壁组织细胞(叶、幼根、花)的表达量很低,但在茎、果实这些含有次生细胞壁的组织中表达量很高,证实在黑农44中该基因通过调控FCC细胞次生细胞壁的增厚增强,进而形成抗炸荚性[11];近期,Funatsuki等[12]图位克隆了抗炸荚基因pdh1,在低湿度条件下,该基因通过降低荚皮表面的扭曲力来降低大豆炸荚性,结合种质资源筛选工作,证实该基因广泛分布在干旱或半干旱地区,该基因对全球大豆扩张起到重要作用。
综上所述,不难发现,尽管二者都是调控大豆炸荚的关键因子,但其作用方式截然相反:SHAT1-5是调控大豆抗炸荚性状的正调控因子,栽培大豆中高表达SHAT1-5基因可以显著提高腹缝线FCC细胞中次生细胞壁的厚度进而增强豆荚的抗炸荚性,而Pdh1是调控大豆抗炸荚的负调控因子,Pdh1的功能丧失等位基因phd1可以通过降低荚皮的扭曲力来抑制大豆炸荚。大豆炸荚性状的表现形式多种多样,暗示大豆炸荚是一个受多基因调控的复杂过程,其中任一环节的变化都可以促进或抑制豆荚的炸裂。因此,未来需要挖掘更多的参与调控大豆炸荚的基因,最终描绘大豆炸荚/抗炸荚的分子网络途径,为现代大豆育种服务。
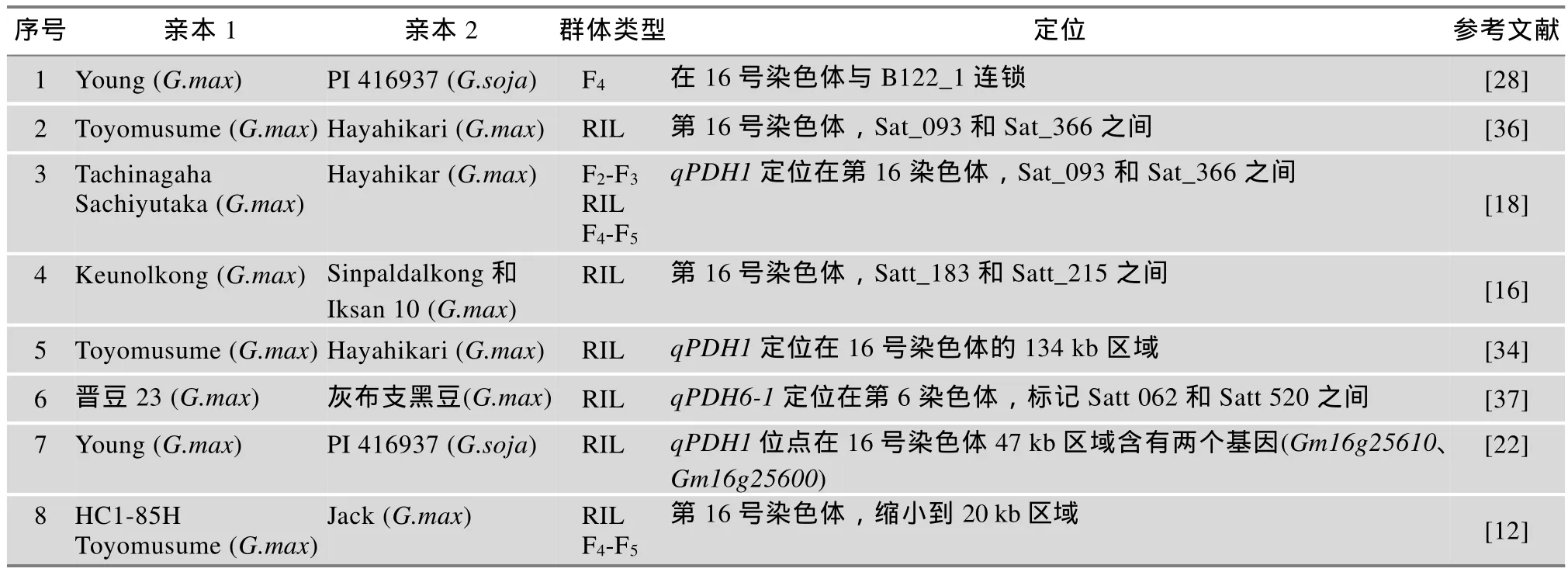
表3 大豆炸荚相关的QTL信息
7 结语与展望
大豆炸荚性状的描述较多,炸荚、裂荚、豆荚开裂等词在文献中都有使用,作者认为“炸荚”一词中“炸”字非常形象地描述了大豆炸荚的动态过程。大豆炸荚易受环境条件影响,且不同基因型大豆品种与环境因子互作强弱差异较大,因此,该性状的研究难度很大。目前,大豆炸荚的表型鉴定存在一定的差异,不同的研究方法获得的研究结果差异较大。如何获得精准的表型鉴定数据,将环境因素对炸荚的影响降到最低是该领域今后研究的重点。应用精准的炸荚鉴定方法评价大豆种质很有必要,为基础和应用研究提供材料保障。
目前,对抗炸荚主效基因pdh1研究的比较深入,如Suzuki等[11,12]观察了pdh1豆荚的炸荚过程,该基因参与荚皮内层厚壁组织木质素起始阶段的沉积,而SHAT1-5基因参与FCC细胞中次生细胞壁的增厚,进而起到抑制炸荚作用,这说明抗炸荚性是比较复杂的性状,任一环节的变化都可能抑制或促进大豆豆荚的炸裂。因此,在大豆抗炸荚的研究中,一方面可利用已克隆的大豆抗炸荚基因开发功能标记,分析其实用性,筛选优异的等位变异,为分子标记选择育种提供材料和方法;另一方面,抗炸荚性是多基因控制的数量性状,应继续挖掘新的抗炸荚基因和调控因子,明确基因的作用机理及调控网络,为基因的有效利用提供理论支撑。最终应用现代生物技术手段,实现对大豆抗炸荚基因的定向监测,缩短育种进程,加快抗炸荚性大豆新品种的培育与推广。
[1]Harper JL.Population biology of plants.London: Academic Press,1977:33–60.
[2]Philbrook BD,Oplinger ES.Soybean field losses as influenced by harvest delays.Agron J,1989,81(2): 251–258.
[3]张跃进,马赛斐,高启云,罗家传.黄淮流域主栽大豆品种炸荚性研究.河南农业科学,2006,(6):56–59.
[4]董钻.大豆产量生理.北京:中国农业出版社,2000: 17–18.
[5]王连铮,郭庆元.现代中国大豆.北京:金盾出版社, 2007:199–200.
[6]Carlson JB,Lersten NR.Morphology in soybeans improvement production and uses. Madison, WI: American Society of Agronomy,1987:303–406.
[7]Tsuchiya T.Physiological and genetic analysis of pod shattering in soybean.Jpn Agr Res Quart,1987,21(3): 166–175.
[8]TiwariSP,Bhatia VS.Characters ofpod anatomy associated with resistance to pod-shattering in soybean. Ann Bot,1995,76(5):483–485.
[9] Christiansen LC,Dal Degan F,Ulvskov P,Borkhardt B. Examination of the dehiscence zone in soybean pods and isolation of a dehiscence-related endopolygalacturonase gene.Plant Cell Environ,2002,25(4):479–490.
[10]Summers JE,Bruce DM,Vancanneyt G,Redig P,Werner CP,Morgan C,Child RD.Pod shatter resistance in the resynthesized Brassica napus line DK142.J Agr Sci,2003, 140(1):43–52.
[11]Dong Y,Yang X,Liu J,Wang BH,Liu BL,Wang YZ.Pod shattering resistance associated with domestication is mediated by a NAC gene in soybean.Nat Commun,2014,5: 3352.
[12]Funatsuki H,Suzuki M,Hirose A,Inaba H,Yamada T, Hajika M,Komatsu K,Katayama T,Sayamaa T,Ishimoto M, Fujino K. Molecular basis of a shattering resistance boosting global dissemination of soybean.Proc Natl Acad of Sci USA,2014,111(50):17797–17802.
[13]李启干,苏东,张顺,张凤云,张庆深,徐世库.黄淮流域主栽大豆品种炸荚性研究初报.安徽农学通报,2008, 14(2):14–19.
[14]彭玉华,袁建中,杨国保.黄淮流域大豆炸荚性初步分析.大豆科学,1991,10(4):285–230.
[15]马赛斐,南翠梅,张凤彩,魏艳平.黄淮流域主栽大豆品种炸荚性研究初报.大豆通报,2006,(2):21–23.
[16]Kang ST,Kwak M,Kim HK,Choung MG,Han WY,Baek IY,Kim MY,Van K,Lee SH.Population-specific QTLs and their different epistatic interactions for pod dehiscence in soybean[Glycine max(L.)Merr.].Euphytica,2009, 166(1):15–24.
[17]Nilmani B,Dhirendra K,Shrivastava AN.Studies on the factors affecting pod shattering in soybean.Indian J Genet Plant Breed,2013,73(3):270–277.
[18]Funatsuki H,Hajika M,Hagihara S,Yamada T,Tanaka Y, Tsuji H,Ishimoto M,Fujino K.Confirmation of the location and the effects of a major QTL controlling pod dehiscence,qPDH1,in soybean.Breed Sci,2008,58(1): 63–69.
[19]Caviness CE.Effects ofrelative humidity on pod dehiscence in soybeans.Crop Sci,1965,5:511–513.
[20]Ting CL.Genetic studies on the wild and cultivated soybeans.J Am Soc Agron,1946,38(5):381–393.
[21]Tukamuhabwa P, Rubaihayo P, Dashiell KE. Genetic components ofpod shattering in soybean. Euphytica,2002,125(1):29–34.
[22]Gao MQ,Zhu HY.Fine mapping of a major quantitative trait locus that regulates pod shattering in soybean.Mol Breed,2013,32(2):485–491.
[23]Suzuki M,Fujino K,Funatsuki H.A major soybean QTL, qPDH1, controls pod dehiscence without marked morphologicalchange.PlantProd Sci,2009,12(2): 217–223.
[24]胡立成.日本北海道大豆抗裂荚性育种.世界农业, 1991,(1):21–22.
[25]Metcalfe DS,Johnson IJ,Shaw RH.The relation between pod dehiscence, relative humidity and moisture equilibrium in BirdsfootTrefoil,Lotus corniculatus. Agron J,1957,49(3):130–134.
[26]Caviness CE.Heritability of pod dehiscence and its association with some agronomic characters in soybeans. Crop Sci,1969,9(2):207–209.
[27]Tsuchiya T, Sunada K. Shattering of pods in soybean breeding. I. Relations between degree of shattering and moisture content in pods.Bull Hokkaido Pref Agr Exp,1977,37:17–24.
[28]Bailey MA,Mian MAR,Carter TE Jr,Ashley DA,Boerma HR.Pod dehiscence of soybean:identification of quantitative trait loci.J Hered,1997,88(2):152–154.
[29]Romkaew J,Umezaki T.Pod dehiscence in soybean: Assessing methods and varietal difference.Plant Prod Sci, 2006,9(4):373–382.
[30]杨德旭,刘德军,高连兴.完熟期大豆炸荚力学特性试验.沈阳农业大学学报,2012,43(5):576–580.
[31]Tukamuhabwa P,Rubaihayo PR,Dashiell K,Adipala E. Inheritance of resistance to pod shattering in soybean.Afr Crop Sci J,2000,8(3):203–211.
[32]Zhang LX,Bellaloui N.Effects of planting and maturity dates on shattering patterns under early soybean production system.Am J Plant Sci,2012,3(1):119–124.
[33]Davies GC,Bruce DM.Fracture mechanics of oilseed rape pods.J Mat Sci,1997,32(22):5895–5899.
[34]Suzuki M,Fujino K,Nakamoto Y,Ishimoto M,Funatsuki H.Fine mapping and development of DNA markers for the qPDH1 locus associated with pod dehiscence in soybean. Mol Breed,2010,25(3):407–418.
[35]Helms TC.Greenhouse and field evaluation of pod dehiscence in soybean.Can J Plant Sci,1994,74(4): 699–701.
[36]Funatsuki H,Ishimoto M,Tsuji H,Kawaguchi K,Hajika M,Fujino K.Simple sequence repeat markers linked to a major QTL controlling pod shattering in soybean.Plant Breed,2006,125(2):195–197.
[37]罗汝叶,巩鹏涛,赵德刚,刘学义.大豆豆荚开裂性状的相关分析及 QTL定位.分子植物育种,2012,10: 1401–1407.
[38]Yamada T,Funatsuki H,Hagihara S,Fujita S,Tanaka Y, Tsuji H,Ishimoto M,Fujino K,Hajika M.A major QTL, qPDH1,is commonly involved in shattering resistance of soybean cultivars.Breed Sci,2009,59(4):435–440.
[39]Agrawal AP,Salimath PM,Patil SA.Inheritance of pod shattering in soybean.Indian J Genet Plant Breed,2003, 63(3):265–266.
[40]贾鸿昌,闫洪睿,张雷,鹿文成,梁吉利,刘英华,朱海芳.早熟高产优质大豆新品种黑河43.黑龙江省农业科学,2007,(5):124.
[41]王志新,郭泰,吴秀红,郑伟,刘忠堂,刘国民,韩士丰.高产优质耐密植栽培特用小粒大豆品种合农58号的选育.中国种业,2010,(6):55–56.
[42]林红,来永才,齐宁,杨雪峰,姚振纯.大豆种间杂交新品种龙小粒豆一号的选育.中国油料作物学报,2003, 25(4):44–46.
[43]闫任沛,张万海,乔雪静,孙东显,李殿军.早熟大粒高抗炸荚大豆新品种——蒙豆7号.农业科技通讯, 2003,(5):40.
[44]董全中.丰收27号的特点及栽培技术.安徽农学通报, 2009,15(6):146–147,150.
[45]孙东凤,康玉凡.大豆炸荚性研究进展.大豆科学,2011, 30(6):1030–1034.
(责任编委:刘宝)
Occurrence characteristics and molecular genetic basis of pod shattering in soybean
Dezhi Han1,2,Yulong Ren2,Yong Guo2,Hongrui Yan1,Lei Zhang1,Wencheng Lu1, Lijuan Qiu2
1.Heihe Branch,Heilongjiang Academy of Agricultural Sciences,Heihe 164300,China;
2.The National Key Facility for Crop Gene Resources and Genetic Improment(NFCRI)/MOA Key Lab of Soybean Biology(Beijing), Institute of Crop Science,Chinese Academy of Agricultural Sciences,Beijing 100081,China
Pod shattering is a natural property of wild soybean(Glycine soja)for propagation and also a major cause of yield loss in cultivated soybean(Glycine max L.Merr).Thus,studies on occurrence characteristics and molecular genetic basis of pod shattering in soybean can provide insights into both molecular mechanisms and potential application in legume crop improvement.In this review,we summarize the occurrence features and phenotypicidentification methodsofpod shattering based on analysisofthecellularmicrostructureof shattering-resistant soybean pod.We also introduced the identification and breeding of shattering-resistant germplasms,the progress of molecular genetic studies on shattering-resistant phenotype in soybean as well as perspectives on future studies of pod-shattering trait and application in crop improvement.
pod-shattering trait;cellular microstructure;pod-shattering identification;genetic basis;breeding for pod-shattering resistance
URL:http://www.cnki.net/kcms/detail/11.1913.R.20150421.1135.002.html
2014-09-03;
2015-01-28
国家自然科学基金项目(编号:31271753)和中国农业科学院科技创新工程项目和黑龙江省农业科技创新工程项目资助
韩德志,硕士研究生,专业方向:大豆基因资源发掘与利用。E-mail:handezhi2008@163.com
邱丽娟,博士,研究员,研究方向:大豆基因资源挖掘与利用。E-mail:qiulijuan@caas.cn
10.16288/j.yczz.14-456
时间:2015-4-21 11:35:55
