皮肤毛囊发育的转录组研究进展
2015-10-13江玮范一星乔贤张燕军刘志红赵艳红王瑞军王志新张文广苏蕊李金泉
江玮,范一星,乔贤,张燕军,刘志红,赵艳红,王瑞军,王志新,张文广,苏蕊,李金泉
内蒙古农业大学动物科学学院,动物遗传育种与繁殖内蒙古自治区实验室,呼和浩特 010018
皮肤毛囊发育的转录组研究进展
江玮,范一星,乔贤,张燕军,刘志红,赵艳红,王瑞军,王志新,张文广,苏蕊,李金泉
内蒙古农业大学动物科学学院,动物遗传育种与繁殖内蒙古自治区实验室,呼和浩特 010018
近年来,转录组测序技术在动物重要经济性状受复杂基因网络的调控研究领域取得了显著的成果。作为哺乳动物皮肤的衍生物,毛囊是唯一具有高度自我更新能力、独特的可再生器官,毛囊细胞经增殖分化最终形成毛发。已有的研究表明,诸多生长因子及其受体作为体内分泌协调基因的重要因素,对毛发的生长发育起着重要的调控作用。文章综述了近年来转录组测序技术在人、小鼠及羊等生物的皮肤毛囊发育和再生过程中基因调控方式的研究进展,旨在为今后人工干扰绒毛周期生长发育和分子育种提供理论依据,同时也为皮肤毛囊相关疾病的临床治疗提供新思路。
毛囊;转录组;人;小鼠;羊
哺乳动物毛发是由毛囊细胞增殖分化产生的,表皮和间叶细胞相互作用形成毛囊[1,2]。毛囊是哺乳动物特有的、具有高度自我更新能力、唯一终生呈周期性生长的器官。不同动物、不同部位的毛囊周期性生长也不相同。鼠的毛囊呈现波浪式再生,而人和羊的毛囊以个体为单位,生长周期是独立的。同种动物不同品种的毛囊周期也不完全相同,美利奴细毛羊的毛囊生长期在两年以上[3];绒山羊毛囊生长期仅为6个月或更短[3];威尔特郡羊随季节的变化有明显的毛发周期[4]。多年来关于皮肤毛囊转录组研究对象主要集中在人和小鼠上,随着分子生物学技术的发展,特别是大规模测序技术的成熟,关于绵羊、山羊、细毛羊等毛用动物皮肤毛囊生长发育的基因表达及调控也取得了一定的研究进展[5]。
转录组是生物体细胞或组织在特定状态下转录出来的所有RNA(包括编码和非编码蛋白质的RNA)的总和。目前,转录组研究技术主要包括两种:基于杂交技术的DNA微阵列技术(DNA microarray)和基于测序技术的转录组测序技术(RNA-seq)。该技术不仅能专注于基因中的功能位点,而且能够代表基因组中大多数适应性位点,可以将特定组织或细胞在某一发育阶段或功能状态下转录出来的所有RNA的集合全部测出,从整体水平研究基因功能以及基因结构,揭示特定生物学过程以及疾病发生过程中的分子机理。
近年来,在转录组水平上对毛囊相关发生机理的研究表明,诸多生长因子及其受体作为体内分泌协调基因和环境的重要环节,对绒毛的生长调控起着极其重要的作用。这些分子穿梭于真皮细胞和上皮细胞之间,介导这两个细胞群体间的相互作用,使得两个细胞群体有序增殖和分化,并最终形成完整的毛囊。此外,还发现部分毛囊的毛乳头细胞来自于神经嵴[6],鼠的毛囊在毛发周期中有多达6000个基因的表达发生改变[5]。由此可见,毛囊的发育过程非常复杂。
1 毛囊形态发生和周期性调控的转录组研究
毛囊具有自我更新的能力,在周期性生长发育过程中需要生长信号的精细调控,目前皮肤毛囊发育的转录组研究主要集中在SHH(Sonic hedgehog)、Wnt以及骨形成蛋白(Bone morphogenetic protein, BMP)信号通路及相关基因,且在毛囊生长和形态发生、肿瘤的发生、皮脂腺的发生方面研究广泛。某些miRNA也参与了毛囊形态发生和周期性调控。
1.1 多种信号通路调控毛囊生长
毛囊发育和周期性生长过程中受多种信号通路调控。这些信号分子73.2%属于Wnt、转化生长因子(Transforming growth factor,TGF)家族、丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)家 族 、 NOTCH、 JAK-STAT(Janus kinase-signal transducers and activators of transcription)和SHH 6个传导通路。还有一部分属于肿瘤坏死因子(Tumor necrosis factor,TNF)家族、成纤维细胞生长因子(Fibroblast growth factor,FGF)家族、BMP家族等。在毛囊发育过程中,虽然有一些其他分子的参与,但是这些分子大部分是通过上述的6个信号通路参与毛囊的发育过程(图1)。这些信号通路的配体、受体、中间的信号分子、下游的转录因子及其靶基因等的遗传突变、表观遗传修饰以及蛋白翻译后修饰的改变等都影响动物毛囊发育,导致毛发的生长和毛发品质的改变[5]。
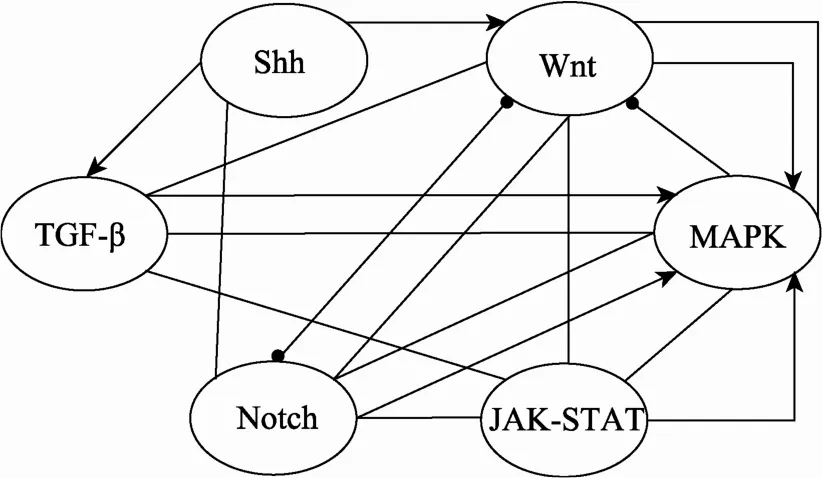
图1 参与毛囊发育过程的信号通路间的关系网络图代表信号通路,代表信号的传递方向,代表抑制作用,表示通路之间的无向链接,TGF-β、Notch、Wnt、MAPK、Shh、JAK-STAT为信号通路。Notch和Wnt信号通路间有相互抑制作用,MAPK信号通路在毛囊发育过程中具有重要作用,多数信号通路之间存在无向链接。
在毛干形成过程中,FGF、Wnt和BMP信号通路起着重要的调控作用。FGF和Wnt通路刺激毛囊干细胞分化,促进毛囊从休止期进入到生长期。Wnt信号通路在调节体内毛囊干细胞转录上起着重要作用。在毛囊干细胞静息期,TCF3、TCF4和TLE基因同时抑制Wnt靶基因的表达,使毛囊干细胞在Wnt信号通路上产生应答而分化再生[7]。BMP信号通路则是一个生长期抑制通路,在休止期时抑制FGF和Wnt通路的活性[8]。对人类真皮毛乳头细胞(Dermal papilla cells,DPSc)中的Sox2基因进行转录分析发现,Sox2基因作为毛发生长的关键调控因子,在DPSc中,通过微调分化毛囊干细胞中BMP信号通路调节间叶上皮细胞的发生,从而控制毛发的生长。切除Sox2转录因子会导致毛干产物的减少[9]。同时,在人类上皮细胞中Dlx3基因同样在毛囊分化和再生中具有重要的调控作用,通过调节Wnt、BMP信号通路,调节毛囊的分化和再生。选择性地切除Dlx3基因会导致毛干和内根鞘形成受阻,形成异常分化的皮层[10]。而在小鼠上,Gata3基因与Dlx3基因在维持小鼠毛发生长发育上都起着重要作用。敲除Gata3基因的小鼠在出生后毛发生长延迟且不易维持,毛囊组织异常且有不规则的色素沉积,在第一个毛囊生长周期后,真皮乳头周围的生发层并没有恢复,相反,基底上皮细胞显著增殖。转录组分析发现,缺失K14-Gata3的小鼠毛囊转录组在Notch、Wnt、BMP信号通路上显著富集,说明Gata3基因集成了不同的信号网络来调控毛囊和上皮细胞凋亡的平衡[11]。随着小鼠的长大,其毛囊干细胞将长期处于休眠期,而在生长期的时间明显缩短,年长的小鼠毛囊干细胞扩散减慢且自我更新能力下降。研究发现,毛囊干细胞中NFATC1基因的协调老化功能是毛发随年龄的增长而生长减慢的主要原因[12]。转录性能分析显示,毛囊干细胞中的NFATC1靶基因在与年龄相关的信号通路上显著富集,当BMP和(或)NFATC1被抑制时,处于衰退期的毛囊干细胞在毛囊发生上表现活跃,从而表现出毛发随年龄增长而生长减慢[12]的现象。
Notch信号和毛囊的形态发生有具直接的关系。Notch信号通路可能参与了毛囊发育的早期环节,并在毛干分化过程中起重要作用。吴萍等[13]筛选了与绒山羊绒毛生长相关的功能基因,设计控制毛囊发育和生长的分子信号途径来改良毛用动物的生产性能,从Notch信号通路组成基因Notch1、DLL1、Hairless结构特点进行分析,推断出这3个基因在绒山羊皮肤及毛囊的组织学周期性变化中的表达趋势,为进一步了解绒毛生长的分子调控机理提供了理论依据。
此外,在毛囊生长发育过程中,皮肤细胞Shh信号通路应答系统在空间上会有短暂的调控,诱导Shh靶基因在生长期的毛囊中表达。Edar和Troy信号通路则在外胚层的器官发育上对调节毛囊发生起着重要的作用[14]。而Notch和MAPK信号通路可能影响毛色形成的过程[15]。这些信号通路有的是单独作用,有的是多条通路联合作用来调控毛囊的生长发育的。目前,Shh信号通路是如何调控毛囊生长发育的还尚未知晓,但发现其在毛囊肿瘤发生上有一定的调控作用。本文参考人和小鼠在毛囊上的研究,将调控毛囊发育过程的主要信号分子进行了归纳总结,具体见表1。
1.2 miRNA调控毛囊的生长发育
miRNA是近年来发现的一类由19~25个核苷酸组成的非编码单链小RNA分子,它们通过与靶基因3′UTR结合负调控靶基因的表达。近年来研究表明,miRNA的表达谱在毛囊组织和周期性发育中存在特异性,通过与信号通路和调控因子相互作用在转录后水平上调控毛囊的生长发育。
毛囊周期性发育是多基因参与、紧密联系且相互制约的复杂生理生化过程,miRNA可以通过靶向作用于不同的信号通路和转录因子,从而对毛囊周期中不同发育阶段的调控和转化发挥作用[16]。在毛干的形成过程中,FGF、Wnt和BMP信号通路起着重要的调控作用,而miR-31能够通过调控角蛋白14、16和17(角化细胞骨架的必需成分)的表达干扰这些信号通路的活性[8,17]。miR-31对细胞周期性发育具有调控作用,高表达的miR-31可能通过下调CEBPA基因表达来促进细胞的增殖从而促进细胞从G2期向M期转变[18]。研究表明,miRNA还可能通过间接调控毛囊相关组织的发育来调控毛囊周期性生长。在毛囊周期发育中提高毛囊的血管化水平可以增加毛囊大小,促进绒毛的生长[19]。而miR-31被认为是血管特异的miRNA,其作为一种负调控因子调控淋巴和血管的生长和成熟[20]。在培养的绒山羊毛囊兴盛期初级毛囊和次级毛囊毛乳头细胞中,同样显示出许多差异表达基因参与血管化、信号通路,与毛囊形态发生密切相关[21]。由此可见,miRNA在调控毛囊生长发育和周期性调控上的重要作用。
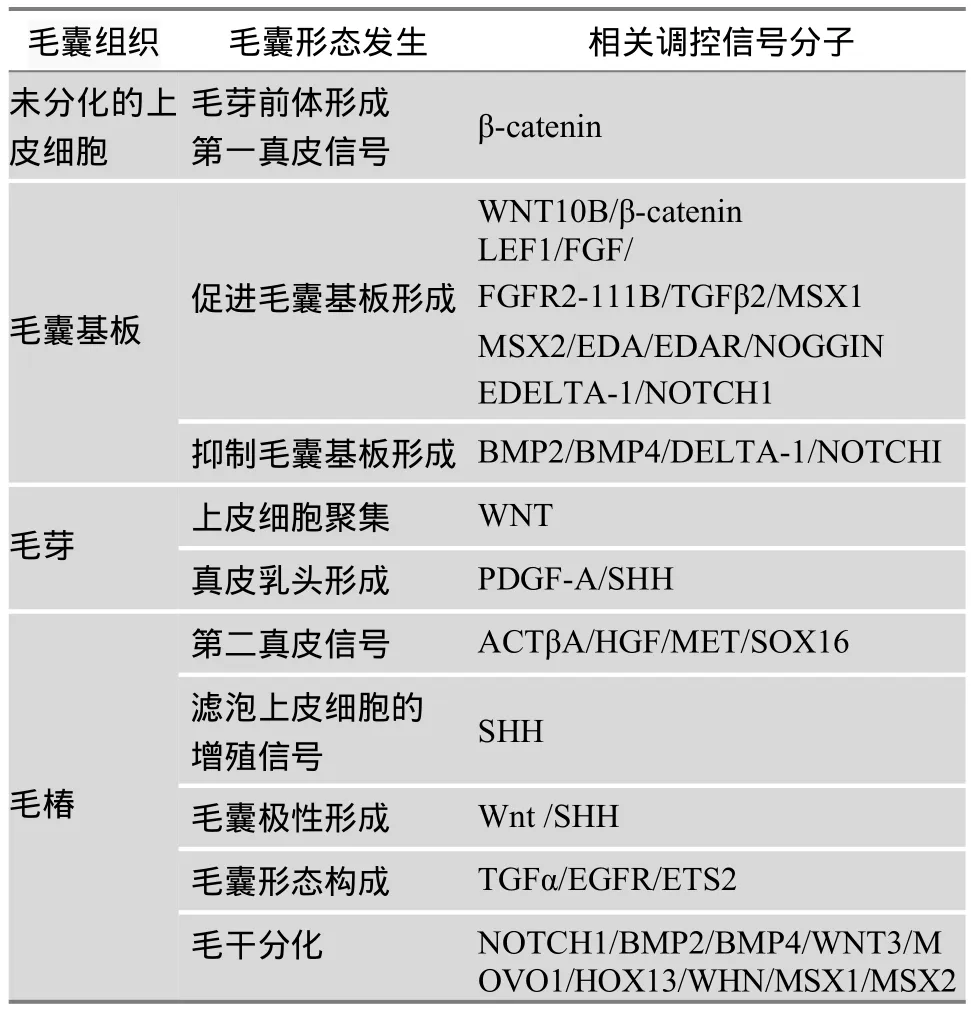
表1 调控毛囊发育过程的主要信号分子
近年来,miRNA在山羊、绵羊等毛用动物上的研究迅速开展,miRNA在哺乳动物毛囊生长和发育过程中可能发挥了重要作用。Wenguang等[22]研究miRNA在成年山羊和绵羊皮肤中的表达谱,发现成年山羊和绵羊皮肤中159个miRNA存在差异表达,其中差异最明显的是mmu-miR-720和mmu-miR-199b,说明这两个miRNA在控制山羊和绵羊的皮肤毛囊发育中的重要性。Yuan等[23]采用山羊兴盛期、退行期、休止期的皮肤组织,测序分析后共获得63、109、1004个raw reads和61、125、753个clean reads用于miRNA分析,发现有399个保守miRNA。其中,326个miRNA在3个时期都表达,然而3、12、11个miRNA在生长期、退行期、休止期显著表达。二代测序发现,172个新的miRNA和36个miRNA在3个时期表达,然而23、29、44个miRNA在生长期、退行期、休止期显著表达。KEGG分析表明,这些miRNA在代谢途径、癌症途径、MAPK信号通路、内吞作用以及黏着斑等通路上显著富集,在毛囊发生时均起着重要作用。
1.3 毛囊相关基因转录组研究
运用转录组测序技术,研究人员在毛囊的相关基因上也进行了大量研究。目前已知与毛囊发育相关的分子共有161个。运用差异微阵列分析,Schellenberger等[15]发现软骨寡聚基质蛋白(Comp)基因在细胞外基质及正常人的毛囊生物学特性上具有重要作用。Comp基因在毛囊发育的休止期和生长期表达,在退行期退化。正常人的结缔组织鞘成纤维细胞通过Comp基因选择性的自转录,与TGFb2基因在结缔组织鞘成纤维细胞表达直接相关,受转化生长因子TGFb信号的调节。Ahn等[25]发现IGF-I基因在生长的初级阶段在维持头发线性生长上起着关键的作用。在毛囊生长中,IGF-I基因的表达与PDGF-A和PDGF-B基因上调有关,且存在反调亡调节。进一步验证发现,IGF-I基因可增加血小板源生长因子PDGF-A和PDGF-B的表达,从而证实了IGF-I基因在控制毛发生长方面与 PDGF-A和PDGF-B基因上调有关。Leishman等[26]发现Foxp1转录因子控制着毛囊干细胞的启动,皮肤上皮细胞中缺少Foxp1基因将导致毛囊干细胞过早的活跃,从而导致毛囊静息期周期缩短;相反,Foxp1在角化细胞中过表达将促进细胞周期停滞,阻止细胞增殖。研究表明,在毛囊干细胞中Foxp1转录因子通过调控Fgf18基因的表达调节静息期毛囊干细胞的状态(静息或增殖)。Br mRNA在皮肤上通过编码一个公认的转录因子来抑制毛发的表达。转录组测序发现,在正常小鼠的毛囊生长期,Br基因表达呈降低趋势,而在毛发发生期显著增加,在连接毛乳头的上皮细胞中表现为上调。研究发现,在毛囊生长期,Br基因作为一个关键因子调节基本的细胞过程(包括毛发的形成,维持真皮毛乳头细胞的完整性及角化细胞凋亡)[27]。在毛囊退化的调控作用研究中,研究人员发现p53基因在小鼠毛囊退行期控制着细胞凋亡,在毛发生长过程中,p53可能是一个拮抗剂,促使毛囊提早进入退行期[28]。目前,虽然已经发现了不少控制毛囊生长发育的基因,但其调控机理还尚不清楚,有待进一步研究。
褪黑激素能促进绒山羊绒毛生长,改变绒毛细度,被广泛应用于绒毛生产中。王琳等[29]以褪黑激素处理后的毛囊为样本进行转录组测序,检测培养后毛囊中基因的变化,挖掘毛囊生长发育中的基因。在初级和次级毛囊中的差异基因富集的通路中找到了Wnt、Shh、MAPK、NF-KB、TGF-β、JAK-STAT和Notch毛囊生长发育相关信号通路,通路中大多数基因在毛囊生长发育中的作用未被报道,它们作为褪黑激素促毛囊生长的候选基因有待进一步研究。而刘斌等[30]通过筛选绒山羊在非长绒期埋植褪黑激素促进羊绒生长的相关基因时也发现在以上7种信号通路富集;同时筛选出差异表达基因95个,分别参与组成细胞成分、分子功能以及生物学过程。其中CTNNB1基因参与Wnt信号通路,CYP2B基因参与维生素A代谢和外源药物代谢等信号通路,这一发现可能与埋植褪黑激素促进绒山羊非长绒期绒毛生长和毛囊发育有关,进一步验证了褪黑激素在绒毛生长上的重要性。Hoxc13基因在皮肤成纤维细胞中过表达,可促进TgfβrII、Rorα2、Nanog、Wnt106和PdgfrA的表达,抑制Bmp2、Msx2、Ntrk3和Delal基因的表达。Hox13基因在哺乳动物被毛的起源过程中发生了适应性变化,可直接调控组成初级和次级毛囊的角蛋白和角蛋白关联蛋白的表达[31]。
FGFs及其受体构成了一个复杂的信号传导系统,参与了几乎所有哺乳动物组织的发育和修复过程。筛选敖汉细毛羊毛囊发育的差异表达基因发现,FGFs在毛囊生长期和休止期质检的mRNA表达量存在3个差异基因——FGF10、FGF18和FGFR3,并在毛囊生长发育的不同部位和不同时期存在差异表达。FGF10在腹部的表达量高于颈部,可能与毛囊发育的负调节有关;FGF18在腹部表达量生长期高于休止期,可能维持了此处毛囊的不活跃状态;而FGFR3则在不同部位和不同时期维持统一状态,这提示它们可能与毛囊的生长发育具有一定的关系,并在不同水平发挥调控作用[32]。
目前,绵羊和山羊全基因组测定计划已完成,在有山羊基因组参考基因组序列的情况下,可以把转录本映射回基因组,确定转录本位置、剪切情况等较为全面的遗传信息,这就可能确定控制绒毛周期发育的关键基因组区域和关键基因。深入发掘控制绒毛周期生长发育调控的关键区域和关键基因,为绒山羊分子育种提供基础。
2 毛囊疾病发病机制上的转录组研究
近年来,转录组测序技术在人类皮肤毛囊肿瘤的发生、多毛症和脱毛现象机理的研究方面已得到广泛应用。
皮肤癌在白色人种中是常见的恶性肿瘤之一,在我国的发病率很低,在皮肤癌中以基底细胞癌最多见。Gli基因在引发肿瘤发生过程中起着重要作用,是Shh信号通路直接调控靶基因的转录因子,是该通路不同水平激活的最后共同通道。研究发现,Shh信号通路在一定程度上通过调节Gli转录因子调控毛囊的生长和形态发生,Shh信号通路异位诱导靶基因将导致毛囊肿瘤(如基底细胞癌)的发生[33]。此外,Ras基因家族中K-Ras基因也对人类癌症的形成影响较大,同样参与细胞内的Shh信号通路的传递。研究发现,Shh信号通路中K-Ras基因呈现显著的负调节作用,是公认的致癌因子,K-Ras基因的激活将严重影响人类毛囊的生长和形态发生。当K-Ras基因突变时,该基因将永久活化,不能产生正常的Ras蛋白,从而使细胞内信号传导紊乱,细胞增殖失控而癌变[34]。
脱发、头发稀少、卷曲是毛囊形态发育异常的具体表现。研究发现,毛囊中Foxe1功能的缺乏将导致毛囊形态突变的发生。它不同于系统性缺陷,而是发生于个体。在毛囊形态发生Shh/Gli信号通路中,Foxe1作为靶基因具有调节毛囊在真皮和皮下组织发生的功能。Foxel在低分化的毛囊间表达特异,具有激活Shh信号通路的作用。Foxel转录因子突变,毛囊形态也成突变状态,患者头发表现为形成异常、稀少、卷曲。由此说明,Shh信号通路的靶基因Foxe1转录因子在毛囊形态发生上发挥重要作用,不可缺失[35]。Oda等[36]发现,将正常小鼠角质细胞中的MED1基因切除后,小鼠毛发分化生长异常,有脱毛现象。在第一个毛囊发育周期中,MED1基因的切除将导致毛囊迅速退化,毛发分化减少,β-catenin/VD受体调节基因表达减少,Shh信号增强,MED1切除也可以使滤泡间的表皮角质细胞增殖,表皮标记表达增加,影响毛囊的正常发育。因此,MED1基因在调节毛囊/表皮增殖分化上起着关键的作用。
小鼠是研究毛囊生长发育机理首选的模式动物。目前在转录水平上研究小鼠皮肤毛囊基因,主要集中在无汗症和多毛症的研究上,并取得了一定进展。Cui等[37]对无汗症小鼠胚胎皮肤毛囊发育期进行比较转录分析,发现小鼠无汗症的形成原因中有3个涉及毛囊的形态构成,分别是Shh通路以及Wnt和BMP通路的拮抗作用。同时发现,EDA基因的突变也将导致无汗症的出现,在人和小鼠上表现为毛发稀疏、汗腺缺陷等,EDA基因是TNF配体家族的一个成员,通过激活NFB信号通路,编码外源蛋白,从而导致无汗症的出现。在小鼠毛囊生长初级阶段,肿瘤坏死转换酶因子factor-α(TACE,又称金属蛋白酶17或分离素)和毛囊干细胞转录因子Sox9在小鼠毛囊细胞中表达,又在细胞中凋亡。Tace/Sox9的小鼠在毛囊生长初级阶段表现为毛发生长稀少,在20周大小时出现全身脱毛现象。在Tace/Sox9角质细胞中,转录因子Sox9、Lhx2、以及Gata基因为上调,而Lef1基因下调。Tace/Sox9的异常表达,将影响毛发生长的质量[38]。通过研究毛囊干细胞中Lhx2基因对Sox9、Tcf4和Lgr5基因的差异调节作用,发现在小鼠皮肤形态发生时,Lhx2在未成熟的毛囊中表达,在休止期,毛囊Lhx2基因存在于干细胞(隆突部、次级毛囊)。这两部分均参与新一轮生长期毛囊生长,在退化末期,隆突部最底部崩裂并围绕毛发形成次级毛囊。实时定量PCR确定在角质细胞中,Sox9、Tcf4和Lgr5基因是Lhx2基因的直接靶基因,发现在毛囊形态发生过程中,Lhx2转录因子控制着干细胞的活动。在皮肤表皮受伤时,Lhx2基因通过调节靶基因Sox9和Tcf4促进伤口上皮的形成,同时在次级毛囊中,通过抑制Lgr5抑制毛囊的循环发生从而控制上皮干细胞的活动[39]。研究还发现,Trps1基因和其靶基因Sox9在毛囊生长期直接抑制毛囊干细胞的表达,控制毛囊上皮细胞的增殖也将导致多毛症的产生[40]。结果进一步验证了Sox9基因在多毛症产生上的重要作用。
3 结语与展望
随着大规模测序技术的发展,批量获得大量数据成为可能。转录组测序已经显示出其他分析技术无可比拟的优势,随着对毛囊转录组研究的逐步深入,将有助于进一步深入对高等真核生物基因组的复杂性和复杂的基因表达调控网络进行探索。目前,在人和鼠中毛囊分子机制研究取得了较大的进展,对于绒山羊而言,在未来的研究工作中,筛选毛囊周期性差异基因、探明与毛囊发育相关的调控因子和可能机理并进行验证将是研究的重中之重,应关注毛囊周期性发育相关基因的表达分析和功能验证。如果能够筛选出影响毛囊生长和周期的重量级因子并寻找到关键性的调控网络,将为阐明绒毛生长周期调控机制、开展分子育种提供新的研究思路和育种手段,也可为人工干扰绒毛周期生长发育和分子育种提供新的实验证据,同时也会为疾病的临床治疗提供理论依据和新思路。
[1]Oro AE,Scott MP.Splitting hairs:dissecting roles of signalling systems in epidermal development.Cell,1998,95(5):575–578.
[2]Hardy MH.The secret life of the hair follicle.Trends Genet,1992,8(2):55–61.
[3]Galbraith H.Fundamental hair follicle biology and fine fibre production in animals.Animal,2010,4(9):1490–1509.
[4]Rogers GE.Biology of the wool follicle:An excursion into a unique tissue interaction system waiting to be re-discovered.Exp Dermatol,2006,15(12):931–949.
[5]王宁,荣恩光,闫晓红.毛囊发育与毛发生产研究进展.东北农业大学学报,2012,43(9):6–11.
[6]Yang CC,Cotsarelis G.Review of hair follicle dermal cells. J Dermatol Sci,2010,57(1):2–11.
[7]Lien WH,Polak L,Lin MY,Lay K,Zheng DY,Fuchs E.In vivo transcriptional governance of hair follicle stem cells by canonical Wnt regulators.Nat Cell Biol,2014,16(2): 179–190.
[8]Mardaryev AN,Ahmed MI,Vlahov NV,Fessing MY,Gill JH,Sharov AA,Botchkareva NV.Micro-RNA-31 controls hair cycle-associated changes in gene expression programs of the skin and hair follicle.FASEB J,2010,24(10): 3869–3881.
[9]Clavel C,Grisanti L,Zemla R,Rezza A,Barros R,Sennett R,Mazloom A,Chung CY,Cai XQ,Cai CL,Pevny L, Nicolis S,Ma’ayan A,Rendl M.Sox2 in the dermal papilla niche controls hair growth by fine tuning BMP signalling in differentiating hair shaft progenitors.Dev Cell,2012,23(5):981–994.
[10]Hwang J,Mehrani T,Millar SE,Morasso MI.Dlx3 is a crucial regulator of hair follicle differentiation and regeneration.Development,2008,135(18):3149–3159.
[11]Kurek D,Garinis GA,van Doorninck JH,van der Wees J, Grosveld FG.Transcriptome and phenotypic analysis reveals Gata3-dependent signalling pathways in murine hair follicles.Development,2007,134(2):261–272.
[12]Keyes BE,Segal JP,Heller E,Lien WH,Chang CY,Guo XY,Oristian DS,Zheng DY,Fuchs E.Nfatc1 orchestrates aging in hair follicle stem cells.Proc Natl Acad Sci USA, 2013,110(51):E4950–E4959.
[13]吴萍.Notch信号通路与绒山羊绒毛生长的研究[学位论文].呼和浩特:内蒙古农业大学,2010.
[14]Pispa J,Pummila M,Barke PA,Thesleff I,Mikkola ML. Edar and Troy signalling pathways act redundantly to regulate initiation of hair follicle development.Hum Mol Genet,2008,17(21):3380–3391.
[15]de Schellenberger AA,Horland R,Rosowski M,Paus R, Lauster R,Lindner G.Cartilage oligomeric matrix protein (COMP)forms part of the connective tissue of normal human hair follicles.Exp Dermatol,2011,20(4):361–366.
[16]蔡婷,刘志红,王志新,赵濛,俎红丽,李金泉.miRNA在调控皮肤和毛囊发育中的作用.遗传,2013,35(9):1087–1094.
[17]Schmidt-Ullrich R,Paus R.Molecular principles of hair follicle induction and morphogenesis.Bioessays,2005, 27(3):247-261.
[18]Sun FY,Wang JY,Pan QH,Yu YC,Zhang Y,Wan Y, Wang J,Li XY,Hong A.Characterization of function and regulation of miR-24-1 and miR-31.Biochem Biophys Res Commun,2009,380(3):660–665.
[19]Mecklenburg L,Tobin DJ,Muller-Rover S,Handjiski B, Wendt G,Peters EMJ,Pohl S,Moll I,Paus R.Active hair growth(anagen)is associated with angiogenesis.J Invest Dermatol,2000,114(5):909–916.
[20]Pedrioli DML,Karpanen T,Dabouras V,Jurisic G,van de Hoek G,Shin JW,Marino D,Kälin RE,Leidel S,Cinelli P, Schulte-MerkerS,BrändliAW,DetmarM.miR-31 functions as a negative regulator of lymphatic vascular lineage-specific differentiation in vitro and vascular developmentin vivo.MolCellBiol,2010,30(14): 3620–3634.
[21]Zhu B,Xu T,Yuan JL,Guo XD,Liu DJ.Transcriptome sequencing reveals differences between primary and secondary hair follicle-derived dermal papilla cells of the Cashmere goat(Capra hircus).PLoS One,2013,8(9): e76282.
[22]Zhang WG,Wang JH,Li JQ,Yashizawa M.A subset of skin-expressed microRNAs with possible roles in goat and sheep hairgrowth based on expression profiling of mammalian microRNAs.Omics,2007,11(4):385–396.
[23]Yuan C,Wang XL,Geng RQ,He XL,Qu L,Chen YL. Discovery of cashmere goat(Capra hircus)microRNAs in skin and hairfolliclesby Solexasequencing.BMC Genomics,2013,14:511.
[24]常子丽.皮肤毛囊基因调控网络的初建及其在绒山羊上的功能预测[学位论文].呼和浩特:内蒙古农业大学,2007.
[25]Ahn SY,Pi LQ,Hwang ST,Lee WS.Effect of IGF-I on hair growth is related to the anti-apoptotic effect of IGF-I and up-regulation of PDGF-A and PDGF-B.Ann Dermatol, 2012,24(1):26–31.
[26]Leishman E,Howard JM,Garcia GE,Miao Q,Ku AT, Dekker JD,Tucker H,Nguyen H.Foxp1 maintains hair follicle stem cell quiescence through regulation of Fgf18. Development,2013,140(18):3809–3818.
[27]Panteleyev AA,Paus R,Christiano AM.Patterns of hairless (hr)gene expression in mouse hair follicle morphogenesis and cycling.Am J Pathol,2000,157(4):1071–1079.
[28]Botchkarev VA,Komarova EA,Siebenhaar F,Botchkareva NV,Sharov AA,Komarov PG,Maurer M,Gudkov AV, Gilchrest BA.p53 Involvement in the control of murine hair follicle regression.Am J Pathol,2001,158(6):1913–1919.
[29]王琳.褪黑激素对内蒙古绒山羊毛囊生长发育相关基因的影响[学位论文].呼和浩特:内蒙古农业大学,2014.
[30]刘斌.绒山羊绒毛生长相关基因的筛选、鉴定和多态性分析[学位论文].呼和浩特:内蒙古农业大学,2012.
[31]吴江鸿.Hoxc13基因在绒山羊皮肤中的表达规律及体外功能分析[学位论文].呼和浩特:内蒙古农业大学,2011.
[32]贺建宁,刘鲁梅,程明,刘开东,于维敏,刘积凤,赵金山,柳楠.敖汉细毛羊毛囊FGF10、FGF18和FGFR3基因差异表达的研究.第六届全国动植物数量遗传学学术研讨会,2014,55.
[33]Oro AE,Higgins K.Hair cycle regulation of Hedgehog signal reception.Develop Biol,2003,255(2):238–248.
[34]Grachtchouk M,Pero J,Yang SH,Ermilov AN,Michael LE,Wang AQ,Wilbert D,Patel RM,Ferris J,Diener J, Allen M,Lim S,Syu LJ,Verhaegen M,Dlugosz AA. Basal cell carcinomas in mice arise from hair follicle stem cells and multiple epithelial progenitor populations.J Clin Invest,2011,121(5):1768–1781.
[35]Brancaccio A,Minichiello A,Grachtchouk M,Antonini D, Sheng H,Parlato R,Dathan N,Dlugosz AA,Missero C. Requirement of the fork head gene Foxe1,a target of sonic hedgehog signaling,in hair follicle morphogenesis.Hum Mol Genet,2004,13(21):2595–2606.
[36]Oda Y,Hu LZ,Bul V,Elalieh H,Reddy JK,Bikle DD. Coactivator MED1 ablation in keratinocytes results in hair-cycling defects and epidermal alternations.J Invest Dermatol,2012,132(4):1075–1083.
[37]CuiCY,Hashimoto T,Grivennikov SI,Piao YL, Nedospasov SA,Schlessinger D.Ectodysplasin regulates the lymphotoxin-β pathway for hair differentiation.Proc Natl Acad Sci USA,2006,103(24):9142–9147.
[38]Nagao K,Kobayashy T,Ohyama M,Akiyama H,Horiuchi K, Amagai M.Brief report:requirement of TACE/ADAM17 for hair follicle bulge niche establishment.Stem Cells,2012, 30(8):1781–1785.
[39]Mardaryev AN,Meier N,Poterlowicz K,Sharov AA, Sharova TY,Ahmed MI,Rapisarda V,Lewis C,Fessing MY,RuengerTM,BhawanJ,WernerS,PausR, Botchkarev VA.Lhx2 differentially regulates Sox9,Tcf4 and Lgr5 in hair follicle stem cells to promote epidermal regeneration after injury.Development,2011,138(22): 4843–4852.
[40]Fantauzzo KA,Kurban M,Levy B,Christiano AM.Trps1 and its target gene Sox9 regulate epithelial proliferation in the developing hair follicle and are associated with hypertrichosis. PLoS Genet,2012,8(11):e1003002.
(责任编委:李明洲)
The transcriptome research progresses of skin hair follicle development
Wei Jiang,Yixing Fan,Xian Qiao,Yanjun Zhang,Zhihong Liu,Yanhong Zhao,Ruijun Wang,Zhixin Wang,Wenguang Zhang,Rui Su,Jinquan Li
Inner Mongolia Key Laboratory of Animal Genetics,Breeding and Reproduction,Inner Mongolia Agricultural University,Hohhot 010018,China
Recently,transcriptome sequencing technology has achieved significant progresses in gene network regulation of important economic traits in animals.As the derivative of mammalian skin,hair follicle is capable of self-renew.Its proliferation and differentiation result in hair formation.Researches have revealed that many growth factors and receptors coordinate genes and environment,as well as play an extremely important role during hair growth.In this review,we summarize the progresses that transcriptome sequencing technologies have achieved in researches of hair follicle development and renegeration in a variety of species,such as humans,mice,goats.We aim to provide theoretical mechanisms for the artificial interference of villus growth cycle,and new ideas for therapeutic treatment of skin hair follicle-related diseases.
hair follicle;transcriptome;human;mice;goat
URL:http://www.cnki.net/kcms/detail/11.1913.R.20150508.0914.001.html
2014-12-12;
2015-04-15
国家高技术研究发展计划项目(863计划)(编号:2013AA102506),国家自然科学基金项目(编号:31201773,31260539,31272421),国家农业部现代农业产业技术体系项目(编号:CARS-40-05)和高等学校博士学科点专项科研基金项目(编号:20091515120010)资助
江玮,硕士研究生,专业方向:动物遗传育种与繁殖。E-mail:jiangwei1022@163.com
李金泉,博士,教授,研究方向:绒山羊遗传育种。E-mail:lijinquan_nd@126.com
苏蕊,博士,讲师,研究方向:绒山羊遗传育种。E-mail:suruiyu@126.com
10.16288/j.yczz.14-440
时间:2015-5-8 9:14:27
