猕猴桃AcGLK2a基因过表达载体的构建及在番茄中的遗传转化
2015-09-28牛向丽刘永胜
周 昂, 牛向丽, 刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
叶绿体是植株进行光合作用的重要细胞器, 叶绿体中含有的叶绿素是植物进行光合作用的重要元素。番茄的未成熟时期绿色主要来源于叶绿素,叶绿素决定了产品的品质特征[1]。番茄进入成熟期后,叶绿体逐渐转变为有色体,叶绿素逐渐被降解,类胡萝卜素的质量比开始增加[2],果实的绿色逐渐转变为黄色,最后转变为番茄成熟时期的深红色。在人类所需的营养中,类胡萝卜素扮演重要角色[3]。成熟番茄果实是人类摄取天然类胡萝卜素和番茄红素的重要来源[4]。
陆生植物叶绿体正常发育过程中需要GLK转录因子[5]。在玉米中ZmGLK2和ZmGLK1分别在维管束鞘细胞和叶肉细胞中特异性调控质体和叶绿体的发育[6-8]。拟南芥的 AtGLK1 和AtGLK2已被证实与叶绿体的发育相关[9-10]。AtGLK以细胞自主性方式协调和维持光合系统[11]。番茄SlGLK的过表达增加了光合成基因的表达和叶绿体的发育,导致碳水化合物和类胡萝卜素在成熟果实中质量比升高[12]。
本文利用植物过表达载体pBI121,在番茄植株中过表达猕猴桃GLK2基因AcGLK2a。半定量逆转录 PCR(reverse transcription-PCR,RT-PCR)分析显示,转基因番茄植株内AcGLK2a的表达量显著升高,而在野生型植株中则没有表达。与野生型相比,转基因植株的未成熟果实和叶片中积累的叶绿素质量比明显提高。
1 材料与方法
番茄(Solanum lycopersicum)、大肠杆菌(Escherichia coli)DH5α菌株、农杆菌(Agrobacterium tumefaciens)菌株EHA105及植物表达载体pBI121均为本实验室保存。
反转录酶、高保真、Taq DNA 聚合酶、pEASY-Blunt载体、T4DNA连接酶、限制性内切酶购自TaKaRa公司,质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自TI天根生化科技(北京)有限公司。
1.1 猕猴桃AcGLK2目的基因的克隆
按照GenBank中猕猴桃AcGLK2a基因序列(登录号 Achn385381)设计引物AcGLK2a-F,AcGLK2a-R,见表1所列,利用上述引物构建pBI121-35S-AcGLK2a过表达载体。

表1 用于PCR扩增寡核苷酸引物
提取野生型猕猴桃幼苗总RNA,通过RTPCR扩增AcGLK2a基因。PCR条件为:94℃预变性5min;94℃30s;57℃30s;72℃60s,32个循环;72 ℃10min。将PCR产物与pEASY-Blunt载体连接后转化大肠杆菌,对重组子进行快提和PCR验证,阳性克隆送南京金斯瑞生物技术服务有限公司测序。
1.2 番茄的遗传转化及转基因植株的鉴定
将重组质粒pBI121-35S-AcGLK2a通过液氮法导入农杆菌EHA105,在含有利福平和卡那霉素(50mg/L)的培养基上28℃ 培养2d,阳性菌用以转化野生型番茄。番茄种子用蒸馏水浸泡12h后,15%次氯酸钠溶液浸泡消毒15min,再以无菌水漂洗5次后播种至1/2MS培养基。25℃生长4d,露白后转至光照下培养。待子叶完全舒展时,将子叶剪下置于预培养基(MS+1mg/L 6-BA+0.04mg/L IAA)上培养2d;将带有pBI121-35SAlGLK2a载体的农杆菌28℃过夜培养,室温下5000r/min离心5min收集菌。
用稀释后的农杆菌浸染预培养子叶10min;吸去子叶上多余菌液后,将子叶转至共培养基(MS+1mg/L KT+1mg/L 2,4-D+10mg/L ACE)上培养2d;然后转至再生培养基(MS+500mg/L SB+2mg/L 6-BA+50mg/L KANA+0.2mg/L IAA),26℃光照培养(16h 光照,8h黑暗),每21d更换1次培养基;待愈伤组织上长出的不定芽长至2cm左右时,将芽切下移至生根培养基(MS+500mg/L SB+2mg/L IAA+50mg/L KANA)上生根;最后将再生植株移入营养土,放于温室中栽培。
提取野生型、转基因番茄基因组DNA。以pBI121-35S质粒为阳性对照,野生型番茄DNA为阴性对照,利用pBI121载体筛选标记基因新霉素磷酶基因(NPTⅡ)(登录号AF485783)序列引物NPTⅡ-F和NPTⅡ-R,对转基因植株进行PCR鉴定。PCR反应条件为:95℃预变性5min;95℃变性30s,64℃退火30s,72℃延伸40s,30个循环;最后72℃延伸5min。
1.3 半定量 RT-PCR
分别提取野生型和转基因T0代叶片总RNA,反转录合cDNA,以此为模板进行半定量RT-PCR。AcGLKa 基因使用的引物为GLK2BDL-F、GLK2BDL-R。以番茄ACTIN 为内参基因(登录号BT013707),其PCR扩增引物为 ACTIN-F、ACTIN-R。95℃预变性5min;95℃变性30s,58℃退火30s,72℃延伸30s,27个循环;72℃延伸5min。
1.4 叶绿素质量比的测定
剪取番茄成熟叶片0.5~1.0g,液氮充分研磨后,以1mL 80%丙酮充分萃取[13]。萃取液离心后分光光度计检测,读取645nm和663nm下光吸收值A645和A663。按照MacKinney常数计算叶绿素a和叶绿素b的质量比,计算公式为:

2 结果与分析
2.1 AcGLK2a基因扩增与测序
以猕猴桃cDNA为模板,分别以AcGLK2a-F和AcGLK2a-R为引物进行PCR扩增,产物进行电泳检测显示,扩增产物为一条特异条带,如图1所示,与预期猕猴桃AcGLK2a基因片段大小(1146bp)一致。测序结果表明与猕猴桃AcGLK2a基因预测序列一致。
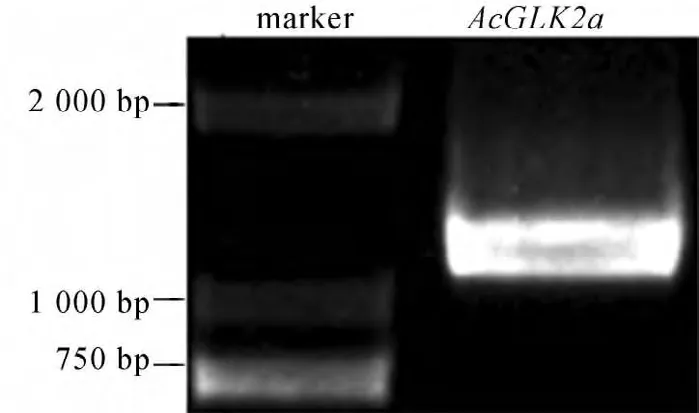
图1 AcGLK2a基因PCR扩增
2.2 pBI121-35S-AcGLK2a表达载体鉴定
利用SacⅠ和BamHⅠ双酶切pBI121-35S-AcGLK2a表达载体,得到预期大小AcGLK2a片段,如图2所示。
由图2可知,AcGLK2a已经连接到植物表达载体pBI121。
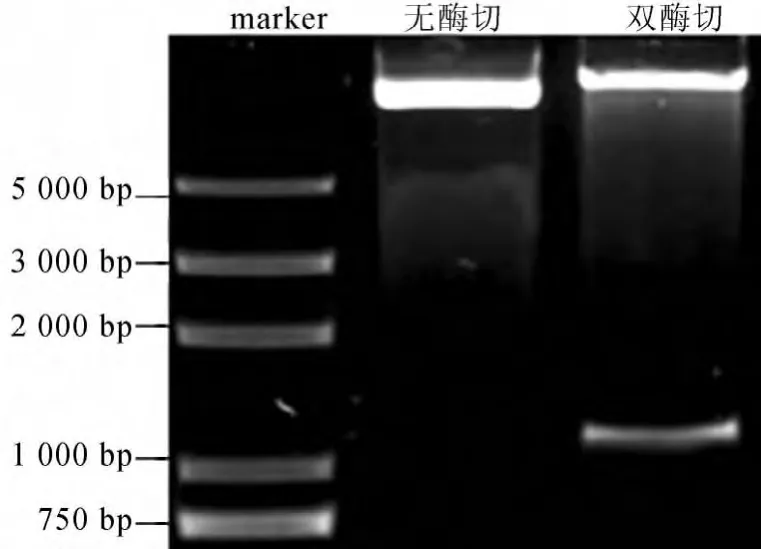
图2 pBI121-35S-AcGLK2a载体酶切鉴定
2.3 转基因阳性植株鉴定
通过植物组织培养获得转基因番茄植株后,提取转基因植株基因组DNA,利用植物表达载体pBI121携带的新霉素磷酸转移酶Ⅱ(NPTⅡ)筛选基因对植株进行阳性鉴定,预期扩增片段长度为857bp。所获得5株转基因植株检测结果如图3所示,其中4株经鉴定为转基因番茄苗。即对照野生型植株未能扩增出857bp条带,而转基因阳性株及阳性对照扩增出857bp条带,说明携带NPTⅡ基因的载体片段已整合于受体植株核染色体组中。
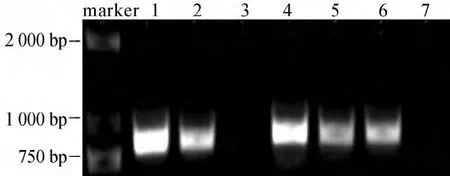
图3 转基因番茄植株的PCR鉴定
2.4 转基因植株中AcGLK2a表达情况
利用半定量RT-PCR方法,分析转基因植株果实中过表达AcGLK2a的表达水平。提取野生型和3株独立的转基因阳性番茄的绿色果实中的RNA,以RNA为模板进行逆转录成cDNA,半定量RT-PCR分析,结果如图4所示。由图4可以看出,转基因植株AcGLK2a基因的表达水平较高,说明转入pBI121-35S-AcGLK2a载体后,猕猴桃AcGLK2a基因得到了过量表达。
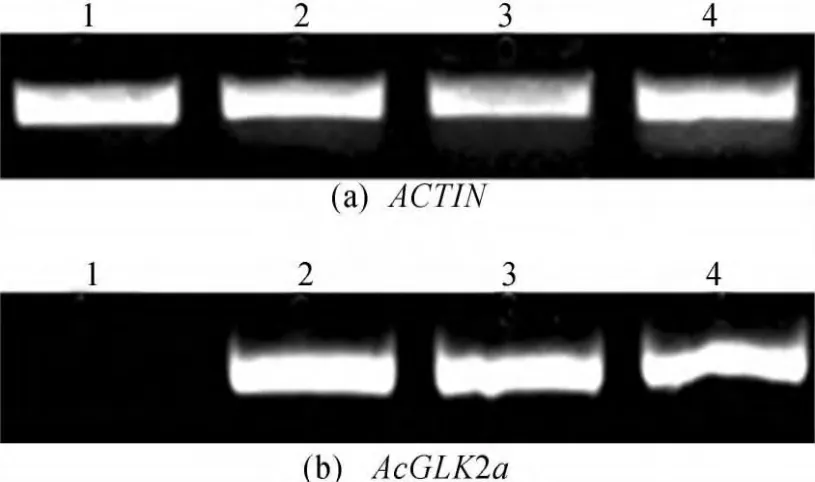
图4 转基因番茄AcGLK2a表达半定量分析
2.5 转基因植株表型分析
AcGLK2a转基因植株与野生型相比,具有明显差异。转基因植株的叶片和果实任一生长发育期颜色均比野生型植株的要深。每植株取绿熟期番茄果实各6个、相同位置叶片各6片,每组3次重复测定果实、叶片叶绿素质量比结果如图5所示,转基因植株果实的总叶绿素和叶绿素a质量比比野生型分别提高544.35% 和632.01%。转基因植株叶片的总叶绿素和叶绿素a质量比比野生型分别提高148.17% 和316.03%。
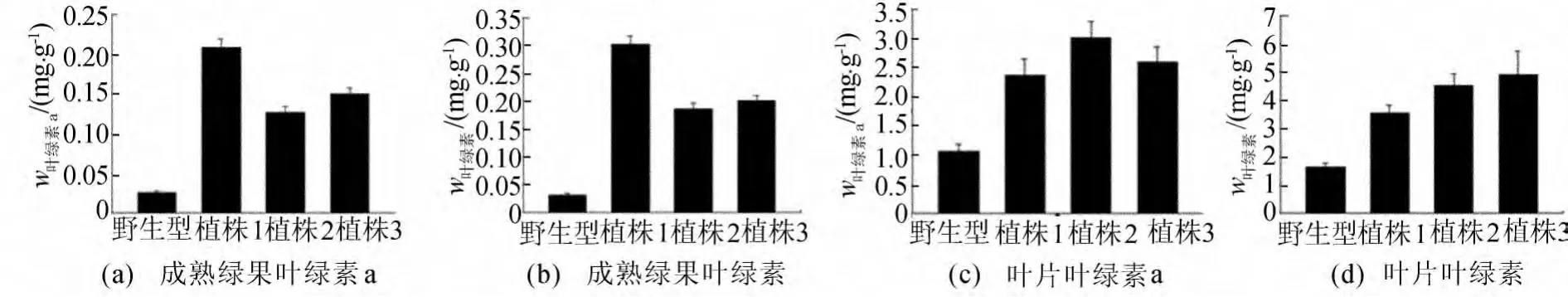
图5 野生型和转基因番茄成熟绿果、叶片的叶绿素a及叶绿素质量比测定
3 讨 论
在植物体内,SlGLK2基因与叶绿体的发育相关[12]。本文将猕猴桃中SlGLK2的同源基因AcGLK2a通过在番茄中过表达,半定量RT-PCR检测结果表明,转基因植株中AcGLK2a基因在番茄植株得到了表达,转基因植株表现出果实、叶片颜色变深,叶绿素质量比显著增加的表型。实验结果表明,过表达AcGLK2a的转基因植株果实叶绿素a质量比比同期野生型果实提高约632.01%。根据文献[14]可知,类胡萝卜素的质量比与叶绿素a呈显著正相关,可利用前期果实内叶绿素质量比估计果实成熟后期类胡萝卜素的质量比。由此可知过表达AcGLK2a的转基因植株成熟番茄红果的类胡萝卜素的质量比。
[1]黄持都,胡小松,廖小军,等.叶绿素研究进展[J].中国食品添加剂,2007(3):115-118.
[2]张要武.番茄果实耐贮性的遗传分析[J].华北农学报,2005,20(4):44-48.
[3]刘继恺,高永峰,牛向丽,等.番茄HP1和HP2基因RNA共干涉载体的构建及遗传转化[J].应用与环境生物学报,2009,15(5):591-595.
[4]冯媛媛.番茄ARF4基因果实特异RNAi载体的构建及遗传转化[J].应用与环境生物学报,2012,18(2):206-211.
[5]Wang P,Fouracre J,Kelly S,et al.Evolution of GOLDEN2-LIKEgene function in C3and C4plants[J].Planta,2013,237(2):481-495.
[6]Langdale J A,Kidner C A.Bundle sheath defective,a mutation that disrupts cellular differentiation in maize leaves[J].Development,1994,120:673-681.
[7]Hall L N,Rossini L,Cribb L,et al.GOLDEN2:a novel transcriptional regulator of cellular differentiation in the maize leaf[J].Plant Cell,1998,10:925-936.
[8]Rossini L,Cribb L,Martin D J,et al.The maize golden2gene defines a novel class of transcriptional regulators in plants[J].Plant Cell,2001,13:1231-1244.
[9]Fitter D W,Martin D J,Copley M J,et al.GLKgene pairs regulate chloroplast development in diverse plant species[J].Plant J,2002,31:713-727.
[10]Yasumura Y,Moylan E C,Langdale J A.A conserved transcription factor mediates nuclear control of organelle biogenesis in anciently diverged land plants[J].Plant Cell,2005,17:1894-1897.
[11]Waters M T,Moylan E C,Langdale J A.GLKtranscription factors regulate chloroplast development in a cell-autonomous manner[J].Plant J,2008,56:432-444.
[12]Powell A L T,Nguyen C V,Hill T,et al.Uniform ripening encodes a golden2-like transcription factor regulating tomato fruit chloroplast development[J].Science,2012,336:1711-1715.
[13]杨敏文.快速测定植物叶片叶绿素质量比方法的探讨[J].光谱实验室,2002,19(4):478-481.
[14]孟凡娟,许向阳,李景富.番茄果实色素含量和表面颜色相关性研究[J].东北农业大学学报,2006,37(4):459-462.
