蚕丝蛋白/PCL共混取向纤维的力学性质与细胞响应
2015-09-16邱旭升陈一心
袁 翰 郑 欣 邱旭升 陈一心*
1(南京中医药大学中西医结合鼓楼临床医学院,南京 210046)2(南京大学医学院附属鼓楼医院创伤骨科,南京 210008)
蚕丝蛋白/PCL共混取向纤维的力学性质与细胞响应
袁 翰1郑 欣2邱旭升2陈一心2*
1(南京中医药大学中西医结合鼓楼临床医学院,南京 210046)2(南京大学医学院附属鼓楼医院创伤骨科,南京 210008)
蚕丝蛋白因其良好的机械强度、生物相容性和耐灭菌性,是目前骨修复领域不可多得的天然蛋白支架材料。为提高蚕丝蛋白支架对细胞定向移动的引导能力和力学强度,采用静电纺丝方式制备较高取向度的PCL/蚕丝蛋白共混纤维支架,并与非取向型对比。通过扫描电镜图像分析技术表征静电纺丝纤维表面的取向度,并比较不同纤维排列结构下的力学性质。间充质干细胞在骨修复中应用广泛。人源骨髓间充质干细胞来自健康献髓者,在体外培养条件下,测试不同结构材料对间充质干细胞增殖的影响,并使用活细胞工作站实时追踪细胞在不同材料表面的运动功能。结果表明,在取向静电纺丝纤维支架中,91%的纤维分布于10°范围以内,且该支架具有力学的各向异性,具有较大的轴向拉伸模量。在间充质干细胞增殖96 min后,中取向静电纺丝纤维支架组的细胞数量产生显著差异。在取向纤维材料表面生长的间充质干细胞展现出最小的细胞分布夹角,仅为6.57°±4.45°,同时,取向纤维表面的细胞长度有显著提高(236.46±82.00) μm。在进一步的实时细胞追踪中,在细胞的主要移动方向上,取向纤维表面的细胞分解移动速度达6.66 μm/h,远远高于其他表面。因而,取向静电纺丝纤维支架可能在体内应用中支持成体干细胞增殖,并加快早期细胞定向迁移。
静电纺丝;蚕丝蛋白;间充质干细胞;取向纤维支架;细胞移动
引言
由于车祸等高能创伤的不断增多,创伤或继发感染导致的骨缺损成为了骨科医师面对的一大挑战。自体骨移植术是治疗骨缺损的有效手段,然而自身骨量有限,且增加了患者多处手术的风险和痛苦[1]。组织工程学材料结合多能干细胞制成的骨修复材料,可促进植入部位新骨形成,有望降低对自体骨的需要,部分甚至全部替代自体骨组织[2]。
以金属为基础的材料首先应用于骨组织修复中,然而金属的植入物需要二次手术取出,给患者带来较大痛苦。多种可吸收材料(如聚丙交酯(PLA)、聚已内酯(PCL)和聚乙交酯复合丙交酯(PLGA)等)在实验中成功被新生组织替代,得到了广泛的关注[3]。其中,聚己内酯材料(PCL)延展性良好,可体内降解,已制成了多种组织功能材料。以蚕丝蛋白为代表的天然可降解材料则具有较低的免疫原性,且蚕丝蛋白可以耐受高压高温灭菌,其力学强度较好,并且有良好的生物相容性。蚕丝蛋白在体内降解的过程以及对骨重建的支持作用已有一定的实验基础[6-9]。然而,单纯蚕丝蛋白在静电纺丝的应用中延展性较差,通过共混溶液纺丝技术则可以引入具有良好延展性的聚已内酯(PCL)材料。这种共混材料能否获得更佳的力学性能,乃是取向纳米纤维的制备以及骨科动力固定材料的基础。
在新近涌现的材料设计中,保持骨折断端的微动、形成动态的固定方式成为关注的焦点。Goodship等通过动力装置,在山羊骨折模型中首次观察到微动可以加速骨缺损愈合[10]。随后,大量临床观察[11]与实验研究[12-13]证实,骨折端微动不仅有益于骨痂形成,而且加快局部血管化与干细胞分化,最终缩短了骨折愈合时间。设计微动固定材料的关键在于提供骨折断端运动的弹性空间,并且防止骨折线的不稳定[11, 14]。本课题组通过静电纺丝方法,制备出取向纤维支架[16]。取向纤维结构使材料具有力学各向异性,可令骨折断端在轴向上拥有更大的弹性固定力,同时提供一定的微动空间。
调控材料的表面形貌,提高纤维材料的取向性,可以调控细胞运动功能[15]。间充质干细胞向骨折端加快集结后,可以进一步分化为成骨细胞,因而可以加快骨修复进程,缩短骨折愈合的时间。本研究的前期实验已成功制备了蚕丝蛋白纤维支架,证实其生物相容性,而本研究则进一步借助活细胞工作站,实时原位记录细胞的运动过程,以矢量方式进行验算,从而评价取向纤维材料在加快细胞定向移动方面的价值。
1 材料和方法
1.1材料制备与表征
蚕丝蛋白购自江苏省丝绸集团有限公司。蚕丝蛋白支架的静电纺丝制备采用旋转电极接收法[16],现简述如下:以热碱法脱去蚕丝丝胶,得到纯蚕丝蛋白。通过三元溶解溶液——CaCl2/乙醇/H2O混合溶液(摩尔比1∶2∶8)溶解蚕丝蛋白,并经纯水充分透析除去杂质。取向静电纺丝纤维支架是通过高速旋转的接收电极制备,在2 000 r/min转速下制得取向纤维支架,而非取向纤维支架在低转速(500 r/min)下取得(装置结构见图1)。纺丝液采用蚕丝蛋白1.5 g与PCL 0.5 g,共同溶解于20 g无水甲酸中。两组材料均在19 kV纺丝电压、180 min内取得。分子生物学实验采用24孔板,接种干细胞于对应材料包被的细胞爬片表面。
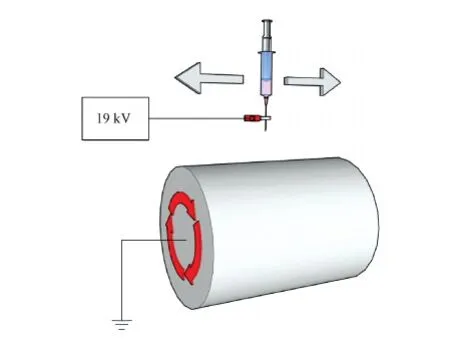
图1 静电纺丝机装置Fig.1 The schematic diagram of electrospinning device
在实验中活细胞工作站将静电纺丝原始纤维膜分割,覆盖于方形载玻片上,使用UV 光固化胶 (LOCTITE®3011)组装,方式见图2。扫描电镜材料采用不同纤维材料,试样剪切为4 mm×4 mm样方后,二氧化碳超临界干燥,真空喷金,并通过扫描电镜观察(场发射扫描电镜:Hitachi, SU-70, 日本)。

图2 原位观察间充质干细胞装置概览(A-普通细胞培养皿; B-冲压φ15mm 圆孔后的细胞培养皿;C和E-无涂层 18 mm 和 20 mm 盖玻片;D-静电纺丝原始纤维膜,分割为 25 mm×25 mm 方形试样以张力覆盖于方形载玻片上,使用UV 光固化胶封装;F-半透膜灭菌袋封装灭菌)Fig.2 An overview on petri dishes for in situ observation(A-Regular polystyrene petri dish; B-Punched petri dish with a φ15 mm round hole; C and E-Regular 18mm and 20mm cover slides; D-The electrospinning raw scaffolds which was split into around 25 mm×25 mm pieces fitting to cover on slides and fix with UV glue; F-Sterilized finished devices)
1.2方法
1.2.1不同取向度静电纺丝纤维支架力学测试
将两组材料切成30 mm×30 mm的多个试样,测量平均厚度,然后在材料拉伸试验机上测定载荷与伸长。其中,取向纤维材料沿两个方向测量,夹具分别固定在取向方向(Y轴)和垂直取向方向(Z轴)上;无序纤维材料以随机方向测量,且通过试样中心的轴线测量。这样,得到力-伸长曲线及有关力学指标,每种材料各测定5块试样,取其平均值。夹持部分的长度为每边5 mm,拉伸速度为5 mm/min,记录被测支架断裂前的受力动态变化,参数主要包括最大力(N)、最大力点的位移(mm)、拉伸强度(MPa)、最大力伸长率(%)、断裂伸长率(%)等,并通过软件计算拉伸强度和杨氏模量。
1.2.2取向静电纺丝纤维对BMSCs增殖力的影响
人骨髓来自健康献髓者,献髓者事先已签署知情同意书。将采集到的抗凝骨髓用密度梯度离心法,分离骨髓中的单个核细胞。运用差速贴壁法纯化细胞,4~5 d传代一次。收集4~6代BMSCs调整浓度2×105个/mL,分布接种于铺有实验组和对照组材料的24孔板中,每组复设4孔。分别于24、48、72、96、120 h弃培养液,每孔加入L-DMEM培养基200 μL、5 mg/mL MTT染液200 μL,孵育4 d后弃上清,加入DMSO 200 μL,振荡溶解15 min,于酶标仪上测定570 nm处的光密度(OD)值,并设参考波长650 nm。细胞数量以吸光度单位来表示。
1.2.3矢量化细胞迁移轨迹捕捉
静电纺丝纤维膜根据取向度分为两组,分别包裹于20 mm×20 mm 方形玻片上,随后镶嵌于打好孔的培养皿底部,以便于观察细胞在纤维界面的长期活动(器械组装方式见图1)。培养皿通过环氧乙烷消毒,并提前浸泡于培养液中脱毒24 h。间充质干细胞以中等密度接种于纤维表面上(2×105个/孔),经过 16~24 h 的预培养,将该培养装置转移到活细胞工作站条件中(37℃恒温、5% CO2饱和湿度)。通过DIC模式拍摄细胞动态照片,采取30 min的间隔观察24 h内的细胞形态变化。照片通过ImageJ软件分析,捕捉细胞运动轨迹。细胞的迁徙路径和参数通过软件自动计算,以得出细胞在不同材料和不同时间点的运动数据来做进一步的比较。
1.2.4细胞骨架标记
间充质干细胞通过前述方法接种于24孔板中。由于细胞间接触抑制可干扰细胞的形态,本实验中细胞以较低的密度植入(2×104/孔),以减少细胞接触所导致的细胞骨架异常。将细胞爬片在接种间充质干细胞前分别包被以各组材料(取向纤维/非取向纤维/蚕丝蛋白涂层),并设置4个重复孔。在共培养72 h后,细胞爬片经PBS冲洗和2.5%多聚甲醛固定10 min。 肌动蛋白通过488 nm荧光标记的鬼笔环肽(Cytoskeleton公司, 美国)进行特异性的标记,细胞核则通过DAPI染料予以复染 (Sigma, 英国)。所有荧光染色样品采用荧光显微镜(Zeiss Axio Imager, Zeiss, 英国)加以观察并拍照。
1.2.5数据分析与处理
细胞定量移动速度以均数和标准差进行表示,组间均数的显著性比较采用单向方差分析 (One-way ANOVA)计算。为了保证实验的可重复性,材料形貌分析采用全区域的自动分析取样,避免人工取样的偏差。4个随机区域被选择作为细胞迁移的观察区。当P<0.05时,认为t检验有显著性;而P<0.0005时,认为单向方差分析有显著性。不同材料的表面纤维分布情况通过 ImageJ作傅里叶分量分析,以量化为取向度指标。图表通过Excel 绘制。
2 结果
2.1取向静电纺丝纤维支架的制备与形态分布
通过调节接收电极的旋转速度,成功使用蚕丝蛋白制备了不同取向度的静电纺丝纤维膜。在较低转速条件下,可制得非取向纤维表面,反之则可得到取向纤维表面。
在电镜下可见两种材料表面纤维分布得较为均匀,相关形貌可见图3。通过较高的接收电极旋转速度可以获得理想的取向纤维,当转速为2 000 r/min时,约91%的纤维分布于主要纤维走向上;然而当转速较低(500 r/min)时,纤维分布于主导方向的仅有14%。进一步分析可知,取向纤维表面的所有纤维取向分布于一个较窄的区间中,提示该方法取得的蚕丝蛋白取向纤维均一度较高。
2.2静电纺丝蚕丝蛋白膜力学性能测定
通过材料拉伸试验机测定取向、非取向纳米蚕丝蛋白力学性能指标,应力应变曲线见图4。取向蚕丝纤维轴向方向的最大力大于径向方向,最大力伸长率小于径向方向及非取向材料;杨氏模量大于径向方向及非取向材料。
MTT法测量细胞的增殖速率的结果显示在1、2、3、4、5 d各检测时间点,在纳米纤维材料表面,BMSCs细胞均可快速增殖。从第4 d开始,取向纳米蚕丝蛋白组细胞增殖力明显高于乱序纳米蚕丝蛋白组(P<0.05,见图5)。
2.3取向纳米纤维结构促进BMSCs的增殖
2.4矢量化细胞迁移轨迹捕捉
在较低密度接种细胞后,细胞移动主要受材料表面结构的影响,减少了接触抑制对细胞迁移的影响。在贴壁过程的初期,不同形貌的纤维表面对初始贴壁过程无显著影响。
然而在12~24 h贴壁之后,细胞的黏附和活动功能趋于平稳,在此阶段,细胞的行为在不同材料表面呈现出一定的区别。通过把不同时间点细胞的活动距离作为二位矢量来分析,可以得出细胞的移动速度和移动方向数据。经测算,细胞在取向纤维表面、非取向纤维表面和涂层表面的移动速度分别为7.17、7.16、6.90 μm/h。结果提示,纤维构造的表面更好地促进了细胞的移动,但差异无显著性。
进一步分解细胞的位移后发现,在细胞的主要移动方向上,取向纳米纤维表面的细胞分解移动速度达6.66 μm/h,远远高于其他表面(分别为4.63和 4.34 μm/h,P<0.05)。此结果提示,细胞和其基质的互动可以引起细胞伸展方向改变,进而使细胞的移动方向和速度产生差异。

图3 取向静电纺丝纤维、非取向纤维的排列。(a) 取向纤维表面, 比例尺为 100 μm; (b) 非取向纤维表面, 比例尺为 50 μm; (c) 取向纤维表面的纤维排列角度集中于峰值附近; (d) 非取向纳米分布呈各向同性 Fig.3 Fiber alignments of aligned and non-oriented scaffolds. (a) Aligned scaffold, scale bar indicates 100 μm; (b) Non-oriented scaffold, scale bar indicates 50 μm; (c) Directionality histograms of aligned scaffold; (d) Directionality histograms of non-oriented scaffold

图4 两种蚕丝蛋白膜的应力曲线Fig.4 The typical tensile stress/strain curves of electrospinning SF/PCL aligned and non-oriented scaffolds

图5 BMSCs在不同材料表面的增殖曲线(图中星号表示差异具有统计学意义,P<0.05)。Fig.5 The proliferation rate of BMSCs on different scaffolds (The asterisk means the statistical significance P<0.05).

图6 各组细胞在正交坐标系x和y轴上的移动速度, 设纤维取向方向为x轴,则总速度为v,细胞沿x轴移动的速度向量为vx,而垂直于纤维方向的速度向量为vy(*表示P<0.05)Fig.6 Cell migration velocity in two directions under different topographical cues. Cell migration velocity on the aligned direction(vx), perpendicular direction (vy) and universal velocity (v) were shown (*P<0.05)
2.5细胞骨架的观察
染色后,通过软件得出了细胞的长度,以及各组视野中细胞的延伸方向与材料界面上纤维的平均分布方向,并计算出其夹角。通过计算,在取向纳米纤维材料表面生长的间充质干细胞展现出最小的细胞分布夹角,仅为 6.57° ± 4.45°,显著低于另外两组(分别与非取向纳米纤维表面为36.68° ± 26.42°,和在涂层表面的45.86° ± 25.61°)。同时,取向纳米纤维表面的细胞长度有显著提高((236.46±82.00)μm),说明取向蚕丝蛋白纳米纤维可以有效地刺激细胞在特定方向上延展和运动。在标记出细胞骨架后,可见取向纳米纤维表面的细胞骨架沿纤维分布方向重新排列,而其他两组材料的细胞骨架呈弥散性分布,不具有定向分布的特点(见图7)。
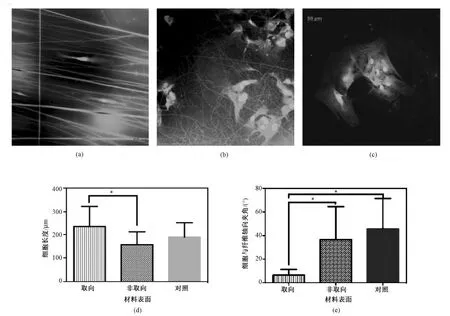
图7 细胞的骨架分布。(a) 取向纳米纤维组; (b) 非取向纳米纤维组; (c) 涂层表面组(图中可见肌动蛋白构成的细胞骨架(绿色),围绕细胞的SF/PCL 纳米纤维 (绿色),以及细胞核(蓝色); 较低的细胞定植密度使得细胞可以任意铺展,表现出分布的倾向性); (d)和(e)细胞长度 (μm) 与细胞分布方向与纤维走向的夹角比较(*P<0.05)Fig.7 Immunofluorescent assay of cytoskeletons. (a) Aligned scaffolds; (b) Non-oriented scaffolds; (c) Spin-coated surfaces (The actin of cytoskeleton (green), the SF/PCL fiber (green), cell nucleus (blue) were shown. The low implant density enabled free cell movement, which shows the distributional tendentiousness); (d) and (e) The cell length (μm) and cell distribution angle was compared (*P<0.05)
3 讨论
蚕丝蛋白作为一种天然的材料广泛应用于组织工程领域,如药物释放和植入物设计。其生物相容性好[19-20]、可生物降解[21],且具有较低的炎症反应[22]。然而,纯蚕丝蛋白的静电纺丝纤维力学性能差,制约了其应用。基于此,本研究通过蚕丝蛋白与PCL的共混纺丝,很好地提高了共混纳米纤维产物的延展性,从而进一步在纺丝过程的电极高速转动中形成连续取向的长纤维,因此制备了取向度更高的材料:91%的纤维分布于10°范围以内的静电纺丝纤维骨修复材料。
用于骨科的植入材料需要具有一定的刚性及韧性。蚕丝蛋白虽然具有生物相容性好、体内可降解、易塑形等优点,但是其刚性及韧性较差,不能满足骨科植入材料的需要。本研究通过共混PCL进行静电纺丝的方法,提高了静电纺丝产物纤维的延展性,进而通过旋转电极法提高了静电纺丝支架的取向性,因而在力学性质上也体现了各向异性。轴向上的高刚度,可增加骨折断端固定的稳定性;而径向上一定的弹性,也提供了骨折断端微动的可能。在拉伸实验中,取向静电纺丝纤维的取向方向载荷达到最大后逐渐下降,并非迅速断裂,反映了纤维间有一定的缠绕以及材料的厚度不均匀现象。力学实验结果也从另一个方面提示,在纤维支架材料取向度提高的同时,材料径向刚度降低,因此有必要进一步研究纤维的取向度实用范围乃至不同取向度材料的复合应用。
通过基质材料表面结构,引导细胞的定向移动,在组织工程学中有重大意义。其意义主要体现在组织修复的过程中,最先发生细胞的召集和向病灶中心的聚集,因此通过形态学的手段增加材料界面的生物活性,加速细胞向病灶转移,将有望加速愈合的整体过程,缩短缺损组织的重建时间[15]。通过材料表面的物质浓度变化[16],取向排列的沟槽结构[17]和平行排列的纤维结构均可以刺激间充质干细胞等定向移动。
多种可降解材料以及天然材料都成功通过静电纺丝的手段制备出来,而取向纤维材料尤其引人瞩目[18]。 Lee等采用PLLA的HFIF溶液,制备了约80%取向的静电纺丝纤维材料,用于体内和体外的骨缺损修复[23];Chang等通过PCL的四氢呋喃溶液,制备了具有平行方向和垂直方向两种构型的表面材料,并在体外研究了间充质干细胞的应答机理[24]。这些研究均认为,提高材料表面纤维的取向度,对加快细胞的迁移速度有利。
在刺激细胞移动的过程中,如何不影响细胞的活力、不抑制细胞的功能是一大挑战。通过单纯改变表面的形态,从光滑表面变为具有平行纤维结构的表面,可以提供刺激细胞定向移动的平台。多个研究采用不同材料,构建了取向纤维的结构,并观察到相似现象。其中,Lee等观察到BMSC细胞在纤维走向上的移动速度是垂直纤维方向的10.46倍之多[23],但由于该研究使用PLLA材料,且有98.0%的纤维处于10°的范围以内,故可以推测这种细胞运动的差异可能由材料的优异性能所致。而Chang等的研究中不仅观察到细胞的分布区别,而且首次指出了这种细胞的排布可能加速了细胞间交流(cell-cell communication),导致细胞可以沿纤维取向的方向更快地传递信号物质[24]。在本研究中发现,取向纤维材料表面生长的间充质干细胞展现出最小的细胞分布夹角,仅为 6.57° ± 4.45°,显著低于非取向表面,这与其他研究一致;本研究还发现,取向纤维表面的细胞长度有显著提高(236.46±82.00) μm,细胞沿纤维走向方向的移动速度约是垂直纤维方向的4倍。
人体骨骼组织中的胶原蛋白呈高度取向的束状分布,构成哈弗森系统,因此静电纺丝取向纤维系统需要从结构上最大程度地模拟体内间充质细胞的迁移环境[26]。早在2009年,就有研究着眼于此种取向纤维的结构对于细胞取向的影响,并认为是纤维走向上的张力大导致细胞在此方向上的细胞骨架重塑。本研究验证了这种平行排列的纤维表面确实能引起细胞内骨架的重塑,进而导致细胞的伸长和定向移动,这与同类研究的结果[23-24]相似,因而提示Actin信号通路可能对此过程有重要影响。同时,Chang等发现,取向纤维构成的表面上细胞表达的黏着斑蛋白较少,因此有助于细胞的快速移动,这和本研究发现的肌动蛋白的丰富表达属于协同过程。
4 结论
取向蚕丝蛋白静电纺丝支架可以支持MSC细胞增殖,在体外具有力学各向异性和引导细胞沿纤维排列方向运动的能力。该变化可能与Actin通路的调控有关,并能观察到细胞骨架的重排。然而在其体内应用后,能否加速骨创伤病灶处成骨细胞的运动,仍需进一步的实验研究。
[1] Dimitriou R, Mataliotakis GI, Angoules AG,etal. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review [J]. Injury, 2011,42:3-15.
[2] Calori G, Mazza E, Colombo M,etal. The use of bone-graft substitutes in large bone defects: any specific needs? [J]. Injury, 2011,42:56-63.
[3] Holzwarth JM, Ma PX. Biomimetic nanofibrous scaffolds for bone tissue engineering [J]. Biomaterials, 2011,32(36): 9622-9629.
[4] Lu Q, Zhang B, Li M,etal. Degradation mechanism and control of silk fibroin [J]. Biomacromolecules, 2011,12(4): 1080-1086.
[5] Anderson JM, Shive MS. Biodegradation and biocompatibility of PLA and PLGA microspheres [J]. Advanced drug delivery reviews, 2012,64:72-82.
[6] Karageorgiou V, Meinel L, Hofmann S,etal. Bone morphogenetic protein-2 decorated silk fibroin films induce osteogenic differentiation of human bone marrow stromal cells [J]. Journal of Biomedical Materials Research Part A, 2004,71(3): 528-537.
[7] Pritchard EM, Valentin T, Boison D,etal. Incorporation of proteinase inhibitors into silk-based delivery devices for enhanced control of degradation and drug release [J]. Biomaterials, 2011,32(3): 909-918.
[8] Li C, Vepari C, Jin HJ,etal. Electrospun silk-BMP-2 scaffolds for bone tissue engineering [J]. Biomaterials, 2006,27(16): 3115-3124.
[9] Wang X, Wenk E, Zhang X,etal. Growth factor gradients via microsphere delivery in biopolymer scaffolds for osteochondral tissue engineering [J]. Journal of Controlled Release, 2009,134(2): 81-90.
[10] Goodship A, Norrodin N, Francis M. The stimulation of prostaglandins synthesis by micromovement in fracture healing [J]. Micromovement in Orthopaedics, 1992,1:31-34.
[11] Kenwright J, Richardson JB, Cunningham JL,etal. Axial movement and tibial fractures. A controlled randomised trial of treatment [J]. J Bone Joint Surg-Br, 1991,73(4): 654-659.
[12] Yamaji T, Ando K, Wolf S,etal. The effect of micromovement on callus formation [J]. Journal of Orthopaedic Science, 2001,6(6): 571-575.
[13] Sarmiento A, McKellop HA, Llinas A,etal. Effect of loading and fracture motions on diaphyseal tibial fractures [J]. Journal of Orthopaedic Research, 1996,14(1): 80-84.
[14] Augat P, Burger J, Schorlemmer S,etal. Shear movement at the fracture site delays healing in a diaphyseal fracture model [J]. Journal of Orthopaedic Research, 2003,21(6): 1011-1017.
[15] Murphy CM, Haugh MG, O’Brien FJ. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering [J]. Biomaterials, 2010,31(3): 461-466.
[16] 袁翰, 梁金, 郑欣, 等. 取向蚕丝蛋白支架与间充质干细胞的复合培养 [J]. 实用骨科杂志, 2013,19(10): 900-903.
[17] Han L, Mao Z, Wu J,etal. Unidirectional migration of single smooth muscle cells under the synergetic effects of gradient swelling cue and parallel groove patterns [J]. Colloids and Surfaces B: Biointerfaces, 2013,111: 1-6.
[18] Hasirci V, Kenar H. Novel surface patterning approaches for tissue engineering and their effect on cell behavior [J]. 2006,1(1):73-90.
[19] McMahon RE, Wang L, Skoracki R,etal. Development of nanomaterials for bone repair and regeneration [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2013,101(2): 387-397.
[20] Gotoh Y, Tsukada M, Minoura N,etal. Synthesis of poly (ethylene glycol)-silk fibroin conjugates and surface interaction between L-929 cells and the conjugates [J]. Biomaterials, 1997,18(3): 267-271.
[21] Minoura N, Aiba SI, Gotoh Y,etal. Attachment and growth of cultured fibroblast cells on silk protein matrices [J]. Journal of Biomedical Materials Research, 1995,29(10): 1215-1221.
[22] Horan RL, Antle K, Collette AL,etal. In vitro degradation of silk fibroin [J]. Biomaterials, 2005,26(17): 3385-3393.
[23] Santin M, Motta A, Freddi G,etal.Invitroevaluation of the inflammatory potential of the silk fibroin [J]. Journal of Biomedical Materials Research, 1999,46(3): 382-389.
[24] Lee JH, Lee YJ, Cho HJ,etal. Guidance ofinvitromigration of human mesenchymal stem cells andinvivoguided bone regeneration using aligned electrospun fibers [J]. Tissue Engineering Part A 2014,20(15-16): 2031-2042.
[25] Chang JC, Fujita S, Tonami H,etal. Cell orientation and regulation of cell-cell communication in human mesenchymal stem cells on different patterns of electrospun fibers [J]. Biomedical Materials, 2013,8(5): 55002-55014.
[26] Kharaziha M, Fathi MH, Edris H. Development of novel aligned nanofibrous composite membranes for guided bone regeneration [J]. Journal of the Mechanical Behavior of Biomedical Materials, 2013,24: 9-20.
[27] Rho J-Y, Kuhn-Spearing L, Zioupos P. Mechanical properties and the hierarchical structure of bone [J]. Medical Engineering & Physics, 1998,20(2): 92-102.
The Mechanical Property and Human Mesenchymal Stem Cell Induction of Aligned and Random Electrospinning Fibrous Silk Fibroin Scaffolds
Yuan Han1Zheng Xin2Qiu Xushen2Chen Yixin2*
1(Drum Tower Clinical College of Integrative Medicine, Nanjing University of Traditional Chinese Medicine, Nanjing 210046, China)2(Department of Orthopedic Surgery, Drum Tower Hospital, Nanjing University, Nanjing 210008, China)
Due to its mechanical strength, biocompatibility and sterilizability, silk fibroin is frequently utilized as a natural bone-regeneration material. To improve its mechanical character and reinforce cell movement induction, a highly aligned electrospinning fibrous scaffold of PCL/silk fibroin blend was fabricated with a rotating collector. Scanning electron microscope images were analyzed and mechanical properties of the scaffold were investigated by tensile mechanical tests, and compared to non-oriented scaffolds. Furthermore, mesenchymal stem cells were planted on the scaffolds to investigate its biocompatibility and cell movement in-situ. Results shows that 91% fibers on the aligned fibroin scaffold were distributed between the dominant direction +/-10°. With ideal support for stem cell proliferation, the aligned fibrous scaffold could also induce cell elongation at a length of 236.46±82 μm and distribution along the dominant fiber direction with a narrow spreading angle at 6.57±4.45 °. In conclusion, this novel aligned fibroin scaffold could provide a moderate mesenchymal stem cell engraftment interface and speed-up the early stage cell movement toward the bone defect.
electrospinning; silk fibroin; mesenchymal stem cell; aligned fibrous scaffold; cell movement
10.3969/j.issn.0258-8021. 2015. 03.011
2014-06-11, 录用日期:2015-04-20
江苏省六大人才高峰项目(2012-WS-092);南京市卫生局项目(YKK13079,ZKX12016)
R318
A
0258-8021(2015) 03-0337-08
*通信作者(Corresponding author), E-mail:chenyixin93@126.com
